Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.27 no.3 Lima jul./set. 2016
http://dx.doi.org/10.15381/rivep.v27i3.11988
ARTÍCULOS PRIMARIOS
Toxicidad de Macroquistes de Sarcocystis aucheniae H. Wild en Ratones Domésticos (Mus musculus)
Toxic Effect of Macrocysts of Sarcocystis Aucheniae h. Wild in House Mice
Víctor Carhuapoma D.1,3, Nicasio Valencia M.2, Víctor Sanchez A.1
1 Centro de Investigación Científica Multidisciplinario de Ingeniería,
2 E.A.P. Zootecnia, Universidad Nacional de Huancavelica, Huancavelica, Perú
3 E-mail: yachayruacc@hotmail.com
RESUMEN
El objetivo del estudio fue determinar la toxicidad del inóculo lisado de macroquistes de Sarcocystis aucheniae (LMSA) en ratones caseros (n=36), a concentraciones de 5 y 10% (0, 50 y 100 µg de proteína por gramo de p.v.) y a dosis de 0.5 y 1.0 ml. Se evaluó la temperatura rectal, frecuencia respiratoria y tasa de supervivencia; así como alteraciones macroscópicas e histopatológicas en hígado, riñón, corazón y pulmón. Todos los ratones tratados murieron entre las 4 y 20 horas de la inoculación, presentando hipotermia, disnea y bradipnea. El riñón y el hígado fueron los órganos más afectados, mostrando severa hiperemia, degeneración tisular e hiperplasia. Los ratones del grupo testigo no presentaron alteraciones visibles ni muerte. Los resultados evidenciaron toxicidad y letalidad del inóculo lisado de macroquistes de Sarcocystis aucheniae en los ratones.
Palabras clave: Sarcocystis, macroquistes, inóculo, ratón, letalidad
ABSTRACT
The aim of the study was to determine the toxicity of lysate macrocysts inoculum of Sarcocystis aucheniae (LMSA) in house mice (n=36) at concentrations of 5 and 10% (0, 50 and 100 mg of protein per gram of body weight) in doses of 0.5 and 1.0 ml. Rectal temperature, respiratory rate and survival rate plus histopathological changes in liver, kidney, heart, and lung were evaluated. All treated mice died within 4 to 20 hours after inoculation, showing hypothermia, dyspnea and bradypnea. The kidney and liver were most affected organs, showing severe hyperemia, tissue degeneration and hyperplasia. The mice in the control group showed no visible abnormalities or death. The results showed toxicity and lethality due to the lysate macrocysts inoculum of Sarcocystis aucheniae in house mice.
Key words: Sarcocystis, macrocystis, inoculum, mouse, lethality
INTRODUCCIÓN
La crianza de los camélidos domésticos (alpacas y llamas) es una de las actividades de mayor importancia e impacto en el desarrollo socioeconómico de la población altoandina en el Perú. Se tiene el caso de Huancavelica, donde el 74% de la población vive en la zona rural y el 85% se dedica a esta actividad (Salvá et al., 2009). La carne de camélidos es rica en proteínas, correspondiendo 21.3% a la carne de alpaca y 24.8% a la carne de llama; además, contienen poca grasa y presentan un bajo contenido de colesterol (Saadoun y Cabrera, 2008).
Los camélidos de las zonas altoandinas se ven afectados por diversas enfermedades, entre ellas el parasitismo causado por Sarcocystis aucheniae (Guerrero et al., 2004; Uzuriaga et al., 2008). El género Sarcocystis incluye especies altamente patógenas para bovinos, ovinos, camélidos, caballos y cabras (Sam et al., 1998); además, se le encuentra parasitando animales silvestres como tejones, ratas, búfalos y monos, entre otros (Sam et al., 1998). La infección causada por S. aucheniae se traduce en importantes pérdidas económicas de la producción alpaquera derivada no solo por la disminución de la productividad animal, sino por la pérdida del valor comercial del animal y por los decomisos de las carcasas (Saadoun y Cabrera, 2008).
Mansilla (1993) sostiene que las sarcosistiosis es una enfermedad zoonótica parasitaria, donde las formas larvarias del parásito se localizan en los músculos y sistema nervioso central, sin aparente reacción del animal infectado. Se presume que ocurre la ruptura de algunos quistes en algún momento de la infección con probable liberación de productos tóxicos, pero no hay información científica sobre este en los procesos de sarcocistiosis crónica (Godoy et al., 2007). La actividad neurotóxica fue demostrada por Hiepe et al. (1981), denominando al producto como sarcocistina. Este producto ha sido considerado como una endotoxina de acción en músculo cardíaco y tejido nervioso gastrointestinal (Franklin et al., 2003). Estudios preliminares utilizando proteína de bradizoitos de macroquistes sonicados (5 mg/ ml) de S. aucheniae demostraron su acción letal en conejos (Sam et al., 1988; Jurado, 2009). Asimismo, existen evidencias de trastornos gastroentéricos en personas que consumieron carne cruda infectada con S. aucheniae y S. hominis (Lesk, 2000).
Los antecedentes mencionados no reportan sobre la concentración y la dosis letal del efecto de extractos de Sarcocystis en cobayos, ratas y conejos. Tampoco se dispone de información sobre el efecto biológico de S. aucheniae a nivel celular (histopatología) ni existen estudios en ratones domésticos, llamados también caseros (Mus musculus), hospederos intermediarios del parásito. Debido a esto, se planteó el presente estudio con el objetivo de determinar el grado de toxicidad del inóculo de lisado de macroquistes de S. aucheniae en ratones caseros.
MATERIALES Y MÉTODOS
El presente estudio se realizó por un periodo de seis meses, en el Laboratorio Central de Investigación, Área de Sanidad Animal, Universidad Nacional de Huancavelica, ubicado cerca de la ciudad de Huancavelica, Perú. La zona se encuentra a 3780 msnm, con temperaturas de 15 a 18 ºC y de 8 a 5 ºC.
Se obtuvieron macroquistes de S. aucheniae de alpacas infectadas naturalmente y que fueron sacrificadas en el camal local. Se recolectó la zona muscular del cuello y se llevó al laboratorio. La carne fue fileteada y con pinzas y bisturí se extrajeron macroquistes enteros que fueron sometidos a solución salina fosfatada (PBS) y conservados a 4 °C. El lisado de macroquistes (LMS) se obtuvo mediante el método descrito por Céspedes (2013) y Sam et al. (1988).
Se utilizaron 36 ratones domésticos (Mus musculus) machos, de 4 a 6 meses de edad, con peso promedio de 150 g y provenientes de las zonas altoandinas de la comunidad de Santa Bárbara, Huancavelica. Los ratones fueron instalados en jaulas y desparasitados. Luego fueron inoculados, vía subcutánea, con un lisado de macroquistes de S. aucheniae en dosis de 0.5 y 1 ml con una concentración de 100, 50 y 0 µg de proteína de macroquistes por gramo de peso vivo para los tratamientos 1, 2 y 3, respectivamente (n=12 ratones por tratamiento). En el grupo testigo se inyectó únicamente suero fisiológico.
Las evaluaciones se realizaron a los 4, 8, 10, 12 y 20 horas posinoculación. Se registró la temperatura rectal con un termómetro digital, la frecuencia respiratoria con ayuda de un estetoscopio, y el porcentaje de supervivencia. Se sacrificó un ratón por tratamiento en cada periodo de evaluación mediante incisión primaria, según Aluja (2002). El protocolo fue certificado por el Comité de Ética de Educación y Ciencias de la Salud para la Investigación de la Universidad Nacional de Huancavelica con resolución N° 0691-2014-CECSI-UNH. En la necropsia se tomaron muestras de pulmón, hígado, riñón y corazón para el examen histopatológico. Los tejidos fueron teñidos con hematoxilina-eosina. Se hicieron cortes de 4-5 micras de espesor y la lectura histopatológica se hizo en microscopio óptico, según Vilca et al. (2013).
Se utilizó el diseño completamente al azar y la prueba de Tukey (p<0.05) para la comparación de medias. Los datos se procesaron en el programa de SAS v. 7.
RESULTADOS
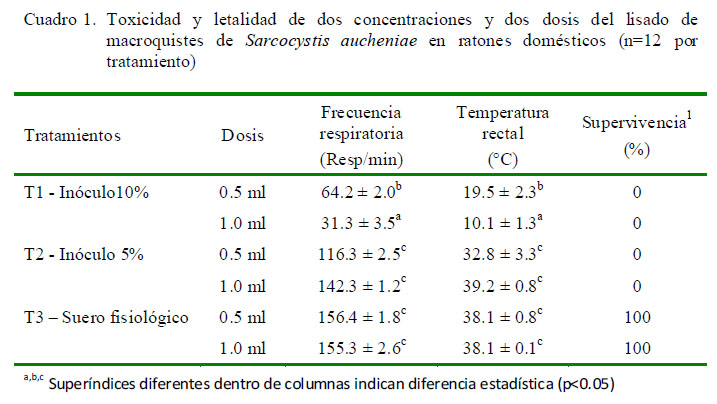
Los ratones sometidos al tratamiento 1, con inóculo 10% y a dosis 1 ml, presentaron una mayor toxicidad y mortalidad al lisado del inóculo de macroquistes, presentando temperatura corporal disminuida y alteración en la frecuencia respiratoria, llegando a morir entre las 4 y 6 h de la inoculación (Cuadro 1). Los ratones del tratamiento 2 con inóculo 5% y a dosis 0.5 ml, presentaron los efectos tóxicos y mortalidad a partir de las 8 a 10 h de la inoculación, muriendo dentro de las 20 horas de la inoculación. En ambos tratamientos se observó inestabilidad, anorexia, postración y diarrea intensa. Los ratones del tratamiento 3 (testigo, inoculados con suero fisiológico) no presentaron signos clínicos de toxicidad.
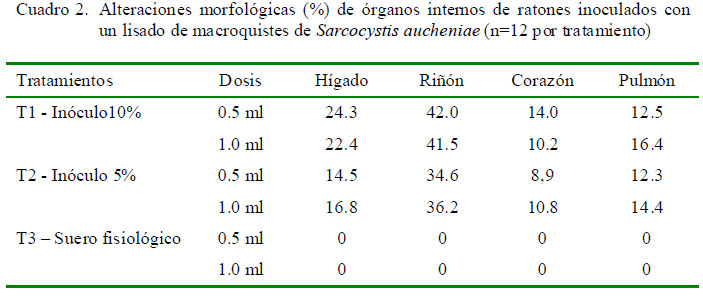
Los ratones de los tratamientos 1 y 2 que recibieron el inóculo presentaron diversas alteraciones morfológicas e histopatológicas, tales como congestión, necrosis, alteraciones vasculares y degeneración celular. Asimismo, en los riñones hubo presencia de tumefacción turbia del epitelio tubular cortical renal y severa congestión e hinchazón aguda del epitelio de los tubulis, en el hígado se apreció congestión y pérdida de la citoarquitectura trabecular, en tanto que en pulmones y corazón se observó alteraciones morfológicas como incremento de tamaño y cambio de color tisular. En suma, el riñón y el hígado fueron los órganos más afectados. Por otro lado, los ratones del tratamiento testigo no presentaron alteraciones evidentes (Cuadro 2).
DISCUSIÓN
Los signos de toxicidad y letalidad encontrados en los ratones domésticos por efecto de la inoculación del LMS fueron compatibles con los reportados por Sam et al. (1998) y Granados et al. (2007). Las alteraciones clínicas y hallazgos histopatológicos observados en los tratamientos 1 y 2 se deben a las propiedades hemolíticas, hemaglutinantes y neuroparalizantes de los macroquistes (Franklin et al., 2003).
El tiempo de supervivencia por efecto del inóculo fue similar a las 12-27 h observadas por Vilca et al. (2013) al inocular conejos inoculados con lisados de macroquistes obtenidos de carne de alpaca sometida a procesos de ahumado y curado.
Los signos clínicos y las alteraciones histopatológicas en los ratones de los grupos tratados fueron similares a los observados en el estudio de Sam et al. (1998) utilizando extractos de S. aucheniae en conejos a dosis de 50 mg/ml, así como en otros trabajos (Leguía et al., 1990; Mansilla, 1993; Céspedes et al., 2013). Las lesiones en riñones e hígado fueron similares con el reporte de Céspedes et al. (2013).
El mayor grado de lesiones observado en riñón e hígado fue consecuencia de la actividad neurotóxica, que altera las membranas celulares y libera mediadores inflamatorios que producen hipertermia (Lesk, 2000; Godoy et al., 2007).
CONCLUSIONES
-
El inóculo de lisado de macroquistes de Sarcocystis aucheniae fue tóxico y letal para los ratones domésticos, quienes no sobrevivieron por más de 20 horas de la inoculación.
-
El mayor grado de lesiones histopa tológicas se observó en el riñón y el hígado.
LITERATURA CITADA
1.Aluja A. 2002. Técnicas de necropsia en animales domésticos. México DF: El Manual Moderno. 103 p. [ Links ]
2. Céspedes C, Vilca M, Ramos D, Sam R, Lucas J. 2013. Saneamiento y detoxificación de carne de alpaca (Vicugna pacos) con sarcocistiosis mediante tratamientos físicos y químicos (marinado y salazón de uso doméstico). Rev Inv Vet Perú 24: 404-410. doi: 10.15381/rivep.v24i3.2591 [ Links ]
3. Franklin RP, Mackay RJ, Gillis KD, Tanhauser SM, Ginn PE, Kennedy TJ. 2003. Effect of a single dose of ponazuril on neural infection and clinical disease in Sarcocystis neuronachallenged interferon-gamma knockout mice. Vet Parasitol 114: 123-130. [ Links ]
4. Guerrero C. Hernández J, Alva J. 2004. Sarcocystis en alpacas. Rev Fac Med Vet Lima 21: 69-76. [ Links ]
5. Godoy R, Vilca M, Gonzáles A, Leyva V, Sam R. 2007. Saneamiento y detoxificación de carne de llama (Lama glama) infectada con Sarcocystis aucheniae mediante cocción, horneado, fritura y congelado. Rev Inv Vet Perú 18: 51-56. doi: 10.15381/rivep.v18i1.1275 [ Links ]
6. Granados L, Vilca M, Sam R. 2007. Saneamiento y detoxificación de carne de llama (Lama glama) infectada con Sarcocystis aucheniae mediante métodos químicos: marinado, ahumado, curado seco y curado húmedo. Rev Inv Vet Perú 18: 57-63. doi: 10.15381/rivep.v18i1.1277 [ Links ]
7. Jurado J. 2009. Respuesta inmune en conejos a dos tamaños de Sarcocystis aucheniae. Tesis de Médico Veterinario. Lima: Univ Nacional Mayor de San Marcos. 53 p. [ Links ]
8. Lesk A. 2000. Introduction to protein architecture: the structural biology of proteins. UK: Cambridge Institute for Medical Research, University of Cambridge. 347 p. [ Links ]
9. Leguía G, Guerrero C, Sam R, Rosadio R. 1990. Patología de Sarcocystis aucheniae en alpacas infectadas experimentalmente. MV Rev Cienc Vet 6(3): 11-13. [ Links ]
10. Mansilla D. 1993. Efecto histopatológico del lisado de macroquistes de Sarcocystis aucheniae en ratones, conejos y cobayos. Tesis de Médico Veterinario. Lima: Univ Nacional Mayor de San Marcos. 60 p. [ Links ]
11. Sam R, Mansilla I, Morales C, Ramírez A. 1998. Efecto tóxico de macroquistes de Sarcocystis aucheniae en ratones, cobayos y conejos. Rev Inv Pec IVITA 9(2): 11-18. [ Links ]
12. Saadoun A, Cabrera MC. 2008. A review of the nutritional content and technological parameters of indigenous sources of meat in South America. Meat Sci 80: 570-581. doi: 10.1016/j.meatsci.2008.03.027 [ Links ]
13. Salvá BK, Zumalacárregui JM, Figueira AC, Osorio MT, Mateo J. 2009. Nutrient composition and technological quality of meat from alpacas reared in Peru. Meat Sci 82: 450455. doi: 10.1016/j.meatsci.2009.02.015 [ Links ]
14. Uzuriaga M, Sam R, Manchego A, Alvarado A. 2008. Desarrollo de estadios asexuales de Sarcocystis aucheniae en cultivo de células. Rev Inv Vet Perú 19: 49-53. [ Links ]
15. Vilca M, Durán J, Ramos D, Lucas J. 2013. Saneamiento y eliminación de la toxicidad de carne de alpaca (Vicugna pacos) con Sarcosistiosis mediante ahumado y curado. Rev Inv Vet Perú 2013; 24 (4): 537-543. doi: 10.15381/rivep.v24i4.2740 [ Links ]
Recibido: 30 de octubre de 2015
Aceptado para publicación: 30 de marzo de 2016