Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.27 no.4 Lima out./Dez. 2016
http://dx.doi.org/10.15381/rivep.v27i4.11614
http://dx.doi.org/10.15381/rivep.v27i4.11614
ARTÍCULOS PRIMARIOS
Daño Inflamatorio y Cambios Cariométricos en Tejido Cardiaco de Ratones Experimentalmente Infectados con Trypanosoma cruzi
Inflammatory Damage and Karyometric Changes in Cardiac Tissue from Mice Experimentally Infected with Trypanosoma cruzi
Julio Larenas Herrera1,3, Catalina R ámila Garrido1, Claudio Zúñiga Marti1, María Teresa Paláu Castaño2, Ulises Vergara Castillo1,4
1 Departamento de Patología Animal, Facultad de Ciencias Veterinarias y Pecuarias, Universidad de Chile, Santiago de Chile, Chile
2 Escuela de Nutrición, Universidad Autónoma de Chile, Santiago de Chile, Chile
3 E-mail: jlarenas@uchile.cl
4 E-mail: uvergara@uchile.cl
RESUMEN
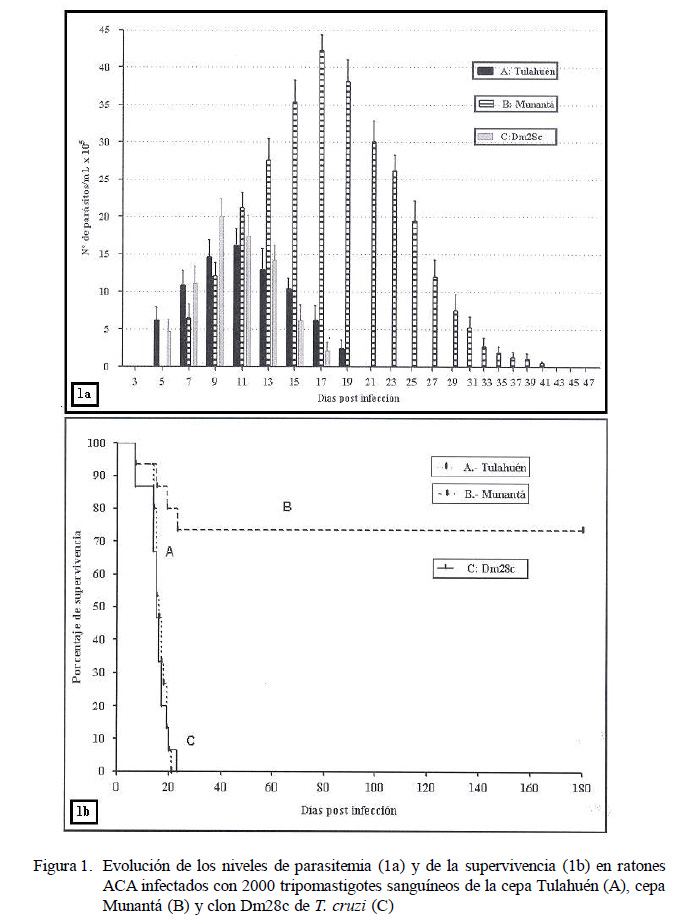
En el presente trabajo se evaluaron las alteraciones cariométricas causadas por la infección con la cepa Munantá, la cepa Tulahuén y el clon Dm28c de Trypanosoma cruzi en el tejido cardiaco de ratones ACA experimentalmente infectados con 2000 tripomastigotes sanguíneos del parásito y su relación con el daño inflamatorio, número de seudoquistes y posible asociación con los niveles de parasitemia y mortalidad acumulada. Los resultados mostraron un aumento significativo del tamaño nuclear en el tejido cardiaco de los ratones infectados, en comparación con los ratones controles no infectados con T. cruzi. Los ratones infectados con la cepa Tulahuén o con el clon Dm28c mostraron una prepatencia sanguínea de cinco días y nivel máximo de parasitemia de 16.23 x 105 ± 2.21 x 105 parásitos/ml a los 11 días pos-infección – p.i. – (cepa Tulahuén) y de 20.10 x 105 ± 2.25 x 105 parásitos/ml a los nueve días (clon Dm28c), en tanto que los ratones infectados con la cepa Munantá mostraron una prepatencia de siete días y un nivel máximo de parasitemia significativamente más elevado (42.57 x 105 ± 2.10 x 105 parásitos/ml; p<0.001) a los 17 días p.i. Los ratones infectados con Munantá presentaron un 75% de sobrevida más allá de los seis meses de infección, en tanto que los ratones infectados con la cepa Tulahuén y con el clon Dm28c mostraron 100% de mortalidad acumulada a los 21 y 23 días p.i., respectivamente. El análisis histopatológico sugiere (al menos al día 19 p.i.) una asociación entre el parasitismo intracelular (seudoquistes), la magnitud del infiltrado inflamatorio mononuclear, la severidad del daño en el tejido cardiaco y la mortalidad de los ratones infectados con la cepa Tulahuén y el clon Dm28c, a pesar del bajo nivel de parasitemia, de manera que no siempre existe una asociación entre los niveles de parasitemia y la resistencia o susceptibilidad a la infección con T. cruzi. Finalmente, el estudio cariométrico sugiere que no existe asociación entre el aumento del tamaño nuclear observado en el tejido cardiaco de los ratones infectados con T. cruzi y la virulencia o características biológicas de los aislados del parásito.
Palabras clave: enfermedad de Chagas, cepas de Trypanosoma cruzi, estudio histopatológico, infiltrado inflamatorio, parámetros nucleares
ABSTRACT
In this study were evaluated the karyometric alterations caused by strains Munantá and Tulahuén and clon Dm28c of Trypanosoma cruzi in cardiac tissue in ACA mice infected experimentally with 2000 blood tripomastigotes of the parasite and the relationship with inflammatory damage, number of pseudocysts and correlation with parasitemia levels and mortality. Results showed a significant increase in the nuclear size in cardiac tissue of infected mice compared with control mice. Infected mice with Tulahuén strain or clon Dm28c showed a 5-day blood prepatency, with a maximum parasitemia levels of 16.23 x 105 ± 2.21 x 105 parasites/ml on day 11 post infection – p.i. –(Tulahuén strain) and 20.10 x 105 ± 2.25 x 105 parasites/ml on day 9 p.i. (clon Dm28c) while mice infected with Munantá strain showed a 7-day prepatency and a significantly higher maximum parasitemia level (42.57 x 105 ± 2.10 x 105 parasites/ml; p<0.001) at 17 days p.i. Mice infected with Munantá showed a 75% survival beyond six months p.i. as compared to 100% mortality in mice infected with Tulahuén strain and clon Dm28c at 21 and 23 days p.i. respectively. The histopathological analysis suggested a correlation at least at day 19 p.i. between intracellular parasites (pseudocysts), the magnitude of mononuclear inflammatory infiltrate, the severity of damage in cardiac tissue and mortality of infected mice with Tulahuén strain and clon Dm28c despite the low level of parasitemia, so not always exists a correlation between the levels of parasitemia and resistance or susceptibility to infection with T. cruzi. Finally, the kariometric study indicates that there is no correlation between an increased nuclear size in cardiac tissue and virulence or biological characteristics of the isolated parasite.
Key words: Chagas disease, Trypanosoma cruzi strains, histopathological study, inflammatory infiltrate, nuclear parameters
INTRODUCCIÓN
La enfermedad de Chagas, llamada también tripanosomiasis americana, es una infección parasitaria producida por el protozoo hemoflagelado Trypanosoma cruzi y que, debido a su amplia distribución y alta prevalencia en el hombre y diversos animales, constituye un importante problema de salud pública en Centro y Sudamérica. La enfermedad es una condición inflamatoria crónica y potencialmente mortal y se estima que entre 15 y 18 millones de personas se encuentran infectadas por el parásito y que entre 75 y 90 millones se encuentren expuestas a la infección, desde el sur de Estados Unidos hasta el cono sur de Latinoamérica (OMS, 2010; Rassi et al., 2010). En Chile, el área endémica se extiende desde la región de Arica y Parinacota por el norte a la región del Libertador General Bernardo O’Higgins por el sur, incluyendo la Región Metropolitana (ISP, 2014).
A más de cien años de su descripción, la enfermedad de Chagas continúa siendo una infección compleja y, a pesar que las diversas estrategias orientadas al control de los insectos vectores han logrado disminuir la incidencia de la enfermedad en varios países de América Latina (OMS, 2010), la globalización del comercio y el aumento de las migraciones de regiones endémicas a no endémicas han convertido esta infección parasitaria en un problema latente de salud, existiendo un número creciente de pacientes afectados en países no-endémicos como Australia, Canadá, Japón y España (Clayton, 2010; Rodríguez y Albajar, 2010; Kowalska et al., 2011).
En América Latina, el parásito es transmitido a hospederos vertebrados a través de insectos hematófagos de los géneros Triatoma, Panstrongilus y Rhodnius (Hemiptera; Reduviidae). La infección afecta al humano y a más de 150 especies de animales domésticos, sinantrópicos y mamíferos selváticos (Rodríguez y Albajar, 2010). Además de la forma habitual de infección a través del insecto hematófago, los humanos pueden infectarse por transfusión sanguínea, por transmisión congénita a través de la placenta, trasplante de órganos, accidentes de laboratorio y por la ingestión de alimentos contaminados con deyecciones de insectos infectados.
El modelo de infección experimental en ratones ha sido uno de los más ampliamente utilizados en el estudio de la infección con T. cruzi. La evidencia experimental obtenida utilizando el modelo murino sugiere que el desarrollo y la evolución de la infección dependen tanto de factores asociados al parásito (virulencia y tropismo celular de distintos aislados o cepas de T. cruzi, dosis o número de parásitos en la infección inicial, sitio o tejido de ingreso de los mismos) (Andrade et al., 2010), como de factores propios del hospedero (sexo, edad, repertorio genético asociado a los distintos mecanismos de respuesta inmune) (Zúñiga et al., 2012a). Las cepas de ratones difieren en cuanto a la susceptibilidad a la infección con T. cruzi, existiendo, al parecer, un complejo control genético de los niveles de parasitemia y de la supervivencia de los animales infectados (Wrightsman et al., 1982). A pesar de ello, aún no se conocen con certeza los factores directamente involucrados en los fenómenos de resistencia o susceptibilidad a la infección (Zúñiga et al., 2012b).
El modelo murino ha sido utilizado no solo en el estudio de los mecanismos de transmisión de la enfermedad congénita, sino también para demostrar la existencia de cambios en la morfología nuclear de células trofoblásticas asociados al daño placentario (Sala et al., 2008) y determinar cambios nucleares en los acinos y conductos estriados de la glándula sublingual (Albuquerque et al., 2008).
Basados en estos antecedentes, en el presente trabajo se analizan las alteraciones nucleares o cariométricas (diámetro, perímetro, superficie, volumen, relación superficie/ volumen) de las células cardiacas de ratones ACA, experimentalmente infectados con las cepas Munantá, Tulahuén y clon Dm28c de T. cruzi, así como su asociación con el daño tisular producido por la infección parasitaria.
MATERIALES Y MÉTODOS
Ratones y Parásitos
Tres grupos de 15 ratones hembras de la cepa ACA de 10 semanas de edad fueron infectados con 2000 tripomastigotes sanguíneos de la cepa Tulahuén, de la cepa Munantá o del clon Dm28c de Trypanosoma cruzi. Estas cepas o aislados del parásito han sido mantenidas in vivo en la unidad de mantención de animales de experimentación del Laboratorio de Inmunología de la Facultad de Ciencias Veterinarias y Pecuarias de la Universidad de Chile, mediante el traspaso semanal de tripomastigotes sanguíneos en ratones de la cepa Balb/c.
Modelo de Infección Experimental
Mediante punción cardiaca se extrajo 0.6 ml de sangre de un ratón Balb/c infectado con cada una de las cepas o del clon Dm8c de T. cruzi. Los ratones fueron sacrificados utilizando CO2 vía inhalatoria, cumpliendo con las normas bioéticas y de bioseguridad establecidas en los Manuales de Normas de Bioética y de Bioseguridad de la Comisión Nacional de Investigación Científica y Tecnológica (CONICYT).
Los procedimientos de infección experimental de ratones, extracción de sangre y extracción de tejidos luego del sacrificio de los animales se realizaron en un gabinete de bioseguridad Forma Scientific Class IIA/B3 (USA). El manejo adecuado de los animales y el cumplimiento de los protocolos fueron certificados por los comités de Bioética Animal y de Bioseguridad de la Facultad de Ciencias Veterinarias y Pecuarias de la Universidad de Chile (Certificado 23-11-2012).
La sangre fue colocada en tubos estériles con 0.1 ml de citrato de sodio como anticoagulante. Se tomó 10 µl y fue diluida en 490 µl de suero fisiológico estéril y se hizo un recuento de parásitos en la cámara de Neubauer. De esta forma, se determinó la cantidad total de parásitos en los 0.6 ml de sangre inicial con el fin de realizar las diluciones necesarias, en suero fisiológico estéril, para obtener 2000 parásitos en 0.2 ml. Esta dosis fue inoculada en cada ratón de los grupos experimentales.
Se utilizó, además, como control negativo, un grupo de cinco ratones hembras de la cepa ACA de 10 semanas de edad, que se inocularon con 0.2 ml de sangre de ratones Balb/c no infectados y diluida de manera similar a la de aquella proveniente de ratones infectados. Estos ratones se sangraron en forma paralela a los grupos infectados para establecer que las alteraciones y eventual muerte de los animales experimentales se debe a la infección con T. cruzi y no a variables como una eventual anemia provocada por las sucesivas sangrías realizadas durante el desarrollo del estudio.
Estudio de Parasitemia
Para determinar la prepatencia y la eventual variación en el número de parásitos libres en circulación, los ratones experimentalmente infectados se sangraron cada dos días a partir del tercer día pos-infección (p.i.). Los niveles de parasitemia se analizaron hasta hacerse negativos o hasta la muerte de los ratones infectados. La sangre se recolectó de la vena caudal en tubos de microhematocrito heparinizados, fue centrifugada a 700 g por 5 min y se dejó reposar por 30 min en estufa a 37 ºC, para medir el volumen de sangre en cada tubo. Finalmente, cada muestra fue colocada en un portaobjeto para determinar el número de parásitos en 50 campos elegidos al azar, utilizando un aumento de 400X. Los resultados se expresaron como el promedio de parasitemia del grupo y la desviación estándar correspondiente, de acuerdo al método descrito por de Arias y Ferro (1988).
Estudio Histopatológico
El daño histopatológico y los cambios en los parámetros nucleares se determinaron en muestras de tejido cardiaco de ratones sacrificados los días 7, 15 y 19 p.i. en cada grupo experimental y del grupo control. Los tejidos fueron fijados en Bouin-formalina 10% e incluidos en parafina (López et al., 1982). Se hicieron cortes de 5 µm que fueron teñidos con hematoxilina-eosina.
Se determinó la magnitud y las características del daño tisular y el número de células mononucleares en los focos inflamatorios detectados (400X). Además, se cuantificó el número de seudoquistes parasitarios en 50 campos elegidos al azar (400X). El estudio de las alteraciones nucleares o cariométricas (diámetro, perímetro, superficie, volumen y relación superficie/volumen) se realizó en 30 campos elegidos al azar (1000X). En cada núcleo se midió el largo y ancho y con dichas medidas se calculó el diámetro medio, perímetro, superficie, volumen, y relación superficie volumen.
La captura y digitalización de imágenes se realizó utilizando el programa Motic MCCamera 2.0, y la cuantificación de células se determinó utilizando el Programa Image J 1.48 (National Institute of Health, EEUU).Análisis Estadístico
Los resultados de los niveles máximos de parasitemia, número de células inflamatorias mononucleares y número de seudoquistes se analizaron mediante un análisis de varianza y el análisis de supervivencia se realizó de acuerdo al método de Kaplan y Meier (1958), en ambos casos utilizando el programa Graph Pad Prism v. 5.0. El análisis de los parámetros nucleares se realizó mediante la prueba no paramétrica de KruskalWallis (Sala et al., 2008), utilizando el software InfoStat (Di Rienzo et al., 2008).
RESULTADOS
Niveles de Parasitemia y Mortalidad
En la Figura 1 se muestra la evolución de los niveles de parasitemia (1a) y del porcentaje de supervivencia (1b) como expresión del desarrollo de la infección en los ratones ACA experimentalmente infectados. El periodo de prepatencia sanguínea fue de 5 días para la cepa Tulahuén y el clon Dm28c, y de 7 días para la cepa Munantá (1a). El nivel máximo de parasitemia (42.57 x 105 ± 2.10 x 105 parásitos/ml) alcanzado por los ratones infectados con la cepa Munantá a los 17 días p.i. fue significativamente más alto (p<0.001) que el nivel máximo (16.23 x 105 ± 2.21 x 105 parásitos/ml) alcanzado por los ratones infectados con la cepa Tulahuén a los 11 días p.i. y el nivel máximo (20.10 x 105 ± 2.25 x 105 parásitos/ml) alcanzado por el clon Dm28c a los 9 días p.i.
Los ratones infectados con la cepa Tulahuén y con el clon Dm28c presentaron 100% de mortalidad acumulada a los 21 y 23 días p.i., respectivamente (Fig. 1b), mientras que el grupo de ratones infectados con la cepa Munantá solo presentó el 25% de mortalidad en el mismo periodo. Asimismo, 75% de estos ratones sobrevivió más allá de los seis meses p.i.
Estudio Histopatológico
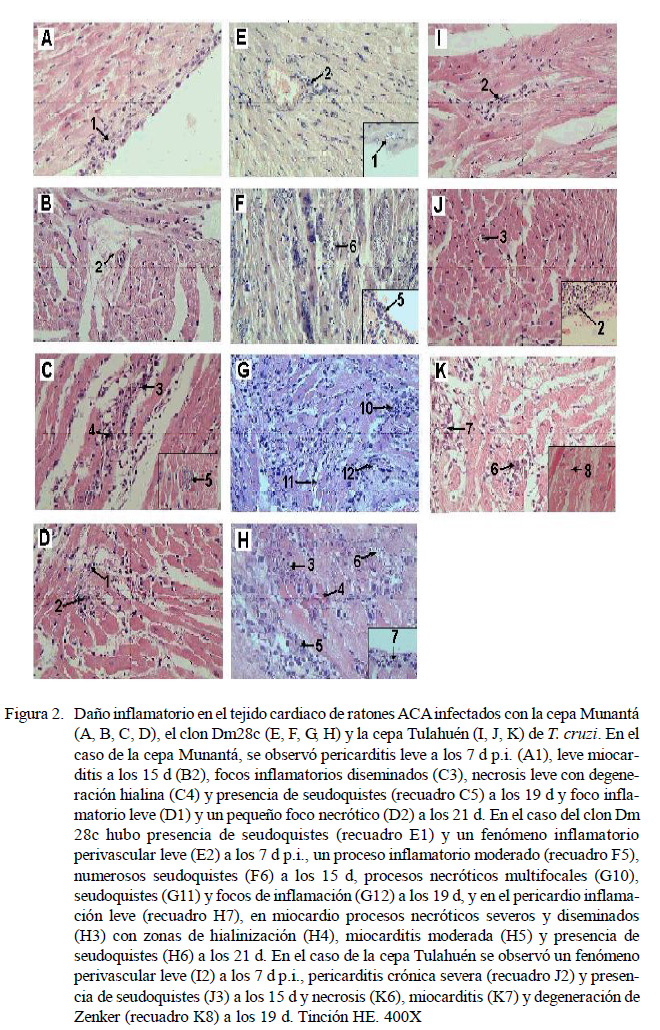
En el día 7 p.i., se detectó un leve proceso inflamatorio e infiltrado mononuclear en el pericardio de los ratones infectados con la cepa Munantá (Fig. 2A), con ausencia de focos inflamatorios y escasa infiltración mononuclear en el miocardio. Asimismo, en el caso del tejido cardiaco de los ratones infectados con el clon Dm28c (Fig. 2E) y con la cepa Tulahuén (Fig. 2I) se detectó un leve fenómeno inflamatorio perivascular e infiltración de células mononucleares, pero sin evidencia de pericarditis.
En el día 15 p.i., los ratones infectados con la cepa Munantá presentaron un pericardio sin daño aparente, mientras en el miocardio se observó la presencia de focos inflamatorios (Fig. 2B). En el caso de los ratones infectados con el clon Dm28c (Fig. 2F), hubo mayor daño inflamatorio y necrosis, zonas de calcificación y numerosos seudoquistes, en tanto que en los ratones infectados con la cepa Tulahuén se observó una pericarditis crónica severa y presencia de seudoquistes (Fig. 2J).
En el día 19 p.i., se observó mayor daño tisular en el tejido cardiaco de ratones infectados con el clon Dm28c (Fig. 2G), con procesos necróticos multifocales, presencia de seudoquistes e inflamación. En los ratones infectados con la cepa Munantá se observaron procesos inflamatorios diseminados y focales en el pericardio, mientras el miocardio (Fig. 2C) mostró focos inflamatorios diseminados y necrosis leve, con degeneración hialina de la fibra muscular y presencia de seudoquistes. En los ratones infectados con
Figura 2. Daño inflamatorio en el tejido cardiaco de ratones ACAinfectados con la cepa Munantá (A, B, C, D), el clon Dm28c (E, F, G, H) y la cepa Tulahuén (I, J, K) de T. cruzi. En el caso de la cepa Munantá, se observó pericarditis leve a los 7 d p.i. (A1), leve miocarditis a los 15 d (B2), focos inflamatorios diseminados (C3), necrosis leve con degeneración hialina (C4) y presencia de seudoquistes (recuadro C5) a los 19 d y foco inflamatorio leve (D1) y un pequeño foco necrótico (D2) a los 21 d. En el caso del clon Dm 28c hubo presencia de seudoquistes (recuadro E1) y un fenómeno inflamatorio perivascular leve (E2) a los 7 d p.i., un proceso inflamatorio moderado (recuadro F5), numerosos seudoquistes (F6) a los 15 d, procesos necróticos multifocales (G10), seudoquistes (G11) y focos de inflamación (G12) a los 19 d, y en el pericardio inflamación leve (recuadro H7), en miocardio procesos necróticos severos y diseminados (H3) con zonas de hialinización (H4), miocarditis moderada (H5) y presencia de seudoquistes (H6) a los 21 d. En el caso de la cepa Tulahuén se observó un fenómeno perivascular leve (I2) a los 7 d p.i., pericarditis crónica severa (recuadro J2) y presencia de seudoquistes (J3) a los 15 d y necrosis (K6), miocarditis (K7) y degeneración de Zenker (recuadro K8) a los 19 d. Tinción HE. 400X la cepa Tulahuén (Fig. 2K) se detectaron miocarditis, necrosis y degeneración de Zenker.
En el día 21 p.i., el pericardio de los ratones infectados con la cepa Munantá tenía una apariencia normal y focos inflamatorios y necróticos en el miocardio (Fig. 2D). Los ratones infectados con el clon Dm28c presentaron seudoquistes, inflamación, procesos necróticos severos y diseminados, con zonas de hialinización y degeneración de Zenker en el miocardio (Fig. 2H) y un proceso inflamatorio leve en el pericardio (Fig. 2H).
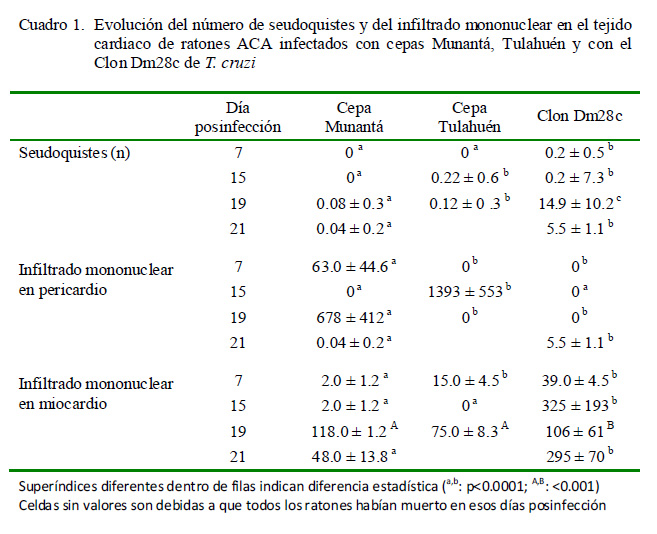
En el Cuadro 1 se muestra la evolución del número de seudoquistes y del infiltrado inflamatorio en 50 campos elegidos al azar en el tejido cardiaco de los tres grupos experimentales. Los ratones infectados con el clon Dm28c presentaron un número significativamente más elevado de seudoquistes durante el periodo experimental (p<0.0001).
A nivel de pericardio solo se detectaron células inflamatorias en los ratones infectados con la cepa Munantá en los días 7 y 19 p.i., infiltrado inflamatorio mononuclear en ratones infectados con la cepa Tulahuén en el día 15 p.i., e infiltración inflamatoria en los ratones infectados con el clon Dm28c en el día 21 p.i. Por otro lado, en el miocardio se observó un número significativamente más elevado de células inflamatorias en los ratones infectados con el clon Dm28c que con las cepas Tulahuén y Munantá (Cuadro 1).
Estudio Cariométrico
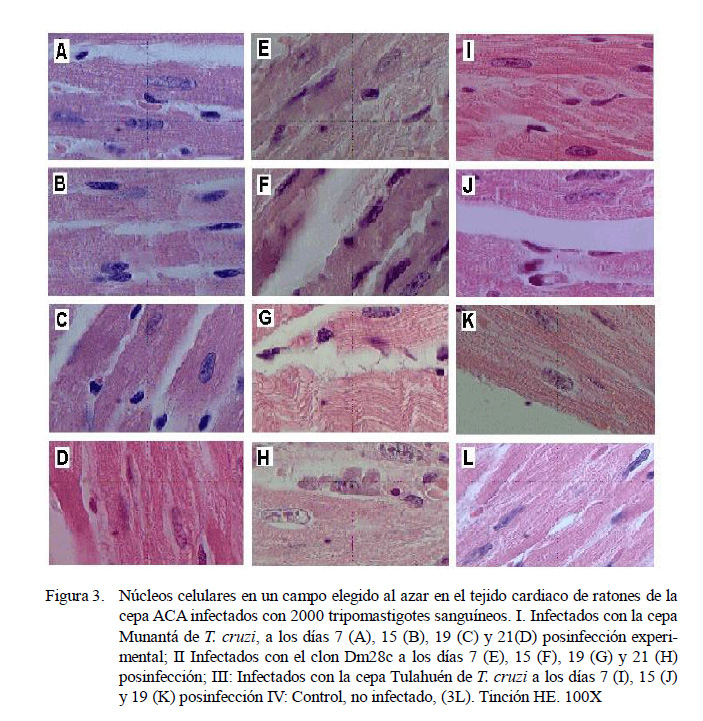
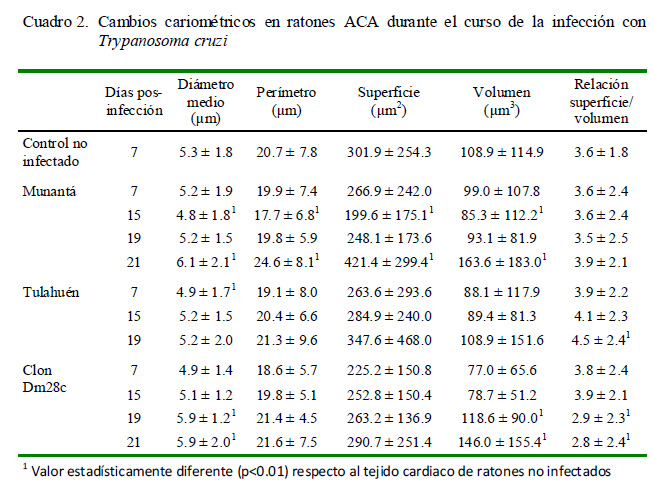
La Figura 3 muestra las eventuales alteraciones nucleares o cariométricas asociadas al daño inflamatorio producido por la infección con T. cruzi los días 7, 15, 19 y 21 p.i. en los ratones experimentalmente infectados con la cepa Munantá (Figs. 3A, B, C y D, respectivamente) y con el clon Dm28c (Figs. 3E, F, G y H, respectivamente). Asimismo, las Figs. 3I, 3J y 3K muestran los núcleos de los cardiomiocitos de los días 7, 15, y 19 p.i. de los ratones infectados con la cepa Tulahuén. La Fig. 3L muestra los núcleos celulares en el tejido cardiaco de los ratones control, no infectados, con T. cruzi.
El Cuadro 2 muestra los resultados obtenidos al comparar los cambios nucleares observados en los ratones ACA experimentalmente infectados con T. cruzi con aquellos observados en los ratones control (no infectados). El análisis estadístico, mediante la prueba no paramétrica de Kruskal-Wallis, permitió establecer que existe un aumento significativo en el diámetro y el volumen de los núcleos celulares en el tejido cardiaco de los ratones infectados, en particular a los 21 días p.i. con la cepa Munantá y el clon Dm28c (p<0.01).
DISCUSIÓN
La Enfermedad de Chagas es una infección parasitaria cuyas distintas formas de expresión clínica y la severidad del daño nervioso, cardiaco y digestivo (Rassi et al., 2010; Ribeiro Machado y Pinto Días, 2012) parecen obedecer a una compleja red de eventos que acompañan, tanto a la presencia del parásito en distintos tejidos como al desarrollo de una respuesta inmune protectora y una respuesta autoinmune (Kierszenbaum, 1999, 2005), y conducen finalmente a daño tisular a medida que progresa el curso de la infección y la enfermedad. Así, los resultados del estudio histopatológico permiten confirmar que, como se ha sugerido, el parasitismo intracelular y el daño tisular producido por el infiltrado inflamatorio mononuclear que acompaña a la infección dependen no solo del repertorio genético del hospedero, sino también de las características biológicas del aislado o cepa del parásito utilizado en la infección experimental (Zuñiga et al, 2007; Albuquerque et al., 2008; Sala et al., 2008).
Los ratones infectados con la cepa Munantá mostraron un escaso número de seudoquistes, miocarditis y pericarditis leve y solo 25% de mortalidad, a pesar de que sus niveles de parasitemia fueron significativamente más elevados (p<0.001) que los alcanzados por los ratones infectados con la cepa Tulahuén y el clon Dm28c, que presentaron 100% de mortalidad acumulada a la tercera semana p.i. Por otro lado, aun cuando los animales infectados con Tulahuén y clon Dm28c presentaron una prepatencia de cinco días y similares niveles de parasitemia y de mortalidad acumulada, los ratones infectados con el clon Dm28c presentaron mayor daño tisular con focos necróticos severos y un número significativamente más elevado de seudoquistes (p<0.0001), que los otros que presentaron miocarditis, pericarditis y número de seudoquistes similares a lo previamente descrito (Zuñiga et al., 2007).
En los casos de transmisión congénita de la enfermedad de Chagas en humanos, se ha demostrado la existencia de alteraciones placentarias que incluyen la presencia de nidos de amastigotes, áreas de necrosis, parásitos en fibroblastos coriónicos y mesénquima sub-amniótico del sinus marginal e infiltrado inflamatorio que puede inducir apoptosis de células placentarias y ruptura de la barrera trofoblástica, con la consiguiente liberación de tripomastigotes y riesgo de infección del embrión o feto (Garcia-Lloret et al., 2000; Redline, 2006).
En el modelo murino de transmisión congénita de la infección con T. cruzi se ha observado, además, la existencia de alteraciones en la morfología nuclear de las células trofoblásticas gigantes y de las células trofoblásticas de la zona esponjosa, asociadas al daño placentario en hembras A.Sw intraperitonealmente infectadas con distintas cepas del parásito (Sala et al., 2008). El análisis de las alteraciones nucleares observadas en las células cardiacas de las hembras ACA infectadas con distintas cepas o aislados de T. cruzi muestran que el parásito induce una disminución en el tamaño del núcleo en las primeras dos semanas de infección, para luego inducir un aumento significativo del tamaño nuclear, a partir del día 15
Aumentos similares en el tamaño nuclear se han obtenido en tejido cardiaco, hígado y bazo de machos Balb/c infectados con el clon Brenner B5CL (Rodrigues et al., 2013).
Los resultados muestran que, a pesar que en las primeras dos semanas de infección los tres grupos de ratones presentan sólo un leve daño tisular y un escaso número de seudoquistes y de células inflamatorias en el tejido cardiaco, los ratones infectados con la cepa Tulahuén y con el clon Dm28c acumulaban una mortalidad del 50%, significativamente más elevada que el escaso 14% de mortalidad acumulado en los ratones infectados con la cepa Munantá, a pesar del elevado nivel de parásitos libres en circulación que ellos presentaban en el mismo periodo.
Los resultados sugieren que, al menos al día 19 p.i., existiría una asociación entre el parasitismo intracelular (seudoquistes), la magnitud del infiltrado inflamatorio mononuclear, la severidad del daño en el tejido cardiaco y la mortalidad de los ratones infectados con la cepa Tulahuén y con el clon Dm28c, a pesar del bajo nivel de parasitemia, pues no siempre existe una asociación entre los niveles de parasitemia y la resistencia o susceptibilidad a la infección con T. cruzi (Minoprio et al.,1989; Hoft et al., 1993), así como tampoco existe asociación entre la inducción de un aumento del tamaño nuclear en el tejido cardiaco y la virulencia o características biológicas de los aislados del parásito, aquí utilizados en la infección experimental de ratones ACA.
CONCLUSIONES
Se observó una asociación entre la presencia de seudoquistes, la magnitud del infiltrado inflamatorio mononuclear, la severidad del daño en el tejido cardiaco y la mortalidad de los ratones infectados con la cepa Tulahuén y el con el clon Dm28c, a pesar del bajo nivel de parasitemia.
Agradecimientos
Este estudio ha sido financiado por los proyectos DPA14LIHBAC1314002 y DPA15LIHBAC1314005, Departamento de Patología Animal, Facultad de Ciencias Veterinarias y Pecuarias, Universidad de Chile.
LITERATURA CITADA
1. Albuquerque S, Lopes RA, Sala MA, Carraro AA, Domingues R. 2008. Histometría de la glándula sublingual de ratones (Mus musculus) machos y hembras infectados con la cepa RAL del parásito de Chagas, Trypanosoma cruzi. Rev Biol Trop 56: 459-471. [ Links ]
2. Andrade LO, Galvao LMC, Meirelles M, Chiari E, Pena S, Macedo A. 2010. Differential tissue tropism of Trypanosoma cruzi strains: an in vitro study. Mem Inst Oswaldo Cruz 105: 834837. [ Links ]
3. Clayton J. 2010. Chagas disease 101. Nature 465: S4-S5. doi: 10.1038/ nature09220 [ Links ]
4. De Arias AR, Ferro EA. 1988. Quantification of Trypanosoma cruzi parasitemia by direct micromethod. Trans Royal Soc Trop Med Hyg 82: 248. [ Links ]
5. Di Rienzo JA, Casanoves F, Balzarini MG, Gonzalez L, Tablada M, Robledo CW. 2008. InfoStat, versión 2008, Grupo InfoStat, FCA, U. de Córdoba, Argentina. [ Links ]
6. Garcia-Lloret MI, Winkler-Lowen B, Guilbert LJ. 2000. Monocytes adhering by LFA-1 to placental syncytiotrophoblasts induce local apoptosis via release of TNF-alpha. A model for hematogenous initiation of placental inflammations. J Leukoc Biol 68: 903-908. [ Links ]
7. Hoft D, Linch R, Kirchhoff L. 1993. Kinetics analysis of antigen-specific immune response in resistant and susceptible mice during infection with Trypanosoma cruzi. J Immunol 151: 7038-7047. [ Links ]
8. [ISP] Instituto de Salud Pública de Chile. 2014. Vigilancia de enfermedad de Chagas 2005 – 2013: componente vectorial. Boletín Instituto de Salud Pública de Chile 4(6). [Internet]. Disponible en: http://www.ispch.cl/sites/default/files/Chagas%2023-06-2014_0.pdf [ Links ]
9. Kaplan E, Meier P. 1958. Non parametric estimation from incomplete observations. J Am Stat Assoc 53: 457481. [ Links ]
10. Kowalska A, Kowalski P, Torres M. 2011. Chagas disease – American trypanosomiasis. Pol Ann Med 18: 156- 167. [ Links ]
11. Kierszenbaum F. 1999. Chagas’ disease and the autoimmunity hypothesis. Clin Microbiol Rev 12: 210-223.
12. Kierszenbaum F. 2005. Where do we stand on the autoimmunity hypothesis of Chagas disease? Trends Parasitol 21: 513-516. doi: 10.1016/j.pt.2005.08.013 [ Links ]
13. López M, Leyton C, Graf M. 1982. Técnicas de histología y citología. 2ª ed. Santiago de Chile: Departamento de Biología Celular y Genética, Facultad de Medicina, Universidad de Chile. 242 p. [ Links ]
14. Minoprio P, Itohara S, Heusser C, Tonegawa A, Coutinho A. 1989. Immunobiology of murine T. cruzi infection: the predominance of parasitenonspecific response and the activation of TCR1 cells. Immunol Rev 12: 183207. [ Links ]
15. [OMS] Organización Mundial de la Salud. 2010. Enfermedad de Chagas: control y eliminación. En: 63° Asamblea Mundial de la Salud. [Internet]. Disponible en: http://www.paho.org/hq/index.php?option=com_docman&task=doc_view&gid=15376&Itemid=
16. Rassi A Jr, Rassi A, Marin JA. 2010. Chagas disease. Lancet 375: 1388-1402. doi: 10.1016/S0140-6736(10)60061-X
17. Redline RW. 2006. Inflammatory responses in the placenta and umbilical cord. Semin Fetal Neonatal Med 11: 296301. doi: 10.1016/j.siny.2006.02.011
18. Ribeiro Machado MP, Dias da Silva VJ. 2012. Autonomic neuroinmunomodulation in chagasic cardiommyopathy. Exp Physiol 97: 1151-1160. doi: 10.1113/expphysiol.2012.066381
19. Rodrigues V, Da Silva D, Sousa K, Cunha WR, Saraiva J, Kenupp J, Andrade M, Albuquerque S. 2013. In vivo infection by Trypanosoma cruzi: a morphometric study of tissue changes in mice. Parasitol Res 112: 431-436. doi: 10.1007/s00436-012-3048-x [ Links ]
20. Rodriguez J, Albajar P. 2010. Chagas disease: a new worldwide challenge. Nature 465: S6-S7. doi: 10.1038/ nature09221 [ Links ]
21. Sala MA, Lopes RA, Carraro A, Meneguette C, De Albuquerque S, Domingues R. 2008. Kariometric study of placentas from mice with acute infection by different strains of Trypanosoma cruzi. Int J Morphol 26: 623-627. doi: 10.4067/S0717-95022008000300018 [ Links ]
22. Wrightsman R, Krassner S, Watson J. 1982. Genetic control of responses to Trypanosoma cruzi in mice: multiple genes influencing parasitemia and survival. Infect Immun 36: 637-644.
23. Zuñiga C, Cepeda R, Palau MT, Vera A, Mejia J, Vergara U. 2007. Efecto protector de una cepa no virulenta contra la infección con una cepa virulenta de Trypanosoma cruzi en un modelo murino. Arch Med Vet 39: 77-82. doi: 10.4067/S0301-732X2007000100013
24. Zuñiga C, Binder N, Paláu MT, Larenas J, Vergara U. 2012a. Edad del hospedero en la evolución de la infección experimental con Trypanosoma cruzi en un modelo murino. Rev IberoLatinoam Parasitol 71: 23-33. [ Links ]
25. Zuñiga C, Ponzano P, Romo G, Paláu MT. Larenas J, García A, Vergara U. 2012b. Diagnóstico molecular de la infección con Trypanosoma cruzi en ratones. Rev Ibero-Latinoam Parasitol 71:117-124. [ Links ]
Recibido: 28 de marzo de 2016
Aceptado para publicación: 15 de julio de 2016