Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Investigaciones Veterinarias del Perú
Print version ISSN 1609-9117
Rev. investig. vet. Perú vol.28 no.1 Lima Jan./Mar. 2017
http://dx.doi.org/10.15381/rivep.v28i1.12934
ARTÍCULOS PRIMARIOS
Validación del método FAMACHA© para dosificación antihelmíntica selectiva en rebaños caprinos lecheros
Validation of the FAMACHA© method for selective anthelmintic treatment in dairy goat herds
Daniel Zárate Rendón1,2, Julio Rojas Flores1, Alan Segura Hong1
1 Laboratorio de Parasitología, Departamento Académico de Nutrición, Facultad de Zootecnia, Universidad Nacional Agraria La Molina, Lima, Perú
2 E-mail: dazre@lamolina.edu.pe
RESUMEN
Se realizó un estudio en caprinos de explotación extensiva de la costa central delPerú para validar el método FAMACHA© para la dosificación antihelmíntica selectiva en rebaños caprinos lecheros. Se tomaron muestras de sangre y heces de 120 cabras adultas de cinco rebaños caprinos lecheros. Se utilizó el método de microhematocrito, la técnica de McMaster y el coprocultivo para determinar el hematocrito, el número de huevos de nematodos por gramo de heces (HPG) e identificar las principales especies de nematodos, respectivamente; asimismo, se determinaron los coeficientes de correlación Spearman. Se emplearon dos criterios FAMACHA© de decisión para identificar animales anémicos que requieren dosificación antihelmíntica: Criterio 1: valor 3, 4 o 5, y Criterio 2: valor 4 o 5, con <20% hematocrito en ambos casos. Se evaluó la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo. Se identificaron larvas de Bunostomum sp y Haemonchus contortus. Las correlaciones entre valor FAMACHA©, hematocrito y HPG fueron altamente significativas (p<0.001). No se encontraron negativos falsos y la tasa de positivo falso fue de 67.5 y 46.7% para el criterio 1 y 2, respectivamente. El porcentaje de positivo verdadero fue de 23.3% para ambos criterios, pero el porcentaje de negativo verdadero se incrementó de 9.1 a 30%. La sensibilidad del método fue de 100% y la especificidad fue de 12% para el criterio 1 y 39.2% para el criterio 2. El valor predictivo positivo fue de 25.7 y 33.3% para el criterio 1 y 2, respectivamente, mientras que el valor predictivo negativo fue de 100% para ambos criterios.
Palabras clave: caprino, FAMACHA, nematodos, anemia
ABSTRACT
A study in goats was carried out in the central coast of Peru to validate the FAMACHA© method for selective anthelmintic treatment in dairy goat herds. Blood and fecal samples were taken from120 adult goats in five dairy goat farms. The micro haematocritand the McMaster techniques plus faecal culture were used to evaluate the haematocrit,faecal nematode egg count (EPG) and to identify major nematode species, respectively. Spearman correlation coefficients were obtained. Two FAMACHA© criteria were used toidentify animals that require anthelmintic treatment: 1: score 3, 4 or 5; 2: score 4 or 5, with <20% haematocrit in both cases. Sensitivity, specificity, positive predictive value and negative predictive value were assessed. Bunostomum sp and Haemonchus contortus were identified. Correlations between FAMACHAscore, haematocrit and EPG were highlysignificant (p<0.001). False negatives were not found and the false positive rate was 67.5 and 46.7% for criteria 1 and 2 respectively. The true positive percentage was of 23.3% for both criteria, but the true negatives increased from 9.1 to 30%. The sensitivity ofFAMACHAwas100%and the specificitywas12% forcriterion1 and 39.2% for criterion 2. The predictive positive value was 25.7 and 33.3% for criteria 1 and 2 respectively, while the negative predictive value was 100% for both criteria.
Key words: goat, FAMACHA, nematode, anemia
INTRODUCCIÓN
La crianza de ganado caprino representa una actividad de importancia para numerosas familias en la costa y sierra del Perú, constituyendo tanto una fuente de alimentos como una actividad generadora de ingresos complementaria a la agricultura.
En los casos clínicos de diarrea profusa, baja tasa de crecimiento, anemia e hipoproteinemia, se debe considerar al parasitismo gastrointestinal en el diagnóstico diferencial (Mathews, 2002). La presencia de nematodos gastrointestinales es uno de los factores que reduce considerablemente la efectividad y la rentabilidad de los sistemas de explotación caprina (Machen et al., 2002; Cardoso et al., 2012).
Dentro del grupo de nematodos gastrointestinales que afectan a las explotaciones caprinas, destacan Trichostrongylus colubriformis, T. axei, Ostertagia sp, Cooperia sp, Oesophagostomum sp, Trichuris ovis, Strongyloides papillosus, Bunostomum sp y, con mayor frecuencia, Haemonchus contortus (Kaplan et al., 2004; Cardoso et al., 2012).
Haemonchus contortus, también conocido como «gusano palo de barbero» (Machen et al., 2002), que se localiza en la mucosa del abomaso, y Bunostomum sp, que se fija a la mucosa de la zona proximal del intestino delgado (Kassai, 1998), son los parásitos más patógenos. Ambos son hematófagos y las infecciones pueden producir anemia, hipoalbuminemia, pérdida de peso y ocasionalmente diarrea (Urquhart, 2001). El método más utilizado para determinar la carga parasitaria es a través del conteo de huevos por gramo de heces (HPG) mediante la técnica de McMaster modificada (Besier et al., 2016).
FAMACHA© es un método que se utiliza en ovejas y cabras en diversas partes del mundo como indicador del grado de anemia y por su estrecha relación con el nivel de parasitismo gastrointestinal (Besier et al., 2016; Maia et al., 2015; Scheuerle et al., 2010). Este método permite, en función del color de la baño a la fracción de animales que requieren tratamiento antihelmíntico (Molento et al., 2004). El método fue desarrollado en Sudáfrica a inicios de los años 90, con el propósito de contrarrestar los efectos perjudiciales provocados por el nematodo H. contortus sobre sus hospederos (Malan y Van Wyk, 1992; Malan et al., 2001). Las conjuntivas oculares son clasificadas por su color al compararlas con una cartilla laminada FAMACHA© que contiene cinco fotografías, cada cual con un color diferente de conjuntiva. Dichos colores varían desde rojo, pasando por rosado a casi blanco (Vilela et al., 2012).
El objetivo de la presente investigación fue validar la metodología FAMACHA© para dosificación antihelmíntica selectiva en rebaños caprinos lecheros de crianza extensiva en la costa central del Perú.
MATERIALES Y MÉTODOS
Lugar y Periodo de Ejecución
La fase de campo se llevó a cabo en la localidad de Santa Rosa de Macas, distrito de Santa Rosa de Quives, provincia de Canta, ubicada en el valle del río Chillón, Región Lima, en febrero de 2008. El análisis de las muestras de heces se hizo en el Laboratorio de Parasitología y las muestras de sangre en el Laboratorio de Fisiología del Departamento Académico de Nutrición, Facultad de Zootecnia, Universidad Nacional Agraria La Molina (UNALM).
Animales Experimentales
Se utilizaron 120 cabras criollas hembras adultas de crianza semiextensiva (con encierro nocturno), seleccionadas al azar en cinco rebaños lecheros, con antecedentes de moderadas cargas de nematodos, de acuerdo al testimonio de los criadores, y previamente empadronados. Los animales muestreados correspondían aproximadamente al 40% de hembras adultas en cada rebaño.
Los animales eran alimentados con base de pastos naturales. El control antiparasitario tradicionalmente se basa en el uso empírico y frecuente de antiparasitarios, sin ningún calendario establecido. Los productos más empleados son la lactona macrocíclica ivermectina y el benzimidazol albendazol. Los animales incluidos en el estudio habían sido desparasitados 45 a 60 días previos al inicio del estudio. Todos los rebaños, en general, presentaban los animales con condición corporal pobre.
La temperatura cálida tropical y la geografía del lugar determina que la presencia de Fasciola hepatica en la zona del muestreo fuera nula; de allí que por estas razones y por datos de estudios no publicados y antecedentes clínicos reportados, no se consideró necesario el descarte de F. hepatica.
Uso de la Cartilla FAMACHA©
La evaluación de los animales con la cartilla FAMACHA© fue realizada por solouna persona. Para esto, los animales fueron sujetados y las conjuntivas oculares fueron expuestas por unos segundos a la luz, evitando realizar el proceso bajo sombra. La cartilla se colocó lo más cerca posible a la conjuntiva ocular, con la finalidad de contrastar directamente el color observado con el de la cartilla.
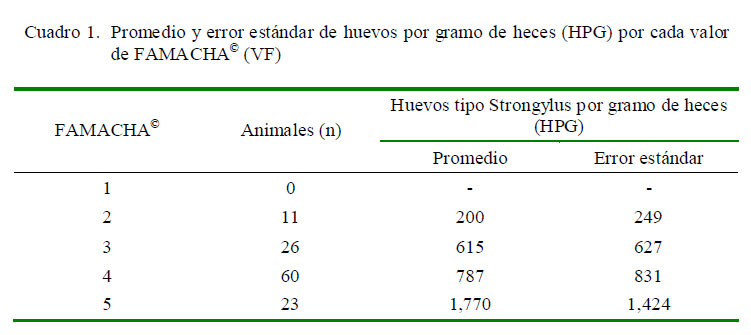
El resultado se expresó en valores de 1 al 5, donde 1 y 2 corresponden a colores rojo y rojo pálido, respectivamente (animales no anémicos), el 3 al color rosado (valor intermedio donde el animal puede considerarse tanto anémico como no anémico), y 4 y 5 corresponden a colores rosado pálido y blanco (animales anémicos).
Muestras de Heces y Sangre
Se tomaron muestras de sangre (3 ml)mediante venopunción de la vena yugular con tubos al vacío de 3 ml con EDTA(Vacuette®).Asimismo, se recolectaron muestras de heces directamente del recto (4-5 g). Las muestras, debidamente identificadas, fueron colo-cadas en cajas isotérmicas con gel refrigerante para su transporte al laboratorio.
El contaje de huevos de nematodos en heces se realizó mediante la técnica de McMaster, y el valor del hematocrito mediante el método de microhematocrito. Además, se hizo coprocultivo de larvas utilizando un mínimo de dos muestras por cada rebaño (n=10 muestras) para observar el tercer estadio larvario (L3) e identificar el género al que pertenecen.
Análisis Estadístico
Para determinar la fuerza y la dirección de la asociación de las variables en estudio, se obtuvo los coeficientes de correlación Spearman corregido para valores iguales, utilizando el software SAS, y de esta forma examinar la relación entre el valor de FAMACHA© (VF), el valor de hematocrito(Ht) y la cantidad de huevos de nematodos por gramo de heces (HPG).
En la interpretación del coeficiente de correlación (r) de Spearman, los valores próximos a 1 o -1 indican correlaciones fuertes y positivas o negativas, respectivamente, mientras que valores próximos a 0 indican que no hay correlación lineal (Milton, 2001)
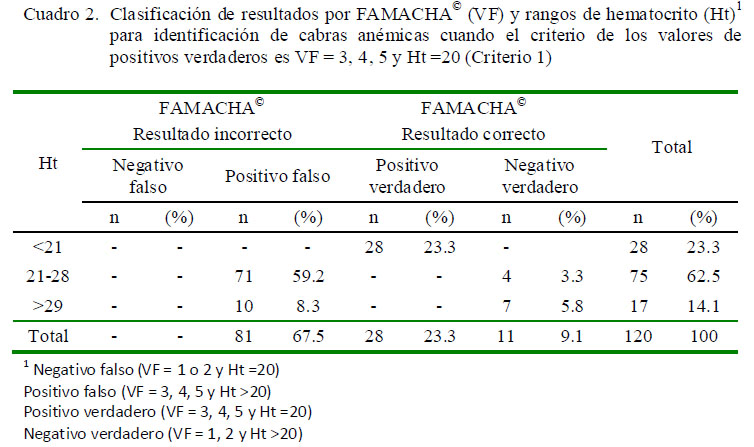
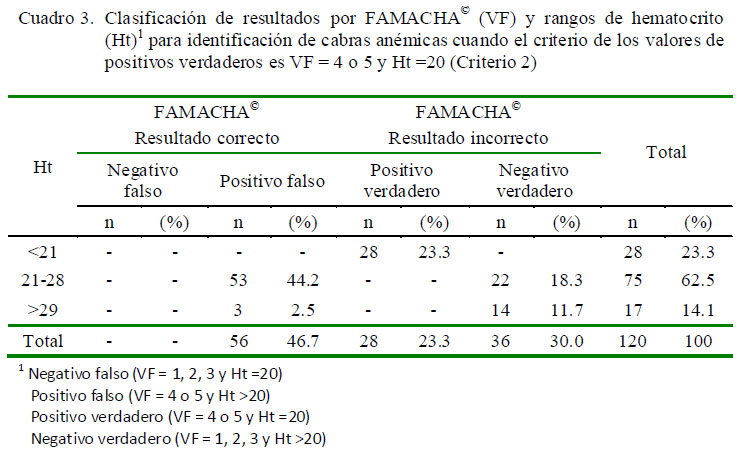
Se utilizaron dos criterios de decisión para identificación de animales anémicos en relación con los valores FAMACHA©. El primero (liberal), donde los animales calificados con VF = 3, 4 o 5 y Ht <20 fueron considerados anémicos y el segundo (conservador)donde los calificados con VF = 4 o 5 y Ht <20 se consideraron anémicos. Ambos criterios permitieron clasificar los resultados en incorrectos (negativo falso y positivo falso) ycorrectos (positivo verdadero y negativo verdadero). Estos se relacionaron con tres rangos de Ht (<20%, 21 a 28% y >28%) (Cuadros 2 y3).
La sensibilidad, especificidad y valores esperados como índices para medir la precisión del método se hallaron a partir de los criterios de calificación de resultados positivos (verdadero y falso) y negativos (verdadero y falso):
-
Un resultado positivo verdadero fue aquel con color de conjuntiva ocular pálida (VF = 3, 4, 5 o 4, 5) y definido como anémico (Ht <20). El resultado positivo falso es aquel con conjuntiva ocular pálida (VF = 3, 4, 5 o 4, 5) pero con Ht >20% (no anémico).
-
Un resultado negativo verdadero fue aquel con color de conjuntiva ocular rojo o rosado (VF = 1,2 o 1, 2,3) yHt >20% (no anémico). El resultado negativo falso es aquel con conjuntiva roja o rosada (VF = 1, 2 o 1, 2, 3) pero Ht <20 (anémico).
Se utilizó el hematocrito de <20% como indicativo de anemia tomando el valor inferior del rango de 20 a 28% encontrado por Arce (1983) en cabras adultas en los valles de Rímac y Chillón, Lima.
Los índices de precisión se hallaron siguiendo las definiciones otorgadas por Thrusfield (1990), Kaplan et al. (2004) yBurke et al. (2007).
La sensibilidad se calculó como la proporción de animales calificados como positivos verdaderos en función del total de animales anémicos, representado por la suma de la tasa de positivo verdadero y negativo falso. La especificidad estuvo representada por la proporción de animales calificados como negativos verdaderos en función del total de animales no anémicos, dado por lasuma de la tasa de negativo verdadero y positivo falso.
El valor predictivo positivo se define como la probabilidad de que un animal positivo por FAMACHA© se encuentre realmente anémico (positivo verdadero) sobre el total de animales considerados positivos, dado por la suma de la tasa de positivo verdadero y positivo falso. El valor predictivo negativo indica la probabilidad de que un animal negativo por FAMACHA© se encuentre realmente no anémico (negativo verdadero) entre el total de animales considerados negativos, representado por la suma negativo verdadero y negativo falso.
RESULTADOS Y DISCUSIÓN
Correlación entre FAMACHA©,Hematocrito y HPG
Las correlaciones entre VF–Ht, VF– HPG y Ht–HPG resultaron altamente significativas (p<0.001), siendo negativas entre VF–Ht (-0.65) y Ht–HPG (-0.48) y positiva entre VF–HPG (0.43). Estos resultados coinciden con el estudio de Kaplan et al. (2004),quienes emplearon las mismas variables, con la diferencia que se obtuvieron correlaciones mayores en el presente estudio.
La correlación entre las variables VF y HPG resulta importante debido a que el valor VF (anémico / no anémico) se atribuye exclusivamente al nivel de carga parasitaria, principalmente H. contortus. No obstante, tal como lo señala Morales et al. (2007), un valor de Ht elevado no supone necesariamente una inexistente o nula carga de nematodos, de la misma forma que un Ht reducido no debe asociarse necesariamente con la presencia de alta carga parasitaria.
Relación entre FAMACHA© y HPG
El mayor número de cabras fue clasificado con VF=4 (60/120), y ningún animal fue calificado con VF=1 (Cuadro 1). El número de HPG se incrementó de acuerdo a valores crecientes de FAMACHA©, tal y como ha sido reportado por Kaplan et al. (2004). No obstante, Burke et al. (2007) difiere de estos resultados pues por cada VF obtuvieron promedios irregulares de HPG. Por otro lado, es importante resaltar que los valores promediode HPG obtenidos en este estudio fueron menores que los hallados por los autores anteriormente mencionados; asimismo, identificaron H. contortus en las muestras de heces, especie con alta producción de huevos. En el presente estudio, en los cultivos fecales solo se identificaron larvas de Bunostomum y H. contortus. Debido al reducido número de larvas infectivas obtenido en los coprocultivos, no se pudo establecer un porcentaje de composición de especies suficientemente representativo de la muestra, de allí que solo se puede reportar la presencia de especies.
Relación entre FAMACHA© y Hematocrito
Con el primer criterio no se obtuvieron negativos falsos, mientras que la tasa de positivo falso para Ht de 21-28% fue de 59.2%. La tasa de positivo verdadero para Ht <20% fue de 23.3% (Cuadro 2). Con el segundo criterio tampoco se obtuvieron negativos falsos, mientras que la tasa de positivo falso para Ht entre 21 y 28% fue de 44.2%. La tasa de positivo verdadero para Ht <20% fue similar al resultado del primer criterio, mientras que las tasas de negativo verdadero fueron de 18.3 y 11.7% para Ht entre 21 y 28% y >28%, respectivamente (Cuadro 3).
Dentro de los resultados incorrectos, la tasa de negativo falso reviste la mayor importancia pues representa aquellos animales negativos a FAMACHA® que serían dejados sin dosificar; sin embargo, ningún animal se encontró dentro de este grupo. Por otro lado, calificar un animal como positivo falso no implica mayor riesgo, pues serán tratados animales de conjuntivas pálidas, aun cuando poseen un Ht normal, ya que esto no pone en riesgo su salud.
En este trabajo, la inexistente presentación de negativo falso difiere con los resultados obtenidos por Kaplan et al. (2004) yBurke et al. (2007), quienes utilizando los criterios de decisión VF = 3, 4 o 5 y Ht <19 y VF = 4 o 5 y Ht <19, obtuvieron incrementos en la tasa negativo falso de 0.7 a 5.2% y de 4.1 a 8.5%, respectivamente. En forma similar, la tasa de positivo verdadero se mantuvo constante del primer al segundo criterio, pero estos autores hallaron tasa de positivo verdadero disminuida de 11.6 a 7.1% y de 8.1 a 3.7%, respectivamente.
Las tasas de positivo falso disminuyeron y las de negativo verdadero aumentaron del primer al segundo criterio, respectivamente. Resultados que coinciden con los hallados por Kaplan et al. (2004) y Burke et al. (2007).
El incremento del negativo verdadero se explica considerando la disminución en la tasa de positivo falso.
Los animales recomendados para tratamiento con el antiparasitario fueron aquellos calificados como positivos (positivo falso y positivo verdadero), de allí que, con base al primer y segundo criterio de decisión, el 90.8 y 70% de los animales fueron recomendados para tratamiento (Cuadro 4).
Los animales calificados con VF=3 representan aquellos que pueden o no pueden ser considerados como anémicos y, por lo tanto, su tratamiento estará supeditado a ladecisión del técnico responsable de la aplicación de la técnica (Malan et al., 2001; Bath, 2002).
El porcentaje de animales recomendados para tratamiento en este estudio resulta elevado si se compara con los resultados de Kaplan et al. (2004), quienes recomendaron tratar entre 68 y 31%, y de Burke et al. (2007)con 39 y 9%, según el criterio 1 o 2. Sin embargo, hay que considerar otros factores que pudieron estar induciendo anemia en los animales en estudio, incluyendo algunos factores no parasitarios, tales como la mala nutrición de los animales debido al mal estado de los pastos naturales, sumado a su exigencia productiva.
Índices de Precisión de FAMACHA©
En el presente estudio se utilizó la sensibilidad, especificidad, valor esperado (predictivo) de un resultado positivo y de un resultado negativo como índices para medirla precisión de FAMACHA© en rebaños caprinos.
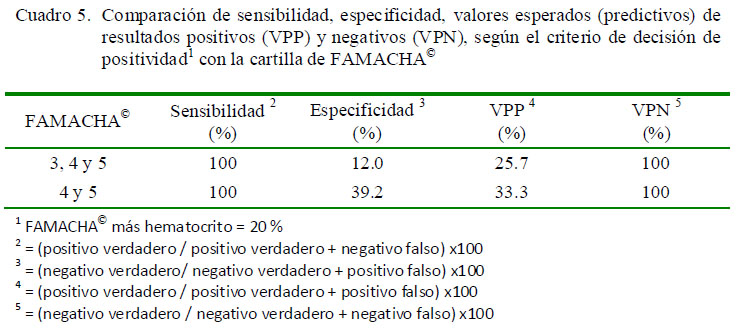
Para ambos criterios de decisión, la sensibilidad resultante fue de 100%, mientras que la especificidad se incrementó de 12 a 39.2%. Así mismo, el valor esperado de un resultado positivo aumentó de 25.7 a 33.3%, mientras que el valor esperado de un resultado negativo fue de 100% (Cuadro 5).
Los resultados incorrectos conducen inevitablemente a una diferenciación equivocada de animales ‘anémicos’ y ‘no anémicos’. Al aplicar FAMACHA©, las pruebas iniciales no suelen estar encaminadas a lograr diagnósticos definitivos sino, más bien, a detectar el mayor número de casos positivos como sea posible; por ello, la interpretación de la técnica se dirige a obtener una mayor sensibilidad frente a una menor especificidad (Thrusfield, 1990; Kaplan et al., 2004; Burke et al., 2007).
El valor de sensibilidad en este trabajo se mantuvo constante, influenciado por la inexistente tasa de negativo falso (resultado incorrecto). Tanto Kaplan et al. (2004) como Burke et al. (2007) obtuvieron incrementos en la tasa de negativo falso, lo cual originó una disminución en la sensibilidad de 93.9 a 57.6% y de 66.3 a 30.1%, respectivamente. Por otro lado, el incremento de la especificidad fue influenciado por la disminución en la tasa de positivo falso (resultado incorrecto) del primer al segundo criterio de decisión. Esto coincide con Kaplan et al. (2004) y Burke et al. (2007), quienes presentaron disminución en la tasa de positivo falso, incrementándose el valor de la especificidad.
Este trabajo solamente asocia el incremento en el esperado de un positivo con la disminución en la tasa de positivo falso, pues el positivo verdadero se mantuvo constante en ambos criterios. Esto resulta diferente a los trabajos de Kaplan et al., (2004) y Burke et al., (2007), donde el incremento en el esperado de un positivo se relacionó no solo a un menor porcentaje de positivo falso sino también a un menor porcentaje de positivo verdadero, originando incrementos en los valores esperados de positivo de 16.9 a 22.9% y de 20.6 a 43.1%, respectivamente.
El valor esperado de obtener un resultado negativo para este trabajo se mantuvo constante, entre el primer y segundo criterio, (Cuadro 6), lo cual difiere con Kaplan et al., (2004) y Burke et al., (2007), quienes obtuvieron reducciones de 97.7 a 92.5% y de 93.2 a 90.7%, respectivamente entre ambos criterios.
Aplicación de FAMACHA©
El aplicar un enfoque de tratamiento selectivo donde se trata solo los animales calificados con VF igual a 4 y 5, el número de animales tratados será menor que el total de la población. La reducción paulatina en el uso de fármacos repercutirá favorablemente sobre el fenómeno de resistencia (Márquez, 2003), aspecto de suma importancia y una de las razones por las que FAMACHA© fue desarrollada (Molento et al., 2011).
Si bien el tratamiento antiparasitario de una menor cantidad de animales reducirá el gasto por concepto de tratamiento (Kaplan et al., 2004), el costo por concepto de manejo y revisión de animales a intervalos más frecuentes se verá incrementado. Aunque la cartilla de FAMACHA© es fácil de usar, diversos estudios indican que el adecuado entrenamiento de su aplicación es un factor de importancia (Vatta et al., 2001; Kaplan et al., 2004; Burke et al., 2007).
Van Wyk y Bath (2002) indican que la característica de susceptibilidad al parasitismo gastrointestinal es transmitida a la siguiente generación, de allí que el uso de FAMACHA© puede permitir la separación y posterior eliminación de dichos animales, mejorando año a año la resistencia genética innata total del rebaño frente a los parásitos. Esto ya se ha demostrado en recientes estudios en ovinos infectados experimentalmente (Pereira et al., 2016); sin embargo, esto no podría lograrse usando enfoques de tratamientos antihelmínticos tradicionales.
CONCLUSIONES
-
FAMACHA© es una herramienta útil para identificar cabras anémicas que necesitan tratamiento contra parásitos gastrointestinales en las condiciones de crianza semiextensiva de Lima, Perú.
-
Las correlaciones entre los valores de FAMACHA©, hematocrito y número de huevos de nematodos por gramo de heces fueron altamente significativas (p<0.001).
-
El incremento de la especificidad y del valor esperado (predictivo) de un resultado positivo al reducir el criterio de decisión de positividad con FAMACHA© demuestra mayor capacidad en la identificación de animales con anemia.
LITERATURA CITADA
1. Arce B. 1983. Determinación de los principales valores hematológicos en cabras en explotación extensiva. Tesis de Ingeniero Zootecnista. Lima: Facultad de Zootecnia, Universidad Nacional Agraria La Molina. 100 p. [ Links ]
2. Besier RB, Kahn LP, Sargison ND, Van Wyk JA, 2016. Diagnosis, treatment and management of Haemonchus contortus in small ruminants. Adv Parasitol 93: 181-238. doi: 10.1016/bs.apar.2016.02.024 [ Links ]
3. Burke J, Kaplan RM, Miller J, Terrill TH, Getz WR, Mobini S, Valencia E, et al. 2007. Accuracy of the FAMACHA system for on-farm use by sheep and goat producers in the southeastern United States. Vet Parasitol 147: 89-95. doi: 10.1016/ j.vetpar.2007.03.033 [ Links ]
4. Cardoso CP, Cardozo LL, Silva BF, Amarante AFT. 2012. Gastrointestinal parasites in goats from Monte Castelo, Santa Catarina, Brazil. Rev Bras Parasitol 21: 148-150. doi: 10.1590/ S1984-29612012000200014 [ Links ]
5. Kaplan RM, Burke JM, Terrill TH, Miller JE, Getz WR, Mobini S, Valencia E, et al. 2004. Validation of the FAMACHA© eye color chart for detecting clinical anemia in sheep and goats on farms in the southern United States. Vet Parasitol 123: 105-120. [ Links ]
6. Kassai T. 1998. Helmintología veterinaria. España: Ed Acribia. 296 p. [ Links ]
7. Machen R, Craddock F, Craig T, Fuchs T. 2002. A Haemonchus contortus management plan for sheep and goats in Texas. AgriLife Extension. [Internet]. Disponible en: http:// animalscience.tamu.edu/wp-content/ uploads/sites/14/2012/04/L5095- haemonchus.pdf [ Links ]
8. Malan F, van Wyk J. 1992. The packed cell volume and color of the conjunctive as aids for monitoring Haemonchus contortus infestation in sheep. In: Proc SA Veterinary Association Biennial National Veterinary Congress. Grahamstown, South Africa. [ Links ]
9. Maia D, Rosalinski-Moraes F, de Torres- Acosta JF, Cintra MCR, Sotomaior CS. 2015. FAMACHA© system assessment by previously trained sheep and goat farmers in Brazil. Vet Parasitol 209, 202-209. doi: 10.1016/ j.vetpar.2015.02.033 [ Links ]
10. Malan FS, van Wyk JA, Wessels C. 2001. Clinical evaluation of anaemia in sheep: early trials. Onderstepoort J Vet Res 68: 165-174. [ Links ]
11. Márquez D. 2003. Resistencia a los antihelmínticos: origen, desarrollo y control. Rev Corpoica 4(1): 55-71. [ Links ]
12. Mathews J. 2002. Enfermedades de la cabra. México: Ed Acribia. 315 p. [ Links ]
13. Milton JS. 2001. Estadística para biología y ciencias de la salud. 3a ed. Madrid: McGraw-Hill Interamericana. 722 p. [ Links ]
14. Molento M, Tasca C, Gallo A, Ferreira M. 2004. Método FAMACHA© como parâmetro clinico individual de infecção por Haemonchus contortus em pequenos ruminantes. Cienc Rural 34: 1139-1145. [ Links ]
15. Molento MB, Fortes FS, Pondelek DAS, Borges F, Chagas A, Torres- Acosta JF, Geldhof P. 2011. Challenges of nematode control in ruminants: focus on Latin America. Vet Parasitol 180: 126- 132. doi: 10.1016/j.vetpar.2011.05.033 [ Links ]
16. Morales G, Sandoval E, Pino LA, Balestrini C, Garcia F. 2007. El control de la infestación por estróngilos digestivos en rumiantes domésticos bajo principios de la «agricultura de precisión ». REDVET 8(8). [Internet]. Disponible en: http://www.veterinaria.org/ revistas/redvet/n080807/080716.pdf [ Links ]
17. Pereira JF, Mendes JB, De Jong G, Maia D, Teixeira VN, Passerino AS, Garza JJ, Sotomaior CS. 2016. FAMACHA© scores history of sheep characterized as resistant/resilient or susceptible to H. contortus in artificial infection challenge. Vet Parasitol 218: 102- 105. doi: 10.1016/j.vetpar.2016.01.011 [ Links ]
18. Scheuerle M, Mahling M, Muntwyler J, Pfister K. 2010. The accuracy of the FAMACHA©-method in detecting anaemia and haemonchosis in goat flocks in Switzerland under field conditions. Vet Parasitol 170: 71-77. doi: 10.1016/j.vetpar.2010.01.035 [ Links ]
19. Thrusfield M. 1990. Epidemiología veterinaria. España: Ed Acribia. 339 p. [ Links ]
20. Urquhart GM. 2001. Parasitología veterinaria. España: Ed Acribia. 385 p. [ Links ]
21. van Wyk JA, Bath G. 2002. The FAMACHA© system for managing haemonchosis in sheep and goats by clinically identifying individual animals for treatment. Vet Res 33: 509-529. doi: 10.1051/vetres:2002036 [ Links ]
22. Vargas F. 2006. FAMACHA© Control de haemonchosis en caprinos. Agronomía Measoamericana 17(1): 79-88. [ Links ]
23. Vatta A, Letty B, van der Linde M, van Wyk E, Hansen J, Krececk R. 2001. Testing for clinical anemia caused by Haemonchus spp in goats farmed under resource-poor conditions in South Africa using an eye colour chart developed for sheep. Vet Parasitol 99: 1-14. [ Links ]
24. Vilela VLR, Feitosa TF, Linhares EF, Athayde ACR, Molento MB, Azevedo SS. 2012. FAMACHA© method as an auxiliary strategy in the control of gastrointestinal helminthiasis of dairy goats under semiarid conditions of Northeastern Brazil. Vet Parasitol 190: 281-284. doi: 10.1016/j.vetpar.2012. 05.024 [ Links ]
Recibido: 7 de mayo de 2016
Aceptado para publicación: 4 de octubre de 2016