Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.28 no.2 Lima abr./jun. 2017
ARTÍCULOS PRIMARIOS
Marcadores Genéticos del Color para Determinar la Estructura Genética de Gatos Domésticos (Felis catus) en Zonas Rurales de Lorica, Colombia
Genetic Markers of Colour for Determining the Genetic Structure of Domestic Cats (Felis catus) in Rural Areas of Lorica, Colombia
Luis Alfonso Causil Vargas1,3, Adrián Rodríguez De La Barrera1, Orlando Causil Vargas2
1 Departamento de Biología, Facultad de Ciencias Básicas, Universidad de Córdoba, Colombia
2 Departamento de Ciencias Naturales y Educación Ambiental, Facultad de Educación y Ciencias Humanas, Universidad de Córdoba, Colombia
3 E-mail: luiscausilvargas@gmail.com
RESUMEN
El objetivo de este estudio fue analizar la estructura genética de gatos domésticos (Felis catus) en ambientes rurales de Lorica, Colombia, utilizando marcadores morfológicos del color. Se hizo una clasificación fenotípica de 134 individuos distribuidos en tres poblaciones, atendiendo a la presencia o ausencia de los marcadores autosómicos Nonagouti, Blotched tabby, Dilution, Pelo largo, Manchado de blanco y Dominante blanco y el marcador Orange ligado al sexo. El marcador Blotched tabby fue el de mayor frecuencia y muestra una posible selección natural, mientras que Dominante blanco evidenció los valores más bajos. Las poblaciones mostraron ausencia de equilibrio HardyWeinberg. Asimismo, se evidenció un exceso de homocigotos, y se encontró diferencias entre poblaciones y poco flujo genético entre ellas. El polimorfismo de genes que codifican el color de gatos en hábitats rural, probablemente difieran de las condiciones domésticas en hábitat urbano.
Palabras clave: diversidad genética, frecuencia alélica, heterocigosidad, equilibrio Hardy-Weinberg, hábitat
ABSTRACT
The aim of this study was to analyse the genetic structure of domestic cats (Felis catus) in rural environments in Lorica, Colombia using morphological markers of colour. A phenotypic classification was made of 134 individuals distributed in three populations, attending to the presence or absence of the autosomal markers Non-agouti, Blotched tabby, Dilution, White spotting, Dominant white and the marker Orange linked to sex. The Blotched tabby marker was the most frequent and showed a possible natural selection, while Dominant white showed the lowest values. Populations showed absence of HardyWeinberg equilibrium. Moreover, an excess of homozygotes was evident, and differences between populations and scarce gene flow between populations was found. Polymorphism of genes that encode the colour of cats in rural habitats likely differ from domestic conditions in urban environment.
Key words: genetic diversity, allele frequencies, heterozygosity, Hardy-Weinberg equilibrium, habitat
INTRODUCCIÓN
La presencia del gato doméstico (Felis catus) en ambientes rurales se le puede considerar, en determinadas ocasiones, como un problema relevante para su conservación (Ferreira et al., 2011); sobre todo, donde la variación fenotípica del color, típico de muchos grupos de mamíferos, cuyos dibujos en la piel (como manchas, rayas y puntos, entre otras), podrían jugar un importante papel adaptativo, sea como camuflaje, para la evasión de depredadores o para la comunicación social, ya que el gato doméstico interactúa con muchas otras especies (Eizirik et al., 2010).
Los análisis de estructura genética basados en frecuencias alélicas, son bastante utilizados en estudios relacionados con genética, ecología y conservación de poblaciones. Sus resultados ofrecen información acerca de la existencia de diferencias en la composición genética entre poblaciones de una misma especie, así como describen el nivel de diferenciación a través de índices que miden la estructura genética de una población (Godoy, 2009).
Para entender la dinámica poblacional del gato doméstico se debe entender primeramente su estructura genética-poblacional, la cual podría variar, dependiendo el tipo de hábitat (urbano o rural) (Bradshaw et al., 1999). El polimorfismo de un grupo de genes, expresado en marcadores fenotípicos que codifican para el diseño y coloración del pelaje, ha sido una estrategia muy utilizada para estudiar la variabilidad y estructura genética de muchas poblaciones animales, tanto silvestres como domésticas (Andersson, 2015).
Las alternativas alélicas de los genes expresan marcadores morfológicos que obedecen a un comportamiento mendeliano. La variación morfológica del color en poblaciones naturales de gatos domésticos es un punto de partida útil para investigar la evolución de la diversidad fenotípica en los mamíferos, y de mucho interés para establecer relaciones genético-ecológicas, proporcionando una plataforma para estudios comparativos de variación morfológica (Schneider et al., 2015). Los gatos presentan polimorfismos evidentes, coherentes con el color, el patrón y textura de la capa, particularidades factibles de reconocer a simple vista, razón por la cual la recolección de datos en campo es un procedimiento relativamente sencillo (Pardo et al., 2016).
En Colombia y, específicamente, en la costa del Caribe, se han llevado a cabo estudios genéticos en poblaciones de gatos domésticos de áreas urbanas utilizando marcadores morfológicos del pelaje, cuyos resultados han evidenciado que su estructura y variación genética está directamente relacionada con preferencias antrópicas, lo que ha ocasionado la selección artificial de algunos genes que codifican para la coloración y diseño del pelaje (Pardo et al., 2014, 2015, 2016; Montes-Díaz et al., 2015). El objetivo de esta investigación fue analizar la estructura genética de gatos domésticos utilizando mar cadores genéticos para la coloración del pelaje, en el hábitat rural de Lorica, Colombia, y comparar los resultados con aquellos de estudios previos en el país.
MATERIALES Y MÉTODOS
Sitio de Estudio
El trabajo se realizó en áreas rurales de Lorica, Colombia, específicamente en El Carito (9° 4' 0.012" N) con una extensión de 11.8 mm2, Los Morales (9° 4' 4.933" N), con una extensión de 12.2 km2 y Nariño (9° 10' 7.630" N), con una extensión de 28.13 km2. La temperatura promedio anual de las tres poblaciones es de 33 °C.
Obtención de Datos
Los muestreos se llevaron a cabo entre marzo y abril de 2016, mediante excursiones rurales, donde fueron muestreados la totalidad de los gatos encontrados en todas las casas y en campo abierto de las tres poblaciones, mediante observación directa y con ayuda de registros fotográficos para la identificación de los gatos.
Se hizo una clasificación fenotípica de cada individuo adulto, atendiendo a la presencia o ausencia de los marcadores autosómicos Non-agouti (a); Bl ot ched tabby (Tb); Dilution (d), Pelo largo (l); Manchado de blanco (S) y Dominante blanco (W) y el marcador Orange (O) ligado al sexo. Asimismo, se determinó el sexo en la medida de lo posible, edad, raza y preferencias antrópicas. Se eliminaron los registros de individuos con sospecha de doble entrada.
Diseño Estadístico
Se calcularon las frecuencias alélicas, donde la estimación de las frecuencias alélicas autosómicas recesivas (q) de cada marcador a nivel poblacional y global fueron estimadas por la raíz cuadrada de las frecuencias fenotípicas, mientras que las frecuencias alélicas dominantes (p) fueron calculadas como 1-q, siguiendo el modelo propuesto por Ruiz-García y Alvarez (2003), asumiendo panmixia dentro de la población.
La frecuencia del alelo del marcador Orange fue calculada con el método de máxima verosimilitud (Robinson, 1987), suponiendo una relación de sexos de 1:1. De esta manera p(O) = (2a + b)/(2N), donde a = número de gatos Orange (O/O y O/), b = número de hembras heterocigotas (O/o) y N = tamaño de la muestra para ese marcador.
El equilibrio Hardy-Weinberg fue testado mediante un Chi-cuadrado. La distancia genética entre las poblaciones y el índice de diversidad genética correspondientes a la heterocigosidad esperada (He) fueron calculadas siguiendo los parámetros de Nei (1972). El coeficiente de diferenciación genética (Gst ) y flujo génico (Nm) se estimaron a través del programa PopGene 1.31 (Yeh et al., 1999) y los índices de fijación FIS , FIT y FST se calcularon mediante el programa FSTAT v. 2.9.3.2 (Goudet, 2001).
RESULTADOS
Se muestrearon un total de 134 individuos distribuidos en tres poblaciones, El Carito (n=40), Los Morales (n=52) y Nariño (n=42), en un área total de 52.14 km2, para una densidad poblacional de 0.39 individuos/km2.
Frecuencias Alélicas
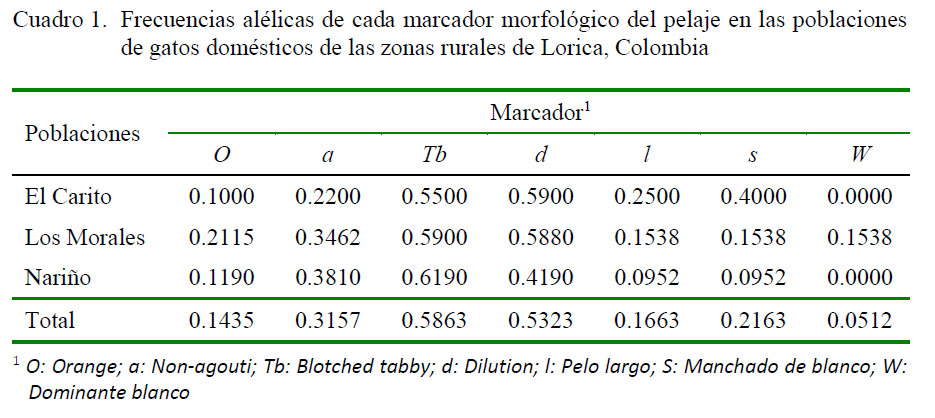
Las frecuencias alélicas para cada población (Cuadro 1), evidencian que el marcador Tabby blotched (p=0.5863) fue el más frecuente, seguido de Dilution (p=0.5323), mientras que Dominante blanco presentó los valores más bajos (p=0.0512), estando ausente en las poblaciones de El Carito y Nariño.
Diversidad Genética
El índice de variabilidad genética a nivel global fue relativamente bajo (Cuadro 2; He=0.2289). Las poblaciones de Los Morales y de Nariño mostraron los índices de diversidad más altos (He=0.2419 y He=0.2401, respectivamente). Con respecto a los marcadores, Blotched tabby reportó el más alto relativamente alto (G =0.25). El valor de flujo valor de diversidad (He=0.3772), seguido de Dilution (He= 0.2787), en tanto que Domi nante blanco tuvo los valores más bajos (He=0.0289), aunque se debe indicar que pocos ejemplares presentaron este marcador.
Diferenciación Genética y Flujo Génico
El nivel de diferenciación genética entre las poblaciones de gatos domésticos fue relativamente alto (GST=0.25) génico (Nm=0.762) evidencia que las pobla&ciones mantienen un grado mínimo de intercambio genético, ya que el flujo génico fue menor que 1, por lo que se podría suponer que las poblaciones se comportan de forma independiente.
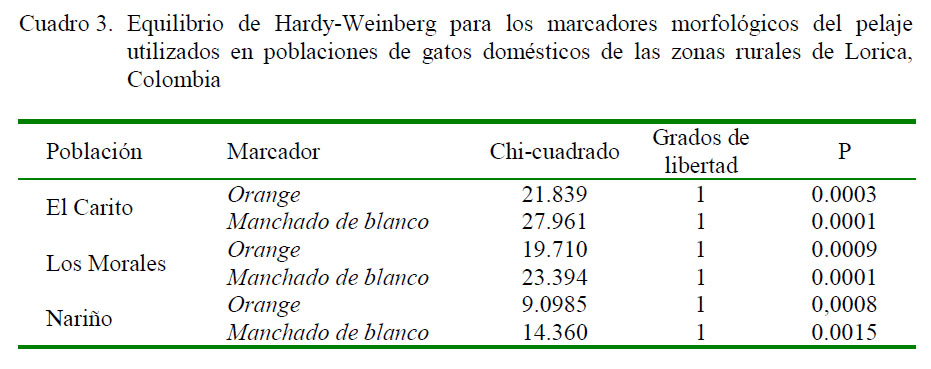
El test de equilibrio de Hardy-Weinberg (Cuadro 3) indicó ausencia de equilibrio (p<0.005) para los marcadores O (Orange) y S (Manchado de blanco), debido a un exceso de homocigotos; hecho que podría proporcionar baja variabilidad genética entre y dentro de las poblaciones.
Estructura Poblacional
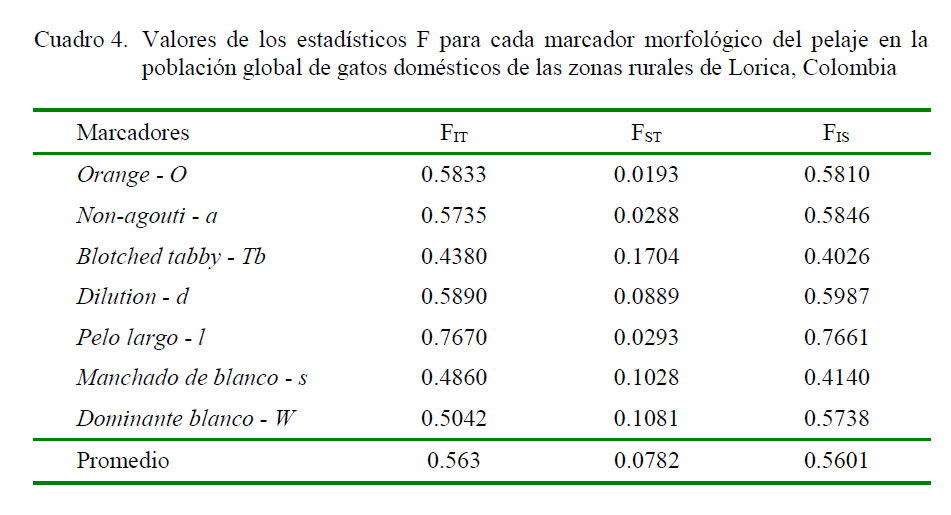
Los valores positivos de F para todos los marcadores morfológicos de pelaje (Cuadro 4) muestran un exceso de homocigotos de los individuos con respecto a cada población, con valores que oscilan entre 0.7661 para el marcador Dilution y 0.4026 para el marcador Blotched tabby. Los resultados, por lo tanto, hacen suponer la presencia de consanguinidad dentro de las poblaciones. El estadístico F, en forma similar, refleja un exceso de homocigotos de los individuos con respecto a la población total. Por otro lado, el valor promedio de F resultó ser relativamen alto (0.0782), lo que podría indicar diferenciación génica significativa entre las poblaciones.
DISCUSIÓN
Debido a su estrecha asociación con los humanos, el gato doméstico tiene una de las mayores distribuciones geográficas que cualquier otro carnívoro terrestre (Thomas et al., 2012). Las densidades de gatos domésticos pueden reflejar las densidades poblacionales humanas y la predisposición de los seres humanos hacia el mantenimiento de los gatos como mascotas. Por lo tanto, es probable que su densidad poblacional sea mayor en lugares con altas densidades poblacionales antrópicas, donde se han reportado densidades mínimas de gatos de 132 individuos/km2 (Sims et al., 2008), lo que podría explicar la baja densidad encontrada en este estudio.
Frecuencias Alélicas
Los gatos domésticos tienen diferentes y heredables patrones de dibujos en la piel (rayas, manchas o puntos en el cuerpo), denominados colectivamente como patrones de tipo (Kaelin y Barsh, 2010). Posiblemente la inactivación o reducción de la proteína Agouti, molécula de señalización paracrina, y su receptor obj etivo, el de Melanocortina 1 (MC1R), que controla la producción temporal de la eumelanina y la feomelanina durante el crecimiento del pelo sería el principal factor para que aparezca alguna de las variables de los fenotipos expresados por el marcador Tabby (Kaelin y Barsh, 2013), incluyendo su forma recesiva Blotched tabby.
El marcador Blotched tabby, en ambientes rurales, podría presentar una ventaja selectiva, puesto que la herencia del color en el gato doméstico sugiere un mecanismo conservado, cuya apariencia puede ser alterada por la selección (Kaelin et al., 2012), y la presencia de este marcador podría ayudar en las estrategias de camuflaje, en la dinámica predador-presa (Mills y Patterson, 2009). Este hecho podría explicar que las frecuencias alélicas de Blotched tabby fueron las más altas en las tres poblaciones, dado que el estudio se realizó en un hábitat rural. Estos resultados difieren del estudio de Pardo et al. (2016) realizado en un hábitat urbano en la costa del Caribe colombiano, donde la frecuencia de Blotched tabby fue nula. Estos resultados sugieren que las presiones antrópicas en ambientes urbanos juegan un papel importante en el polimorfismo del color en poblaciones de gatos.
Los bajos valores del marcador Dominante blanco podrían estar relacionados a que este expresa efectos pleiotrópicos, que exhiben penetrancia completa para la ausencia de pigmentación del manto y penetrancia incompleta para la sordera (David et al., 2014). El fenotipo de los gatos blancos sordos se caracteriza por piel blanca, iris azul y pérdida de audición. Se estima que solo el 5% de los gatos de la población mundial son blancos y una subpoblación de estos son de ojos azules (Kral y Lomber, 2015). Este tipo de sordera en gatos blancos puede ser bilateral, aunque en algunos casos es unilateral con audición residual en el oído del lado opuesto (Kral y Lomber, 2015). Esta anomalía confiere una desventaja selectiva (Ryugo y Menotti-Raymond, 2012); hecho que podría explicar que los gatos de color blanco fueron los menos frecuentes en este estudio, pues un predador con limitaciones de audición en un medio rural ofrece ventajas frente a otros que poseen una adecuada audición.
En el estudio realizado en hábitat urbano en la ciudad de Lorica (Pardo et al., 2015), la población de gatos mostró una alta frecuencia de individuos portadores del marcador Orange (0.3516) debido a una posible selección, tanto natural como artificial. En el primer caso, podría deberse a que el marcador Orange es favorecido en ambientes urbanos (densidades poblacionales altas), en tanto que la selección artificial, debido a preferencias antrópicas por cuestiones estéticas, dado que los habitantes del área urbana de esta ciudad manifestaron una tendencia preferencial por gatos naranjas y sus dos formas heterocigotas (Calico y Tortoiseshell) (Pardo et al., 2015). A diferencia del hábitat urbano, en el presente estudio, las frecuencias del marcador Orange fueron bajas (0.1435), y la encuesta realizada a los habitantes del lugar no evidenció preferencias por algún fenotipo en particular. Es conocido que en ambientes rurales, las presiones antrópicas son menores y los fenotipos de coloraciones silvestres podrían verse favorecidos (Mills y Patterson, 2009).
Índice de Diversidad Genética
La heterocigosidad génica media, entendida como la media del número de individuos heterocigóticos observados por loci, es una de las estimaciones más empleadas para analizar la variabilidad genética de las poblaciones. En este estudio, en todos aquellos casos donde no se podía diferenciar los individuos heterocigóticos de los homocigóticos para los alelos activos, se supuso la existencia de equilibrio de Hardy-Weinberg y, por lo tanto, la heterocigosidad génica considerada, es la heterocigosidad génica esperada.
Los valores de heterocigosidad esperada encontrados en este estudio (0.2289), son menores que la heterocigosidad encontrada en la zona urbana de Lorica (He=0.3220) (Pardo et al., 2015). Los eventos evolutivos que alteran las frecuencias alélicas y, por ende, el número de individuos heterocigotos es más compleja si se tiene en cuenta que las presiones de selección, tanto natural como humana, y el flujo génico podrían ser mayores que en hábitat rural. Es así que la media de la la heterocigosidad esperada en este estudio fue baja, lo que indicaría un bajo nivel de diversidad genética.
Diferenciación Genética y Flujo Génico
El alto valor del índice de diferenciación génica (G ST ) indicaría que cerca del 25% de la variación detectada se debe a diferencias entre las poblaciones, que estas fueron significativamente diferentes para los marcadores estudiados, de allí que se deben analizar de forma independiente y no como una sola población; hecho que también es reflejado en el bajo valor del flujo genético.
Los gatos domésticos en ambientes rurales son usualmente de vida solitaria, pero no se descarta que algunas poblaciones vivan en camadas. Shreve y Udell (2015) encontraron un alto índice de paternidad múltiple en la población urbana (70-83% de las camadas con más de un padre), pero más baja en la población rural (0-22%). Asimismo, se reporta que los machos se reproducen tan pronto como alcanzan la madurez sexual (10 meses de edad) en la población urbana, mientras que la mayoría de los machos comienzan a reproducirse a los tres años en la población rural (Say et al., 1999). Estos factores inciden en la dinámica genéticapoblacional, lo que podría explicar la ausencia de equilibrio de Hardy-Weinberg de las poblaciones estudiadas. Esto estaría directamente relacionado con el exceso de homocigotos, el cual podría influir negativamente en el flujo genético, y posiblemente aumentar el efecto de endogamia; situación que sugiere una disminución en los niveles de panmixia y con ello un incremento de consanguinidad en la población. Por otra parte, la estimación de la relación de flujo génico podría afectarse con el aumento de la distancia geográfica (Hansen et al., 2008).
Estructura Poblacional
El índice de fijación o coeficiente de endogamia F representa la desviación de los genotipos con respecto al equilibrio de HardyWeinberg, dentro de una población y oscila en valores que van desde -1 (exceso de heterocigotos) hasta 1 (exceso de homocigotos). En este estudio, el exceso de homocigotos estaría relacionado con una fuerte relación de consanguinidad entre los individuos de cada población. Asimismo, el déficit de heterocigotos podría explicarse como resultado de selección natural de algunos fenotipos, que confieren cierta ventaja selectiva en la dinámica predador-presa y que ha conllevado a marcadores como Blotched tabby a un incremento de sus frecuencias alélicas (Kaelin y Barsh, 2013).
Los valores relativamente altos del índice F evidencian diferencias entre las poblaciones, las cuales podrían obedecer a que los patrones de colonización humana se reflejan en datos genéticos de poblaciones de gatos domésticos (Koch et al., 2015). Estas poblaciones fueron colonizadas por los españoles, pero una vez que la población negra de Cartagena se rebeló, se estableció en las zonas urbanas y rurales de Lorica, principalmente en las poblaciones de interconexión con medio y alto Sinú, como El Carito (Rhenals y Flórez, 2008). Es así que las poblaciones de gatos domésticos podrían haberse establecidas en diferentes épocas, lo cual podría explicar parte de las diferencias entre ellas.
CONCLUSIONES
-
La dinámica poblacional en cuanto al polimorfismo de genes que codifican el color de gatos en condiciones naturales o sin cuidado doméstico, probablemente difieran de las condiciones domésticas en hábitat urbanos.
-
Los resultados sugieren que marcadores de fenotipo silvestre ausentes o de baja frecuencia alélica como Blotched tabby en ambientes urbanos, se ven favorecidos en hábitat rural, en tanto que marcadores como Orange, debido a distintas presiones antrópicas por condiciones estéticas, han aumentado su frecuencia en ambientes urbanos, pero evidencian bajas frecuencias en hábitat rural.
-
Se reporta exceso de homocigotos y, por ende, déficit de heterocigotos, lo que conllevaría a un aumento de consanguinidad y bajos niveles de panmixia en la población, causando una desviación en el equilibrio de Hardy-Weinberg.
LITERATURA CITADA
1 . Andersson L. 2015. Domestic animals as models for biomedical research. Ups J Med Sci 121: 1-11. doi: 10.3109/03009734.2015.1091522 [ Links ]
2 . Bradshaw J, Horsfield G, Allen J, 2 . Bradshaw J, Horsfield G, Allen J, Robinson I. 1999. Feral cats: their role in the population dynamics of Felis catus. Appl Anim Behav Sci 65: 273-283. doi: 10.1016/S0168-1591(99)00086-6
3. David VA, Menotti -Raymond M, Wallace AC, Roelke M, Kehler J, Leight y R, Eizirik E, et al. 2014. Endogenous retrovirus insertion in the KIT oncogene determines white and white spotting in domestic cats. G3 (Bethesda) 4: 1881-1891. doi: 10.1534/ g3.114.013425 [ Links ]
4 . Eizirik E, David VA, Buckley-Beason V, Roelke ME, Schäffer AA, Hannah SS, Narfström K, et al. 2010. Defining and mapping mammalian coat pattern genes : multiple genomic regions implicated in domestic cat stripes and spots. Genetics 184: 267-275. doi: 10.1534/genetics.109.109629 [ Links ]
5. Ferreira JP, Leitão I, Santos-Reis M, Revilla E. 2011. Human-related factors regulate the spatial ecology of domestic cats in sensitive areas for conservation. PLoS One 6(10): e25970. doi: 10.1371/journal.pone.0025970 [ Links ]
6. Godoy J. 2009. La genética, los marcadores moleculares y la conservación de especies. Ecosistemas 18: 23-33. [ Links ]
7. Goudet J. 2001. FSTAT, a program to estimate and test gene diversities and fixation indices (version 2.9.3.2). [Internet]. Available in: http://www2.unil.ch/popgen/softwares/fstat.htm [ Links ]
8. Hansen H, Hess SC, Cole D, Banko PC. 2008. Using population genetic tools to develop a control strategy for feral cats (Felis catus) in Hawai’i. Wildlife Res 34: 587-596. doi: 10.1071/WR07043
9. Kaelin CB, Barsh GS. 2013. Genetics of pigmentation in dogs and cats. Annu Rev Anim Biosci 1: 125-156. doi: 10.1146/annurev-animal-031412-103659 [ Links ]
10. Kaelin CB, Xu X, Hong LZ, David VA, McGowan KA, Schmidt-Küntzel A, Roelke ME, et al. 2012. Specifying and sustaining pigmentation patterns in domestic and wild cats. Science 337: 1536-1541. doi: 10.1126/science.1220893 [ Links ]
11. Kaelin C, Barsh G. 2010. Tabby pattern genetics – a whole new breed of cat. Pigment Cell Melanoma Res 23: 514- 516. doi: 10.1111/j.1755-148X.2010.-00723.x [ Links ]
12. Koch K, Algar D, Searle JB, Pfenninger M, Schwenk K. 2015. A voyage to Terra Australis: humanmediated dispersal of cats. BMC Evol Biol 15: 262. doi: 10.1186/s12862-015-0542-7 [ Links ]
13. Kral A, Lomber SG. 2015. Deaf white cats. Current Biol 25: R351-R353. doi: 10.1016/j.cub.2015.02.040 [ Links ]
14. Mills MG, Patterson LB. 2009. Not just black and white: pigment pattern development and evolution in vertebrates. Semin Cell Dev Biol 20: 72-81. doi: 10.1016/j.semcdb.2008.11.012 [ Links ]
15. Montes-Díaz Y, Barrios YC, PardoPérez E. 2015. Análisis de la variabilidad genética de las poblaciones de gatos domésticos (Felis catus) mediante genes del pelaje en Cartagena, Colombia. Rev Academia Colombiana Ciencias Exactas, Físicas y Naturales 39: 503-513. doi: 10.18257/raccefyn.240 [ Links ]
16. Nei M. 1972. Genetic distance between populations. Am Naturalist 16: 283-292. [ Links ]
17. Pardo E, Morales J, Cavadia T. 2014. Estudio de la diversidad genética de la población de gato doméstico (Felis catus) en Montería, Colombia. Bistua 12: 35-47. [ Links ]
18. Pardo E, Causil L, Rodríguez A. 2015. Estudio de la diversidad genética de gato doméstico (Felis catus) mediante genes asociados al color del pelaje en Lorica-Córdoba, Colombia. Arch Zootec 64: 389-395. [ Links ]
19. Pardo E, Montes Y, Cardales Y. 2016. Variabilidad genética del gato doméstico (Felis catus) en Magangué, Bolívar, Colombia. Rev Inv Vet Peru 27: 277-287. doi: 10.15381/rivep.v27i2.11661 [ Links ]
20. Rhenals AM, Flórez F. 2008. Entre lo árabe y lo negro: raza e inmigración en Cartagena, 1880-1930. Sociedad Econom 15: 123-144. [ Links ]
21. Robinson R. 1987. Mutant genefrequencies in cats of the Greater London area. Appl Genetics 74: 579-583. doi: 10.1007/BF00288855 [ Links ]
22. Ruiz-García M, Alvarez D. 2003. Análisis de seis poblaciones latinoamericanas de gatos mediante genes del pelaje y marcadores microsatélites. Acta Zool Mex 89: 261-286. [ Links ]
23. Ryugo DK, Menotti-Raymond M. 2012. Feline deafness. Vet Clin North Am Small Anim Pract 42: 1179-1207. doi: 10.1016/j.cvsm.2012.08.008 [ Links ]
24. Say L, Pontier D, Natoli E. 1999. High variation in multiple paternity of domestic cats (Felis catus L.) in relation to environmental conditions. Proc Biol Sci 266: 2071-2074. doi: 10.1 098/rspb.1999.0889 [ Links ]
25. Schneider A, Henegar C, Day K, Absher D, Napolitano C, Silveira L, David VA, et al. 2015. Recurrent evolution of melanism in South American felids. PLoS Genet 11: e1004892. doi: 10.1371/journal.pgen.1005126 [ Links ]
26. Shreve KRV, Udell MA. 2015. What’s inside your cat’s head? A review of cat (Felis silvestris catus) cognition research past, present and future. Anim Cogn 18: 1195-1206. doi: 10.1007/ s10071-015-0897-6
27. Sims V, Evans KL, Newson SE, Tratalos JA, Gaston KJ. 2008. Avian assemblage structure and domestic cat densities n urban environments. Diversity Distrib 14: 387-399. doi: 10.1111/j.1472-4642.2007.00444.x [ Links ]
28. Thomas RL, Fellowes MD, Baker PJ. 2012. Spatio-temporal variation in predation by urban domestic cats (Felis catus) and the acceptability of possible management actions in the UK. PLoS On e 7( 11) : e4936 9. doi : 10 .137 1/ journal.pone.0049369 [ Links ]
29. Yeh F, Yang R, Boyl e T. 1999 . Microsoft Windows-based freeware for population genetic analysis. Release 1.31. University of Alberta, Edmonton. 29 p. [ Links ]
Recibido: 15 de julio de 2016
Aceptado para publicación: 16 de diciembre de 2016