Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.28 no.2 Lima abr./jun. 2017
http://dx.doi.org/10.15381/rivep.v28.i2.13073
ARTÍCULOS PRIMARIOS
Resistencia Antibiótica de Enterobacterias Aisladas de Monos (Ateles, Callicebus y Lagothrix) en Semicautiverio en un Centro de Rescate, Perú
Antibiotic resistance of enterobacteria isolated from monkeys (Ateles, Callicebus and Lagothrix) in semi-captivity in a rescue centre, Peru
Claudia Medina G.1, Siever Morales C.2,4, Miluska Navarrete Z.3
1 Carrera de Medicina Veterinaria y Zootecnia, Universidad Científica del Sur, Lima, Perú
2 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú.
3 Laboratorio de Anatomía Animal y Fauna Silvestre, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú.
4 Email: sieverm@hotmail.com
RESUMEN
El Perú cuenta con diversos géneros y especies de primates no humanos, dentro de los que se encuentran las especies Ateles belzebuth, Ateles chamek, Callicebus oenanthe, Lagothrix cana y Lagothrix lagotricha cuyos estados de conservación según la Lista Roja de la UICN se encuentran en la categoría amenazada. El objetivo del presente estudio fue determinar el perfil de resistencia antibacteriana de cepas entéricas aisladas de Ateles, Callicebus y Lagothrix en semicautiverio en un centro de rescate, Perú. La toma de muestras se realizó por hisopado rectal en 56 primates no humanos habitantes del Centro de Rescate y Rehabilitación de Primates Ikama Peru. El aislamiento e identificación bacteriana se realizó mediante un protocolo estándar, y la sensibilidad bacteriana mediante la técnica de Kirby-Bauer. Se aislaron 106 cepas bacterianas de la familia Enterobacteriaceae. La especie de mayor prevalencia fue Escherichia coli con 42.5% (45/106). Los aislados mostraron mayor grado de resistencia a cefalotina (46.2%), amoxicilina ácido clavulánico (31.1%), tobramicina (30.2%) y tetraciclina (24.5%).
Palabras clave: enterobacterias, monos, Ateles, Callicebus, Lagothrix, resistencia, antibióticos
ABSTRACT
Several genera and species of nonhuman primates can be found in Peru. Among them, Ateles belzebuth, Ateles chamek, Callicebus oenanthe, Lagothrix cana and Lagothrix lagotricha. These species according to the IUCN Red List are in the threatened category. The aim of this study was to determine the antibacterial sensitivity profile of enteric isolates from Ateles, Callicebus and Lagothrix raised in semi-captivity. Sampling was performed by rectal swab in 56 nonhuman primates in the Center for Rescue and Rehabilitation of Primates Ikama Peru. Isolation and bacterial identification was performed using a standard protocol and bacterial sensibility by the Kirby-Bauer technique. A total of 106 bacterial strains of the family Enterobacteriaceae were isolated, where the most prevalent species was Escherichia coli (45.5%, 45/106). The isolates showed greater resistance to cephalothin (46.2%), amoxicillin clavulanate (31.1%), tobramycin (30.2%) and tetracycline (24.5%).
Key words: enterobacteriaceae, monkeys, Ateles, Callicebus, Lagothrix, resistance, antibiotics
INTRODUCCIÓN
La familia Enterobacteriaceae se encuentra ampliamente distribuida en el medio ambiente y forman parte de la flora intestinal normal de los animales, incluyendo los primates no humanos; sin embargo, pueden llegar a actuar como patógenos oportunistas y producir enfermedad. Los géneros de import anci a veteri nar ia son Cit robacter, Edwardsiella, Enterobacter, Escherichia, Hafnia, Morganella, Proteus, Salmonella, Serratia y Shigella (Quinn et al., 2011).
En colonias de primates no humanos se ha reportado, asimismo, el aislamiento de bacterias de los géneros Escherichia, Proteus, Enterobacter, Citrobacter y Edwardsiella a partir de hisopados rectales y muestreos coprológicos (Loureiro et al., 1985; Banish et al., 1993; Vargas et al., 2010). Además, en animales en cautiverio se han reportado bacterias del género Salmonella, especialmente asociado con casos clínicos de diarrea (Loureiro et al., 1985; Lee et al., 2011; Ferreira et al., 2012; Rivera et al., 2013).
Las enterobacterias tienen gran capacidad de adaptación a través de mecanismos de mutaciones y recombinaciones génicas, que les permiten adquirir características de resistencia a antibacterianos y otros factores de virulencia (Acha y Szyfres, 2001; Quinn y Markey, 2003; Garrity et al., 2005; Pachón, 2009; Quinn et al., 2011; Rivera et al., 2013).
La resistencia bacteriana es un fenómeno que sucede tanto en humanos como en animales y su estudio en el Perú es importante, porque hay muy poca información sobre el tema. Existen reportes de bacterias de importancia clínica, como Escherichia coli, Pseudomonsa aeruginosa, Klebsiella pneumoniae y Staphylococcus aureus, que han sido aisladas de animales silvestres en cautiverio, como en el azor (Accipiter gentilis), ardillas (Sciurus granatensis), búhos (Bubo virginianus) y gaviotas (Larus sp) (Steele et al., 2005; Ahmed et al., 2007)
En el presente estudio se muestrearon monos mantenidos en semicautiverio, habitantes de las reservas de La Media Luna (Loreto) y Tarangue (San Martín), bases del «Centro de Rescate y Rehabilitación de Primates Ikamaperu». Los monos son miembros de las especies Ateles belzebuth, A. chamek, Callicebus oenanthe, Lagothrix cana y L. lagotricha. De acuerdo a la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (UICN), son especies consideradas en la categoría Amenazada (Boubli et al., 2008; Palacios et al., 2008; Wallace et al., 2008; Veiga et al., 2011), siendo el mono tocón de San Martín (C. oenanthe) una especie endémica del Perú (Bóveda-Penalba et al., 2009) y que además ha sido declarada como parte de la lista de los 25 primates que se encuentran en mayor peligro a nivel mundial (Schwitzer et al., 2014).
La convivencia entre animales silvestres, domésticos y el humano, relacionado con la resistencia antimicrobiana y sus consecuencias ha sido muy poco estudiada (Vargas et al., 2010). Por ello, el objetivo de este estudio fue aislar enterobacterias de animales criados en semicautiverio y determinar su resistencia antibiótica.
MATERIALES Y MÉTODOS
Población Animal
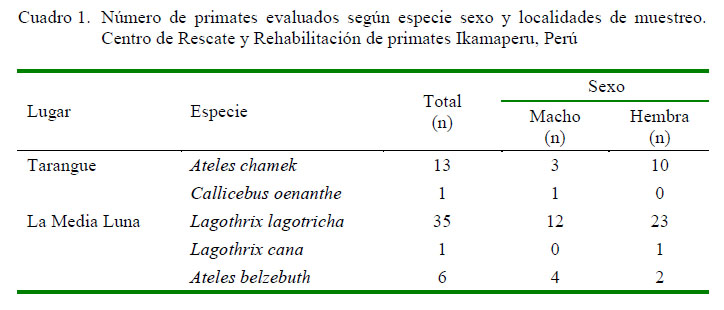
El muestreo se hizo en la totalidad de la población de los primates no humanos (N=56) que se encontraba en semicautiverio en las dos bases del Centro de Rescate y Rehabilitación de primates Ikamaperu, con resolución administrativa N° 006-2008-INRENATFFS-Yurimaguas (Cuadro 1). Los animales provienen de confiscaciones del tráfico ilegal de fauna silvestre en Lima y provincias y se encontraban en proceso de rehabilitación con el fin de una posterior reintroducción a su hábitat natural.
Toma de Muestras
Para la contención química, los animales fueron anestesiados, previo ayuno, con ketamina (5 mg/kg PV) y diazepam (10 mg/ kg PV), vía IM, mediante el uso de una cerbatana. Se registró el sexo y edad aproximada de cada primate, así como la temperatura rectal, frecuencia cardiaca y frecuencia respiratoria durante el proceso anestésico.
Se tomaron muestras de contenido rectal mediante hisopos estériles humedecidos en solución salina. Los hisopos con las muestras se depositaron en tubos de tapa rosca que cont e nían e l medi o de t ranspo rte bacteriano agar Stuart (Merck®). Las muestras fueron conservadas y transportadas durante 72 h, aproximadamente, en cajas de poliestireno expandido (Telgopor®) con refrigerantes a temperaturas entre 4 y 8 ºC al Laboratorio de Microbiología de la Universidad Científica del Sur, Lima, para su procesamiento.
Procesamiento de las muestras
Promoción de crecimiento
Los hisopos se inocularon en tubos con caldo de enriquecimiento Tripticasa Soya (TSB, Merck) y fueron incubados durante 24 h a 37 ºC.
Siembra en medios de cultivo
Las muestras inoculadas en caldo TSB fueron sembradas a partir de una anzada por agotamiento en agar sangre y agar MacConkey (MC), e incubadas durante 24 h a 37 ºC. Se realizó la tinción Gram con las colonias resultantes y se hicieron las pruebas bioquímicas correspondientes.
Las colonias seleccionadas fueron sometidas a las siguientes pruebas bioquímicas: citrato de Simmons, hierro tres azúcares (TSI), descarboxilación de lisina (LIA), sulfuro de hidrógeno-indol-motilidad (SIM), ureasa, catalasa y oxidasa. Tras una incubación de 24 h a 37 ºC, se cotejaron los resultados para su identificación.
Prueba de sensibilidad antibiótica
Esta prueba se desarrolló de acuerdo al método de Kirby-Bauer. Para ello, se inoculó la cepa en placas de agar Mueller Hinton (MH), y se colocaron los discos antibióticos a evaluar. Tras una incubación de 24 h a 37 ºC se realizó la lectura de los halos de inhibición del crecimiento. Los resultados fueron interpretados según las tablas de estándares de halos de inhibición, y la sensibilidad de las cepas fue reportada como sensible (S), sensibilidad intermedia (I) o resistente (R) (INS, 2002).
Se evaluó el perfil de sensibilidad de las cepas aisladas frente a los antibióticos a mikacina (AK) , amoxicilina ácido clavulánico (AMC), ampicilina sulbactam (SAM), cefalotina (CF), cefuroxima (CXM), ceftria xona (CTR), cloran fenicol (C), en rofloxacino (E), gentamicina (GE), sulfamet oxazoltrime toprim (SXT), tetraciclina (TE) y tobramicina (TB).
RESULTADOS
Se aislaron 106 cepas bacterianas (Cuadro 2) de la familia Enterobacteriaceae (31 cepas en primates de la Reserva Tarangue y 75 cepas en primates de la Reserva La Media Luna).
De estos, las bacterias con mayor porcentaje de aislamiento fueron la E. coli (n=45) y la Serratia (n=29); mostrando la E. coli sensibilidad a ceftriaxona el 93.3% (42/45), ampicilina sulbactam 86.7% (39/45), sulfametoxazol trimetoprim 84.4% (38/45), amikacina 80.0% (36/45), amoxicilina.acido clavulonico 73% (33/45), cloranfenicol 71% (32/45), enrofloxacina con 71% (32/45), tobramicina 60% (27/45), tetraciclina 53.3% (24/45), cefalotina 37.8% (17/45); y Serratia sp. cuya sensibilidad a gentamicina es del 100% (29/29), amikacina 93.1% (27/29), sulfametoxazol-trimetoprim 89.7% (26/29), ampicilina – sulbactam 79.3% (23/29), ceftriaxsona 79.3% (23/29), enrofloxacina (17/29), cloranfenicol (16/29), tobramicina (15/29), tetraciclina (5/29), entre otros.
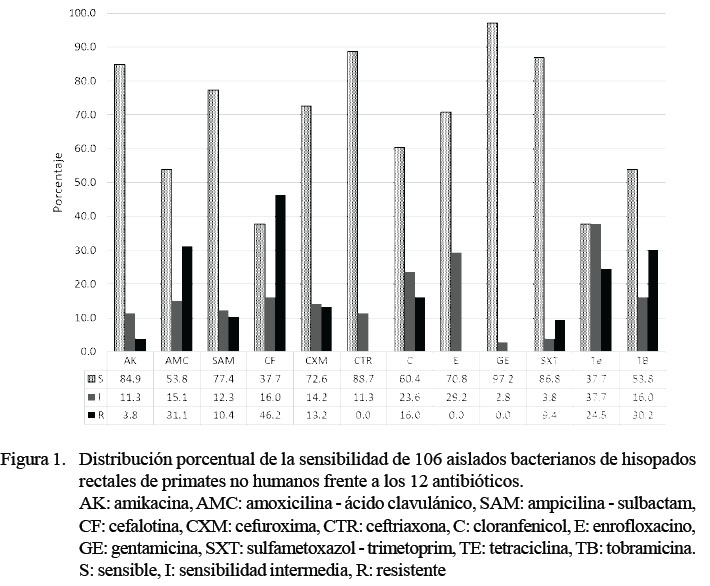
La Figura 1 muestra los porcentajes de sensibilidad, sensibilidad intermedia y resistencia de las cepas aisladas frente a cada uno de los 12 antibióticos en estudio. Las mayores sensibilidades se observaron frente a gentamicina (97.2%), ceftriaxona (88.7%), sulfatrimetroprim (86.8%) y amikacina (84.9%).
DISCUSIÓN
La bacteria aislada de mayor frecuencia fue E. coli fue (42.5%), seguido de bacterias del género Serratia (27.4%). Estas y las demás que fueron encontradas representan un potencial riesgo de infección, ya que los microorganismos podrían actuar como patógenos oportunistas y producir enfermedad en la población animal en estudio, así como ser transmitidos a los seres humanos que entren en contacto con ellos (Loureiro y Carvalho, 1984; Quinn et al., 2002; Simmons y Gibson, 2012). No obstante, el perfil de sensibilidad antibiótica demostró que existen opciones antibióticas que podrían evaluarse con un antibiograma para el control de un eventual brote de enfermedad en los animales.
Las diferencias en especies de bacterias entre las reservas podrían deberse al desigual número de muestras colectadas, así como por su localización geográfica, pues si bien ambas reservas se encuentran en zona de selva, la oferta de frutos y hojas como fuentes de alimentación es diferente y esto influye en la flora bacteriana intestinal de los primates.
En general (Figura 1), los aislados bacterianos mostraron mayor mayor porcentaje de sensibilidad frente a gentamicina (97.2%), amikacina (84.9%) y ceftriaxona (88.7%) y los antibióticos con mayor porcentaje de resistencia fueron cefalotina (46.2%), amoxicilina ácido clavulánico (31.1%), tobramicina (30.2%) y tetraciclina (24.5%). En relación al perfil de sensibilidad antibiótica mostrado por las cepas de los géneros más prevalentes en el presente estudio, las cepas de E. coli (n=45) no presentaron resistencia a gentamicina, tal como sucedió con las 31 cepas de E. coli reportada por Vargas et al. (2010) en muestras rectales y nasales de aves y mamíferos del Zoológico de Barranquilla, entre los que se encontraban primates no humanos.
La alta sensibilidad de las cepas de E. coli (n=45) a ceftriaxona (93.3%), ampicilina-sulbactam (86.7%), sulfametoxazol trimetoprim (84.4%) y amikacina (80.0%) concuerda con el estudio de Hauser (2012). Esto evidencia que la característica de resistencia o sensibilidad de las cepas bacterianas es determinada de forma multifactorial, y estaría influenciado por las condiciones ambientales, físicas y químicas, y tipo de hospederos, entre otros.
El segundo género que presentó mayor prevalencia fue Serratia (n=29), cuyo perfil de sensibilidad mostró que las cepas fueron sensibles a gentamicina (100%), amikacina (93.1%) y sulfametoxazol-tri metopri m (89.7%). Hauser (2012) indica que los miembros de este género generalmente son sensib l es a s u l f a me t ox a zol -t ri me to pr im y aminoglucósidos. Asimismo, señala que generalmente son resistentes a las penicilinas (amoxicilina y ampicilina); sin embargo, la resistencia a amoxicilina-ácido clavulánico y ampicilina-sulbactam en este estudio fue de 44.8 y 10.4%, respectivamente, debido a que ambas aminopenicilinas estaban asociadas a un agente inhibidor de betalactamasas, como son el ácido clavulánico y el sulbactam.
En relación al género Salmonella, se aisló S. arizonae con una prevalencia de 3.8%. Otros autores reportan la presencia de Salmonella spp en muestras fecales de una diversidad de especies de primates no humanos, incluyendo Alouatta clamitans, Saimiri sci ureus, Lagot hrix lagotri cha, Cebus albifrons y Cebus apella (Souza-Júnior et al., 2008; Ferreira et al., 2012; Rivera et al., 2013), aunque no necesariamente presentaban signos de infección por Salmonella. En este estudio, las cuatro cepas de S. arizonae fueron sensibles a ceftriaxona y tres de ellas a amikacina, cefuroxima, gentamicina y sulfametoxazol-trimetoprim. Este resultado concuerda con Hauser (2012), quien indica que Salmonella spp es sensible a quinolonas, cefalosporinas de tercera generación y sulfametoxazol-trimetoprim.
Las dos cepas que se aislaron del género Shigella son de importancia, ya que un brote de shigelosis en una colonia de primates no humanos puede llevar a los animales a la muerte si no es tratada a tiempo y de manera adecuada (Nizeyi et al., 2001; Lee et al. 2011). Además, existe un riesgo potencial de transmisión de la bacteria al ser humano (Loureiro y Carvalho, 1984).
CONCLUSIONES
-
Los géneros bacterianos más prevalentes en los monos At eles, Calli cebus y Lagothrix que viven en semicautiverio en un centro de rescate en los departamentos de San Martín y Loreto, Perú, fueron Escherichia con 42.5% (45/106), y Serratia con 27.4% (29/106).
-
Las cepas aisladas mostraron mayor grado de resistencia a cefalotina (46.2%), amoxicilina ácido clavulánico (31.1%), tobramicina (30.2%) y t etracicl ina
(24.5%).
LITERATURA CITADA
1 . Acha PN, Szyfres B. 2001. Shigelosis. En: Zoonosis y enfermedades transmisibles comunes al hombre y a los animales. Vol 1. Bacteriosis y micosis. 3a ed. Washington DC: OPS. p 255-259. [ Links ]
2 . Ahm ed AM, Mot oi Y, Sato M, Maruyama A, Watanabe H, Fukumoto Y, Shimamoto T. 2007. Zoo animals as reservoirs of Gram-negative bacteria harboring integrons and antimicrobial resistance genes. Appl Environ Microbiol 73: 6686-6690. doi: 10.1128/AEM.01054-07 [ Links ]
3 . Banish LD, Sims R, Sack D, Montali RJ, Phillips L Jr, Bush M. 1993. Prevalence of shigellosis and other enteric pathogens in a zoologic collection of primates. J Am Vet Med Assoc 203: 126-132. [ Links ]
4 . Boubli JP, Di Fiore A, Rylands AB, Wallace RB. 2008. Lagothrix cana. The IUCN Red List of Threatened Species. [Internet]. Disponible en: http://www.iucnredlist.org/details/39925/0 [ Links ]
5. Bóveda-Penalba A, Vermeer J, Rodrigo F, Guerra-Vásquez F. 2009. Preliminary report on the distribution of Callicebus oenanthe on the eastern feet of the Andes. Int J Primatol 30: 467-480. doi: 10.1007/s10764-009-9353-2 [ Links ]
6 . Ferreira DRA, Santos A de S, Wagner PGC, Reis EMF dos, Pinheiro Júnior J W, Po rt o WJ N, et al . 2 01 2. Ocorrênci a de Sal monell a spp em Cebus spp mantidos em centros de triagem de animais silvestres no nordeste do Brasil. Biotemas 25: 181-186. doi: 10.5007/2175-7925.2012v25n2p181 [ Links ]
7 . Garrity GM, Brenner DJ, Krieg NR, Staley JR. 2005. Order X III. Enterobacteriales. In: Bergey’s manual of systematic bacteriology. Vol 2. The Proteobacteria, Pt. B. The Gammaproteobacteria. 2nd ed. New York: Springer. p 587-849.
8 . Hauser AR. 2012. Gram-negative bacteria. In: Antibiotic basics for clinicians: the ABCs of choosing the right antibacterial agent. 2nd ed. Baltimore: Lippincott Williams & Wilkins. p 121-144. [ Links ]
9 . [INS] Instituto Nacional de Salud. 2002. Manual de procedimientos para la prueba de sensibilidad antimicrobiana por el método de disco difusión: serie de normas técnicas N° 30. Lima: INS. Ministerio de Salud del Perú. 67 p. [ Links ]
10. Lee JI, Kim SJ, Park CG. 2011. Shigella flexneri infection in a newly acquired rhesus macaque (Macaca mulatta). Lab Anim Res 27: 343-346. doi: 10.5625/lar.2011.27.4.343 [ Links ]
11. Loureiro ECB, Carvalho RA. 1984. Surto de shigelose entre primatas não humanos mantidos em cativeiro. Rev Latinoam Microbiol 26: 305-308. [ Links ]
12. Loureiro ECB, Muniz JAPC, Kingston WR. 1985. Enterobactérias detectadas em pri matas capt urados na regiäo amazônica do Brasil. Rev Fund SESP 30: 12112-6. [ Links ]
13. Nizeyi JB, Innocent RB, Erume J, Kelema GRNN, Cranfield MR, Graczyk TK. 2001. Campylo bacteriosis, salmonellosis, and shigellosis in free-ranging human-habituated mountain gorillas of Uganda. J Wildl Dis 37: 239-244. [ Links ]
14. Pachón D. 2009. Aislamiento, identificación y serotipificación de enterobacterias del género Salmonella en una población de Crocodylus intermedius y testudinos mantenidos en cautiverio en la Estación de Biología Tropical Roberto Franco E.B.T.R.B de la Facultad de Ciencias, Universidad Nacional de Colombia en Villavicencio – Meta. Tesis de Grado. Bogotá: Pontificia Universidad Javeriana. 115 p. [ Links ]
15. Palacios E, Boubli JP, Stevenson P, Di Fiore A, de la Torre S. 2008. Lagothrix lagotricha. The IUCN Red List of Threatened Species. [Internet]. Disponible en: http://www.iucnredlist.org/details/11175/0 [ Links ]
16. Quinn PJ, Markey BK. 2003. Enterobacteriaceae 2. En: Elementos de microbiología veterinaria. Zaragoza: Ed Acribia. p 77-80. [ Links ]
17. Quinn PJ, Markey BK, Carter ME, Donnelly WJC, Leonard FC. 2002. Enterobacteriaceae. En: Microbiología y enfermedades infecciosas veterinarias. Zaragoza: Ed Acribia. p 125-146. [ Links ]
18. Quinn PJ, Markey BK, Leonard FC, Fitzpatrick ES, Fanning S, Hartigan PJ. 20 11. Enterobacteriaceae . In: Veterinary microbiology and microbial disease. 2nd ed. United Kingdom: WileyBlackwell. p 263-286. [ Links ]
19. Rivera LG, Ortegón LH, Estrada G, Granja YT, Nuñez JM. 2013. Aislamiento, identificación y patrón de sensibilidad antimicrobiana de Salmonella spp en primates en cautiverio. Rev Colomb Cienc Anim 5: 131-144. [ Links ]
20. Schwitzer C, Mittermeier RA, Rylands AB, Taylor LA, Chiozza F, Williamson EA, et al. 2014. Primates in peril: the world’s 25 most endangered primates 2012-2014. Bristol, UK: International Primatological Society. 87 p.
21. Simmons J, Gibson S. 2012. Bacterial and mycotic diseases of nonhuman primates. In: Abee CR, Mansfield K, Tardif S, Morris T (eds). Nonhuman primates in biomedical research. Vol 2. 2nd ed. Canada: Academic Press. p 105-172. [ Links ]
22. Souza Júnior JC de, Hirano ZM, Ávila-Pires FD de, Vieira GR. 2008. Nota sobre infecção por Salmonella sp e Shigella sp em bugios-ruivos, Alouatta clamitans (Primates: Atelidae) mantidos em cativeiro. Braz J Vet Res Anim Sci 45: 266-268. [ Links ]
23. Steele C, Brown R, Botzler R. 2005. Prevalences of zoonotic bacteria among seabirds in rehabilitation centers along the coast of California and Washington, USA. J Wildl Dis 41: 735-744. doi: 10.7589/0090-3558-41.4.735 [ Links ]
24. Vargas J, Máttar S, Monsalve S. 2010. Bacterias patógenas con alta resistencia a antibióticos: estudio sobre reservorios bacterianos en animales cautivos en el zoológico de Barranquilla. Infectio 14(1): 6-19. doi: 10.1016/S0123-9392(10)70088-6 [ Links ]
25. Veiga L, Bóveda-Penalba A, Vermeer J, Tello-Alvarado JC, Cornejo F. 2011. Callicebus oenanthe. The IUCN Red List of Threatened Species [Internet]. Disponible en: http://www.iucnredlist.org/details/3553/0 [ Links ]
26. Wallace RB, Mittermeier RA, Cornejo F, Boubli JP. Ateles chamek. The IUCN Red List of Threatened Species [Internet]. Disponible en: http://www.iucnredlist.org/details/41547/0 [ Links ]
Recibido: 3 de mayo de 2016
Aceptado para publicación: 30 de noviembre de 2016