Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.28 no.3 Lima jul./set. 2017
http://dx.doi.org/10.15381/rivep.v28.i3.13287
ARTÍCULOS PRIMARIOS
Frecuencia y Riesgo de Infección de Leptospirosis Bovina en Dos Establos Lecheros de la Costa y Sierra Peruana
Frequency and Risk of Infection of Bovine Leptospirosos in Two Dairy Farms of the Coast and Highlands of Peru
Luis Llanco A.1, Francisco Suárez A.1,4, Wilfredo Huanca L.2, Hermelinda Rivera G.3
1 Laboratorio de Epidemiología y Economía Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
2 Laboratorio de Reproducción Animal, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
3 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
4 E-mail: francisco_suarez2001@hotmail.com
RESUMEN
El estudio tuvo por objetivo determinar la frecuencia y riesgo de infección de leptospirosis bovina en establos lecheros de la costa y sierra peruana. Se obtuvieron 88 muestras de sangre en un establo de la zona de Lima (costa) y 163 muestras en un establo de la zona de Huancayo (sierra). Las muestras fueron analizadas mediante la prueba de microaglutinación para detectar anticuerpos frente a los serovares canicola, pomona, icterohaemorrhagiae y hardjo. Se encontraron seroprevalencias de 14.8 y 12.3% en los establos de Lima y Huancayo, respectivamente, siendo el serovar icterohaemorrhagiae el único detectado en Lima y los serovares icterohaemorrhagiae y hardjo en Huancayo.
Palabras clave: bovino; leptospirosis; seroprevalencia; riesgo de infección
ABSTRACT
The study aimed to determine the seroprevalence and risk of infection of bovine leptospirosis in dairy farms of the Peruvian coast and highlands. A total of 88 blood samples were obtained in a farm in the area of Lima (coast) and 163 samples in a farm in the area of Huancayo (highlands), both belonging to the National University of San Marcos. The samples were analyzed by the microagglutination test to detect antibodies to serovars canicola, pomona, icterohaemorrhagiae and hardjo. Seroprevalences of 14.8 and 12.3% were found in Lima and Huancayo farms respectively, where the serovar icterohaemorrhagiae was the only detected in Lima and serovars icterohaemorrhagiae and hardjo in Huancayo farms.
Key words: bovine; leptospirosis; seroprevalence; risk of infection
INTRODUCCIÓN
Las cepas patógenas de Leptospira interrogans poseen capacidad de infectar a un amplio número de hospederos que incluyen al hombre y animales, causando enfermedad que cursa con cuadro clínico agudo, algunas veces fatal, en los hospederos accidentales, o crónico asintomático en los hospederos que actúan como reservorios naturales (Zuerner, 2015). La progresión del cuadro clínico depende principalmente del serovar infectante y de la especie hospedera (Radostits et al., 2002).
En la actualidad, la leptospirosis es considerada una importante zoonosis y reemergente debido al aumento del número de casos en todo el mundo (Guerra, 2013). Su presentación en el hombre se relaciona a cambios climáticos, aumento en la precipitación pluvial, características del suelo que favorecen la supervivencia del agente, desplazamientos poblacionales y algunas actividades de riesgo que permiten el contacto directo con ambientes contaminados, principalmente con la orina de los animales reservorios (Acha y Szifres, 2001).
La leptospirosis tiene distribución mundial, siendo más común en los países tropicales y subtropicales de alta humedad, donde se dan las facilidades para su transmisión (Acha y Szyfres, 2001; Artiushin et al., 2004), especialmente durante la temporada de lluvias, donde se incrementa el número de infecciones (Subharat et al., 2012). Otros factores de riesgo reportados en los sistemas de producción lecheros incluyen la elevada densidad animal, aún durante cortos periodos de tiempo, y defectos en la integridad de las instalaciones que facilitan la acumulación de excretas, contribuyendo en la diseminación y mantenimiento de la infección, tornando ineficientes la vacunación y uso de antibióticos (Martins et al., 2012).
Estudios de seroprevalencia señalan entre 34 y 65% en EEUU y Canadá (30 y 45% positivos a L. hardjo, respectivamente) y entre 25 y 65% en Europa, Australia, Nueva Zelandia y América del Sur (también a L. hardjo) (Fang et al., 2014; Peregrine et al., 2006; Subharat et al., 2012). Hardjo-bovis, es la serovariedad más común en Reino Unido, Australia, Nueva Zelanda y EEUU; asimismo, hardjo-bovis resultó ser la más común en ganado de carne y pomona en el ganado lechero en Canadá (Grooms., 2006; Radostits, 2002). L. hardjo ha sido identificado como el principal responsable, individual o asociado a otros patógenos como Neospora caninum o Brucella abortus, de causar aborto bovino en México (Escamilla et al., 2007). Por otra parte, en algunos países latinoamericanos como Venezuela, México, Colombia y Brasil se han reportado seroprevalenciass de 42, 10, 61 y 45%, respectivamente (Godoy et al., 1997, León et al., 2008; Ochoa et al., 2000; Nilson, 2003; Martins et al., 2012). En el Perú, estudios llevados a cabo por Arias et al (2011) en bovinos de la sierra sur, reportaron una seroprevalencia de 2.6 % frente a Leptospira icterohaemorrhagiae.
La repercusión económica más importante en la explotación bovina son los problemas reproductivos que se manifiestan principalmente con la presentación de abortos, nacimiento de animales débiles y disminución de la eficiencia reproductiva (Radostits, 2002). Por esta razón, es importante realizar exámenes serológicos que permitan identificar o descartar la leptospirosis como causa de fallas reproductivas en la lechería bovina del país.
En el presente estudio se determinó la frecuencia de leptospirosis bovina en dos localidades del país y se estableció el riesgo de infección asociado a la localidad utilizando la técnica de microaglutinación (MAT).
MATERIALES Y MÉTODOS
Localidad y Muestreo
Se trabajó con163 bovinos del establo de la Estación Experimental del Centro de Investigación IVITA – El Mantaro, el cual forma parte de la Facultad de Medicina Veterinaria (FMV) de la Universidad Nacional Mayor de San Marcos (UNMSM). La estación experimental está ubicada en el valle del Mantaro, Huancayo, departamento de Junín, a una altitud de 3249 msnm, representando la sierra central del Perú. El sistema de crianza era semiintensivo, con suministro de concentrado al momento de ordeño y pastoreo sobre pastos mejorados el resto del día.
Asimismo, se trabajó con 88 bovinos lecheros del establo de la FMV-UNMSM, localizado en el distrito de San Borja, departamento de Lima, a una altitud de 170 m, representando la zona de costa central del país. El sistema de producción era de tipo estabulado, con alimentación a base de maíz chala como forraje verde picado y uso de concentrados.
Los animales muestreados correspondieron al total de la población de hembras entre 3 meses y 7 años de edad. Se tomaron muestras de sangre por punción de la vena caudal. Los sueros se obtuvieron por centrifugación (900 g por 10 min) y fueron almacenados a -20 ºC en los laboratorios de la FMV-UNMSM, Lima, hasta el momento de su análisis.
Prueba de Microaglutinación (MAT)
La prueba de MAT fue realizada en el laboratorio de microbiología de la FMVUNMSM, siendo las normas recomendadas por WHO (2004). Para esto, se incluyeron los serovares icterohaemorrhagiae, pomona, hardjo y canicola, que son los más prevalentes e importantes en el ganado bovino. Los serovares empleados fueron proporcionados por el Laboratorio de Microbiología de la FMV-UNMSM, donde se usan rutinariamente en el diagnóstico de leptospirosis.
Suspensiones con cada uno de los cuatro serovares de leptospiras vivas fueron colocadas en una placa de 96 pocillos que contenían diluciones en serie (1/100, 1/200, 1/400, 1/800, 1/1600) de los sueros problema. Se incubaron durante 2 h a 28 °C. El título obtenido fue calculado como el recíproco de la dilución más alta del suero que aglutinó por lo menos el 50% de las bacterias para cada serovar al ser observado con el microscopio de campo oscuro. Como control negativo se utilizaron pocillos que contenían el antígeno diluido solamente con suero fisiológico y como control positivo se emplearon sueros con resultados positivos ya titulados con anterioridad.
Análisis de Datos
La prevalencia de leptospirosis fue determinada teniendo en consideración la seropositividad de los sueros a la MAT, siendo expresada en forma porcentual (Gordis, 2014), en tanto que para evaluar la localidad como factor de riesgo se calculó el Odds ratio (Daniel, 2004), teniendo en consideración la positividad de los sueros y la procedencia de los animales.
RESULTADOS Y DISCUSIÓN
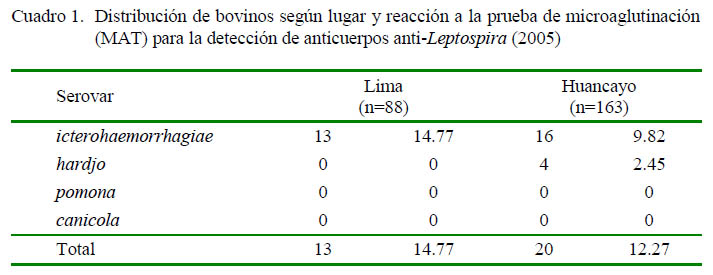
Los dos establos resultaron seropositivos a leptospirosis al contar con al menos un animal positivo a la prueba de MAT (Cuadro 1). Así, en el establo de la costa se detectó una prevalencia de 14.8%, correspondiendo exclusivamente al serovar icterohaemorrhagiae, en tanto que la prevalencia en el establo de la sierra fue de 12.3%, detectándose los serovares icterohaemorrhagiae y hardjo (Cuadro 1). Ningún animal mostró positividad a más de un serovar. Asimismo, no hubo reacción positiva a los serovares pomona o canicola (Cuadro 1).
Se considera que la infección por un serovar no adaptado al hospedero definitivo ocurre en áreas donde el intermediario actúa como reservorio, interactuando con el primero, donde las infecciones cruzadas entre ambos mantienen el patógeno en el ambiente (Bahari et al., 2011). Esto explicaría la mayor prevalencia detectada frente al serovar icterohaemorragiae, que tiene a los roedores como hospederos definitivos. Estos animales son ubicuos, difíciles de eliminar sin las medidas sanitarias adecuadas, tienen una tasa de reproducción elevada y están siempre en contacto con los alimentos y agua ofrecidos al ganado, que pueden contaminarse fácilmente con las leptospiras que las ratas eliminan intermitentemente con la orina.
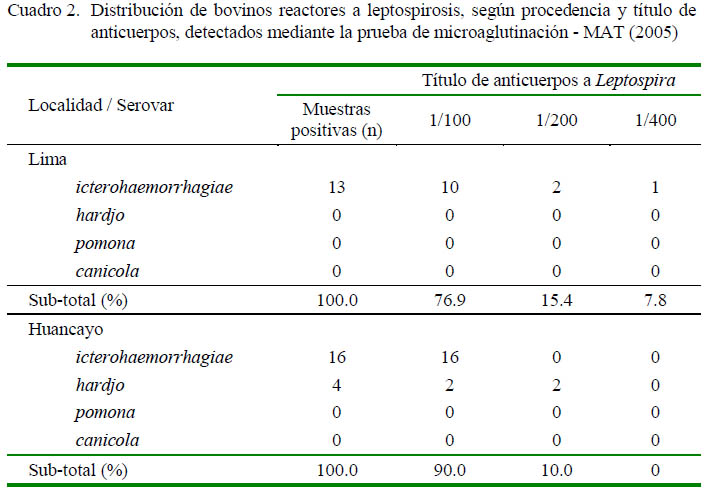
En relación a los títulos de anticuerpos alcanzados en las muestras de Lima y Huancayo, la mayoría de muestras positivas de ambos establos presentaron títulos bajos (1/100), donde solo una muestra en el establo costero alcanzó un título de 1/400 (Cuadro 2).
Los títulos bajos observados en ambas localidades podrían corresponder a infecciones recientes cuyos títulos están en aumento o que están disminuyendo. El hallazgo de un animal con un título de 1/400 al serovar icterohaemorragiae podría sugerir una infección más reciente, pues en la prueba de MAT se logra un máximo de aglutinación a las 2-3 semanas de la infección (Mullan y Panwala, 2016).
Al realizar la prueba del Odds ratio para determinar el riesgo de infección, los datos indican que por cada animal de Huancayo que se infecta 1.2 animales de Lima se infecta. El riesgo de infección animal está asociado a diversos factores ambientales como precipitación pluvial y clima, factores del manejo y sistema de explotación como la crianza conjunta con otras especies productivas como porcinos o por la presencia de animales domésticos (perro) y silvestres (roedores).
En el presente estudio, se podría sugerir que el mayor riesgo de infección hallado en Lima se debería a que las condiciones ambientales de la costa (clima templado) son favorables para la sobrevivencia de la lesptospira; además, la crianza estabulada otorga menos espacio por animal en Lima favoreciendo un mayor contacto entre los animales haciendo más probable la infección (Liceras de Hidalgo et al., 1989; Radostits et al., 2002). Por otro lado, en el establo de la sierra central, los animales solo se concentran durante el ordeño y en las noches, ya que el resto del día se encuentran pastando en terrenos amplios. En el mismo sentido, Arias et al. (2011) sugieren que la seroprevalencia puede ser influenciada por la estación del año, siendo menor durante la época seca.
Debido a la mayor precipitación pluvial que ocurre en Huancayo, se esperaba hallar una mayor prevalencia y riesgo de infección. La explicación a los resultados obtenidos estaría en que, si bien caen más lluvias en la sierra, favoreciendo la supervivencia de Leptospira en el suelo, las lluvias son solo estacionales. Además, existe información que indica que la tasa de aislamiento de esta bacteria se relaciona más con la temperatura que con un elevado nivel de precipitación (Radostits et al., 2002). Así, el clima templado de Lima, con temperatura que difícilmente desciende de 12 ºC durante el invierno, sería más favorable a la sobrevivencia de este patógeno.
CONCLUSIONES
Se halló el 14.8 y 12.3% de prevalencia de Leptospira spp en los establos de la costa y sierra central del Perú mediante la prueba de microaglutinación (MAT).
En total, 33 de los 37 animales positivos correspondieron serovar icterohaemorrhagiae y 4 al serovar hardjo.
LITERATURA CITADA
1. Acha PN, Szyfres B. 2001. Zoonosis y enfermedades transmisibles comunes al hombre y a los animales. Vol 1. Bacteriosis y micosis. 3ª ed. Publicación científica Nº. 580. Washington, USA: OPS-OMS. 420 p. [ Links ]
2. Arias F, Suárez F, Huanca W, Rivera H, Camacho J, Huanca T. 2011. Prevalencia de leptospirosis bovina en dos localidades de Puno en época de seca y determinación de factores de riesgo. Rev Inv Vet Perú 22: 167-170. doi: 10.15381/rivep.v22i2.293 [ Links ]
3. Artiushin S, Timoney J, Nally J, Verma A. 2004. Host-inducible immunogenic sphingomyelinase-like protein, Lk73.5, of Leptospira interrogans. Infect Immun 72: 742-749. doi: 10.1128/IAI.72.2.742-749.2004 [ Links ]
4. Bahari A, Abdollahpour G, SadeghiNasab A, Sattari Tabrizi S, Yavari M, Dadmehr B. 2011. A serological survey on leptospirosis in aborted dairy cattle in industrial farms of Hamedan suburb, Iran. Iranian J Vet Res 12: 337-339. [ Links ]
5. Daniel WW. 2004. Bioestadística. Base para el análisis de las ciencias de la salud. 4ª ed. México: Limusa. 915 p. [ Links ]
6. Escamilla P, Martínez M, Medina M, S. Morales M. 2007. Frequency and causes of infectious abortion in a dairy herd in Queretaro, Mexico. Canadian J Vet Res 71: 314-317. [ Links ]
7. Fang F, Collins-Emerson JM, Cullum A, Heuer C, Wilson PR, Benschop J. 2014. Shedding and seroprevalence of pathogenic Leptospira spp in sheep and cattle at a New Zealand abattoir. Zoonoses Public Health 62: 258-268. doi:10.1111/zph.12146 [ Links ]
8. Godoy S, Mosquera O, Sánchez C. 1997. Prevalencia de leptospirosis por época en bovinos doble propósito en el Municipio Torres, parroquia Las Mercedes, Estado de Lara. Arch Latinoam Prod Anim 5 (Supl 1): 589-561. [ Links ]
10. Gordis L. 2014. Epidemiología. Barcelona, España: Elsevier Saunders. 391 p.
11. Grooms D. 2006. Reproductive losses caused by bovine viral diarrhea virus and leptospirosis. Theriogenology 66: 624628. doi:10.1016/j.theriogenology.2006.04.016
12. Guerra MA. 2013. Leptospirosis: public health perspectives. Biologicals 41: 295-297. doi: 10.1016/j.biologicals. 2013.06.010
13. [INEI] Instituto Nacional de Estadística e Informática. 1994. Censo Nacional Agropecuario 1994. Cuadros estadísticos. [Internet]. Disponible en: http://censos.inei.gob.pe/cenagro/1994/mapas/
14. Liceras de Hidalgo J, Valdivia S, Higuchi E. 1989. Leptospirosis en el Perú. En: Anales Seminario Nacional Zoonosis y Enfermedad de Transmisión Alimentaria. Lima: Ministerio de Salud/OPS/Concytec.
15. León L, García R, Díaz C, Valdez R, Carmona G, Velázquez B. 2008. Prevalence of leptospirosis in dairy cattle from small rural production units in Toluca valley, State of Mexico. Ann NY Acad Sci 1149: 292-295. doi:0.1196/annals.1428.002
16. Martins G, Penna B, Lilenbaum W. 2012. Differences between seroreactivity to leptospirosis in dairy and beef cattle from the same herd in Rio de Janeiro, Brazil. Trop Anim Health Prod 44: 377-378. doi:10.1007/s11250-0119918-x
17. Mullan S, Panwala TH. 2016. Polymerase chain reaction: an important tool for early diagnosis of leptospirosis cases. J Clin Diagn Res 10: DC08-DC11. doi:10.7860/JCDR/2016/22462.9010
18. Nilson G. 2003. Avaliação da infecção por Leptospira em fêmeas bovinas enviadas ao abate no norte de Paraná, a través de diferentesz técnicas diagnósticas. Tesis de Doctorado. Universidade de São Paulo, Brasil. 75 p.
19. Peregrine A, Martin W, Hopwood D, Duffield T, McEwen B, Hobson J, Hietala S. 2006. Neospora caninum and Leptospira serovar serostatus in dairy cattle in Ontario. Can Vet J 47: 467-470.
20. Radostits OM, Gay C, Blood D, Hinchliff K. 2002. Medicina veterinaria. 9a ed. Vol I. Madrid, España: McGraw Hill Interamericana.1206 p.
21. Subharat S, Wilson PR, Heuer C, Collins-Emerson JM. 2012. Longitudinal serological survey and herdlevel risk factors for Leptospira spp serovars hardjo-bovis and pomona on deer farms with sheep and/or beef cattle. N Z Vet J 60: 215-222. doi: 10.1080/00480169.2012.663323
22. [OIE] Oficina Internacional de Epizootias. 2004. Manual de las pruebas de diagnóstico y de las vacunas para los animales terrestres. Vol I. 5ta ed. Francia: Comisión de Estándares Biológicos de la OIE. 634 p.
23. Zuerner R. 2015. Host response to leptospira infection. Curr Top Microbiol Immunol 387: 223-250. doi: 10.1007/9783-662-45059-8_9
Recibido: 12 de abril de 2016
Aceptado para publicación: 14 de abril de 2017