Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Investigaciones Veterinarias del Perú
Print version ISSN 1609-9117
Rev. investig. vet. Perú vol.29 no.1 Lima Jan./Mar. 2018
http://dx.doi.org/10.15381/rivep.v29i1.14084
ARTÍCULOS PRIMARIOS
Prevalencia de mastitis bovina en el Cañón de Anaime, región lechera de Colombia, incluyendo etiología y resistencia antimicrobiana
Prevalence of bovine mastitis in the Anaime Canyon, a Colombian dairy region, including etiology and antimicrobial resistance
María del Pilar Sánchez Bonilla1,3, Norma Patricia Gutiérrez Murillo2, Iván José Posada Almanza1
1 Grupo de Investigación IMPRONTA, Programa de Medicina Veterinaria y Zootecnia,
2 Programa de Ingeniería Civil, Universidad Cooperativa de Colombia, Ibagué, Colombia
3 E-mail: maria.sanchez@campusucc.edu.co
RESUMEN
El objetivo de la investigación fue determinar la prevalencia de mastitis bovina y la resistencia antimicrobiana de los patógenos involucrados en una región lechera de Colombia. Los cuartos mamarios de 348 vacas fueron examinados y evaluados mediante la prueba de California para el diagnóstico de mastitis (CMT). Las muestras positivas a CMT se cultivaron para el aislamiento bacteriológico y susceptibilidad a antibióticos mediante el método de difusión en disco. El análisis de los resultados se realizó mediante estadística descriptiva y relación de prevalencia. Los resultados indican que 158 (45.4%) de las vacas fueron positivas para CMT. Se encontró mastitis clínica en siete vacas (2.0%) y mastitis subclínica en 151 vacas (43.4%). El grupo estafilococo coagulasa-negativo (CNS) fue el principal patógeno encontrado en el 46.7% de los aislamientos, seguido de Staphylococcus aureus (31.1%) y Streptococcus spp (20.7%). Klebsiella pneumoniae y E. coli tuvieron una baja ocurrencia (0.5%). CNS, Staphylococcus aureus y Streptococcus spp presentaron un alto grado de resistencia a penicilina G y a eritromicina, además de multirresistencia.
Palabras clave: mastitis clínica; mastitis subclínica; antibióticos; california mastitis test (CMT); estafilococo coagulasa-negativo (CNS)
ABSTRACT
The aim of this study was to determine the prevalence of bovine mastitis and the antimicrobial resistance of the pathogens involved in a dairy region of Colombia. Mammary quarters of 348 cows were examined and evaluated using the California Mastitis Test (CMT). CMT-positive samples were cultured for bacteriological isolation and susceptibility to antibiotics by the disk diffusion method. Descriptive statistics and prevalence ratio were calculated. The results indicate that 158 (45.4%) of the cows were positive for CMT. Clinical mastitis was found in seven cows (2.0%) and subclinical mastitis in 151 cows (43.4%). The coagulase-negative staphylococcus (CNS) group was the main pathogen found in 46.7% of the isolates, followed by Staphylococcus aureus (31.1%) and Streptococcus spp (20.7%). Klebsiella pneumoniae and E. coli had a low occurrence (0.5%). CNS, Staphylococcus aureus and Streptococcus spp presented a high degree of resistance to penicillin G and erythromycin, in addition to multiresistance.
Keywords: clinical mastitis; subclinical mastitis; antibiotics; california mastitis test (CMT); coagulase-negative staphylococci (CNS)
INTRODUCCIÓN
La producción de leche en Colombia es una de las principales actividades productivas del sector agrario. El acopio pasó de 2756 millones de litros en 2008 a 3218 millones en 2016 (FEDEGAN, 2015), siendo el cuarto productor de leche en América Latina entre 2013 y 2015 (FAO, 2017). Según el Ministerio de Agricultura y Desarrollo Rural de Colombia, 350 000 familias dependían de la producción y venta de leche en 2017 (Ministerio deAgricultura yDesarrolloRural,2017).Las actuales condiciones para el ingreso del país en nuevos mercados internacionales demandan que la industria lechera colombiana requiera ser más competitiva (Ministerio de Agricultura, 2015).
Los factores que influyen en la producción y calidad de la leche son de tipo genético (especie, raza), de manejo (alimentación y ordeño), fisiológicos (fase y número de lactación) y prevalencia de enfermedades (Campos et al., 2016). Dentro de estos últimos, la mastitis bovina es considerada el principal problema del ganado lechero a nivel global (Boldyreva, 2014; Gomes et al., 2016). La mastitis amenaza los ingresos de los agricultores y al sector lácteo debido a problemas de bienestar animal y reducción en la producción y en la calidad de la leche (De Vliegher et al., 2012), costos por tratamientos y sacrificio temprano (Heikkilä et al., 2012).Asimismo, porelriesgoquepuederepresentar para la salud humana, principalmente por el consumo de leche cruda (Murphy et al., 2016).
La clasificación de mastitis clínica o subclínica depende del grado de severidad de sus signos clínicos. La mastitis clínica se caracteriza por anormalidades visibles en la leche o la ubre, mientras que la subclínica es la inflamación de la glándula mamaria, sin generar cambios visibles (NMC, 2016). Esta última causa pérdidas económicas más importantes que la mastitis clínica, debido a la reducción en la producción de la leche que tiende a persistir y afectar mayor número de animales por unidad de producción (Sinha et al., 2014).
Patógenos causantes de mastitis como Staphylococcus (S) aureus, Streptococcus (Str) agalactiae, Str. uberis, Str. dysgalatatiae y los coliformes son conocidos como patógenos mayores por su virulencia y mayor daño al tejido mamario, a diferencia de patógenos causantes de infecciones leves o de tipo subclínico como Corynebacterium bovis y estafilococos coagulasa negativos (CNS, por sus siglas en inglés), llamados patógenos menores (CBMQRN, 2015).
El grupo CNS es considerado un patógeno emergente en mastitis a nivel mundial (Pyörälä y Taponen, 2009; El-Jakee et al., 2013; Björk et al., 2014; Hosseinzadeh y Dastmalchi, 2014). El Consejo Nacional de Mastitis (NMC, por sus siglas en inglés) los clasifica para su diagnóstico y tratamiento como CNS novobiocina-sensibles (v.g. Staphylococcus epidermidis) y CNS novobiocina-resistentes (v.g. Staphylococcus sciuri), donde estos últimos presentan curaciones espontáneas (NMC, 2004).
La terapia antimicrobiana es la principal herramienta para el control de la mastitis durante la lactancia y en las vacas secas; sin embargo, algunas cepas vienen demostrado resistencia completa o parcial a diferentes antimicrobianos ante el uso inadecuado de los antibióticos (Condron, 2013; OIE, 2015; OMS, 2016). Por otra parte, las bacterias resistentes presentes en alimentos de origen animal pueden ser transmitidas a los humanos a través de la cadena alimentaria, como es el caso de S. aureus resistente a meticilina (MRSA) (Santiago-Neto et al., 2014), además de la presencia nociva de residuos de antibióticos en la leche (De Vliegher et al. 2012; Salas et al., 2013; Dangnaw, 2015).
Esto pone de relieve la vigilancia de la resistencia de las bacterias a los antimicrobianos (RAM) en la medicina humana y animal, así como en la salud pública (Saini et al., 2012). Por estas razones, el objetivo del estudio fue determinar la prevalencia de mastitis bovina enAnaime Tolima, una región ganadera del centro de Colombia, así como establecer su etiología y comportamiento frente a antibióticos.
MATERIALES Y MÉTODOS
Localización y Muestras
La investigación se realizó durante 2014 en la región deAnaime, localizada en la «despensa agrícola de Colombia», como se le conoce al municipio de Cajamarca, departamento del Tolima (Colombia). La zona se encuentra a 1814 msnm, coordenadas 4° 262 273 N, 75° 252 403 W, entre los ríosAnaime y Bermellón (Cañón deAnaime), con un clima templado y una temperatura media de 19 ºC (Alcaldía de Cajamarca, 2017).
Las muestras fueron tomadas de vacas de 12 veredas asociadas a la Federación de Ganaderos del Tolima, la mayoría de raza Normando, tanto primíparas como multíparas en diferentes periodos de lactación, y con una producción diaria aproximada de seis litros de leche.
Las fincas son de doble propósito, la alimentación está basada en pastos naturales y el ordeño es manual.Al momento del estudio no contaban con registro de historial clínico de mastitis y la mayoría de los casos de mastitis eran tratados con oxitetraciclina. Se incluyeron en el estudio todas las vacas sin diferenciar el estado de lactación y para la caracterización etiológica solo se utilizaron las muestras de vacas positivas a la prueba California Mastitis (CMT, por sus siglas en inglés) con o sin signos clínicos.
Aspectos Éticos
Se contó con el consentimiento informado de los dueños de las fincas. Las muestras fueron recolectadas durante el ordeño de la mañana sin que se practicaran procedimientos experimentales; por lo que no se solicitó el aval de un comité de ética. La toma y envío de las muestras y las técnicas de laboratorio se realizaron siguiendo los parámetros establecidos por el Consejo Nacional de Mastitis (NMC, 2004).
Diagnóstico de Mastitis
-Mastitis clínica: Cualquier alteración que indicara inflamación de uno o varios cuartos o de toda la glándula, como aumento de temperatura en el área afectada, enrojecimiento de la zona y dolor; o cualquier signo de alteración en la leche (color, grumos, coágulos sanguinolentos o con pus, leche acuosa).
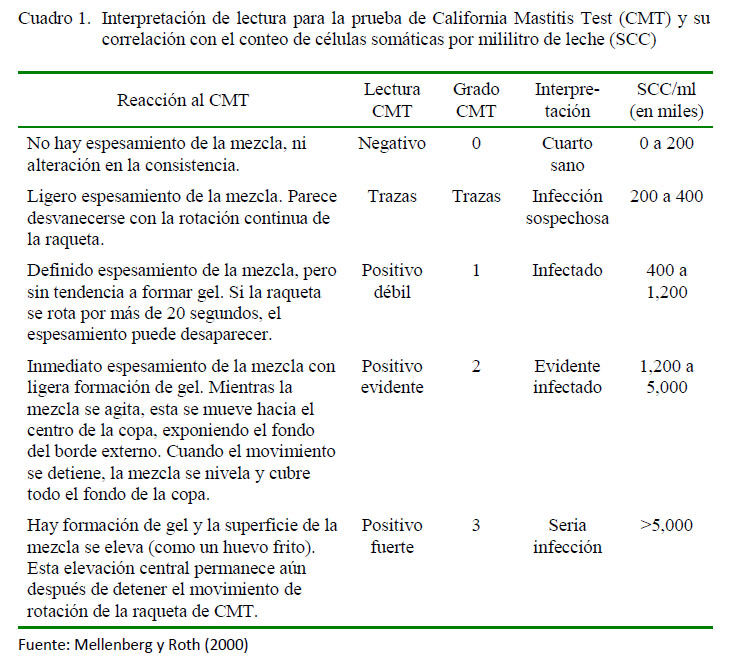
-Mastitis subclínica: Leche proveniente de cuartos en producción sin signos clínicos ni cambios en la leche que resulten positivos a CMT; siguiendo la metodología propuesta por Mellenberger y Roth (2000) y adaptada según lineamientos del NMC que indica que es una prueba cualitativa del conteo de células somáticas que se han desprendido por el proceso inflamatorio. En la lectura del CMT no se tuvo en cuenta el grado trazas como positivo (Cuadro 1).
Agentes Etiológicos y Susceptibilidad Antibacteriana
Muestras de leche de los cuartos que presentaron grado 1 o más al CMT fueron colectadas (20 ml) y transportadas en refrigeración dentro de las 24 h (NMC, 2004) al Laboratorio de Diagnóstico del Programa de Medicina Veterinaria y Zootecnia de la Universidad Cooperativa de Colombia, sede Ibagué, donde fueron cultivadas en el menor tiempo para aislamiento bacteriano.
El cultivo microbiológico se hizomediante la técnica de siembra por superficie con asa calibrada (0.01 ml) en agar sangre y agar MacConkey entre 24 y 48 h a 37 °C en condiciones aeróbicas. Las colonias resultantes fueron teñidas con Gram para la evaluación morfológica. Las colonias gram negativas tipo Enterobacteria fueron sometidas a identificación, mientras que la prueba de la catalasa se utilizó en los cocos gram positivos para diferenciar Streptococcus de Staphylococcus. La prueba de coagulasa en tubo fue usada para diferenciar estafilococos coagulasa positiva (CPS, por sus siglas en inglés) de los coagulasa negativos (CNS). Los CPS se asociaron a S. aureus, en tanto que los CNS con característica de crecimiento en gota de rocío en el agar sangre fueron identificados como Streptococcus spp.
Se hicieron pruebas de susceptibilidad para determinar la sensibilidad y resistencia de las bacterias ante antibióticos mediante la prueba de difusión en disco en agar Müller-Hinton (CLSI, 2007). Los antibióticos utilizados fueron eritromicina (15 µg), penicilina G (10 U), tetraciclina (30 µg), sulbactamcefoperazona (SCF) (105 µg) y trimetoprimsulfametoxazol (SXT) (25 µg). Además, se utilizó novobiocina (5 ìg) para clasificar a los CNS como novobiocina-sensibles o novobiocina-resistentes.
Análisis Estadístico
Se realizó un estudio de corte transversal descriptivo. La población estuvo constituida por 3707 vacas Normando en etapa de producción, registradas en la Federación Colombiana de Ganaderos (FEDEGAN). El tamaño de la muestra fue de 348 vacas (confianza del 95% y un error del 5%), que fueron seleccionadas mediante muestreo probabilístico estratificado en las 12 veredas de la región de Anaime. Se determinó la prevalencia por vaca [(N° de vacas positivas / N° de vacas muestreadas)*100] y por cuartos [(N° de cuartos positivos / N° de cuartos muestreados)*100]
RESULTADOS
De las 348 vacas de las 12 veredas en estudio, 158 presentaron mastitis, siendo de tipo clínica en siete de ellas con 10 cuartos afectados, todas de ellas procedentes de la misma finca. En las 151 vacas que fueron solo positivas al CMT, 236 cuartos reaccionaron al CMT. La prevalencia de mastitis en la región de Anaime se muestra en el Cuadro 2.
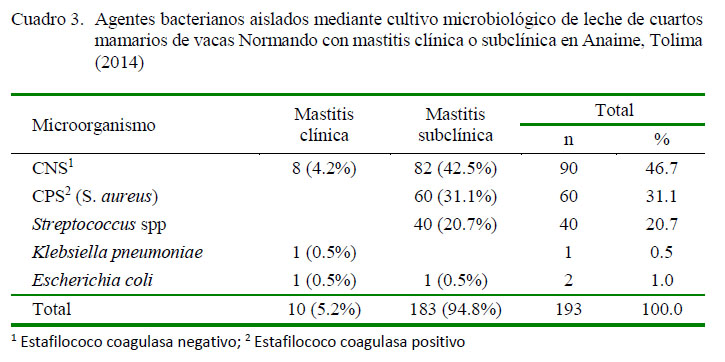
El resultado del cultivo microbiológico de las muestras de los cuatros mamarios con mastitis clínica o subclínica indicaron que en 193 (81.8%) se aislaron microorganismos causantes de mastitis (uno por cuarto), mientras que en 31 (13.1%) de ellas no hubo crecimiento y 12 muestras se perdieron por diferentes causas antes de su total procesamiento. Las bacterias aisladas fueron CNS, S. aureus y Streptococcus spp (46.7, 31.1 y 20.7%, respectivamente). Klebsiella pneumoniae y Escherichia coli se aislaron en menor proporción (Cuadro 3).
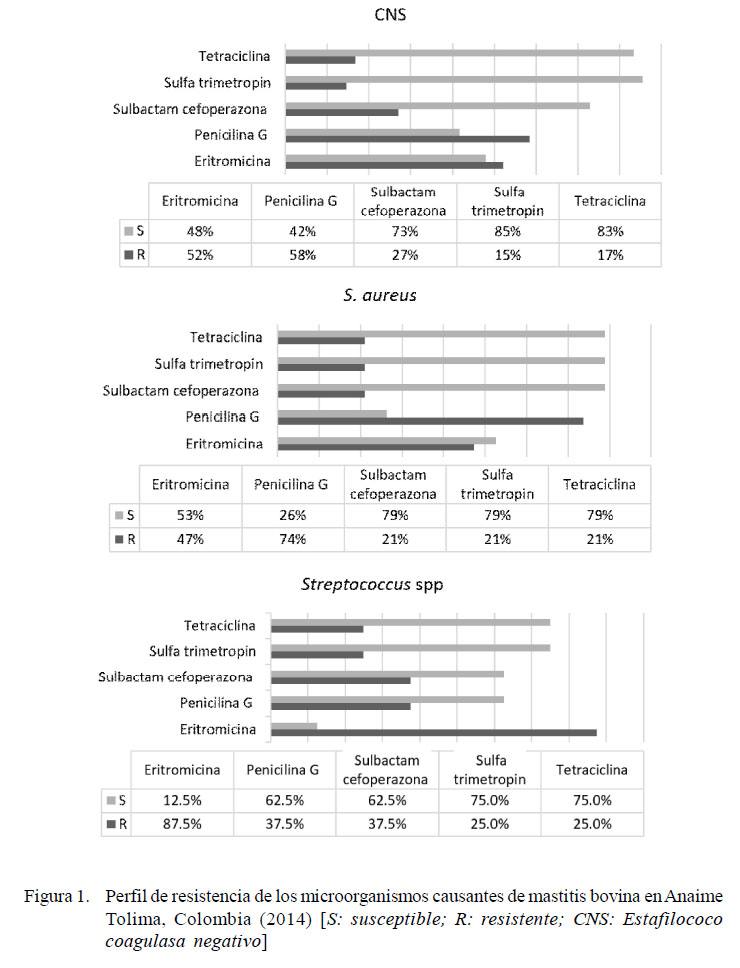
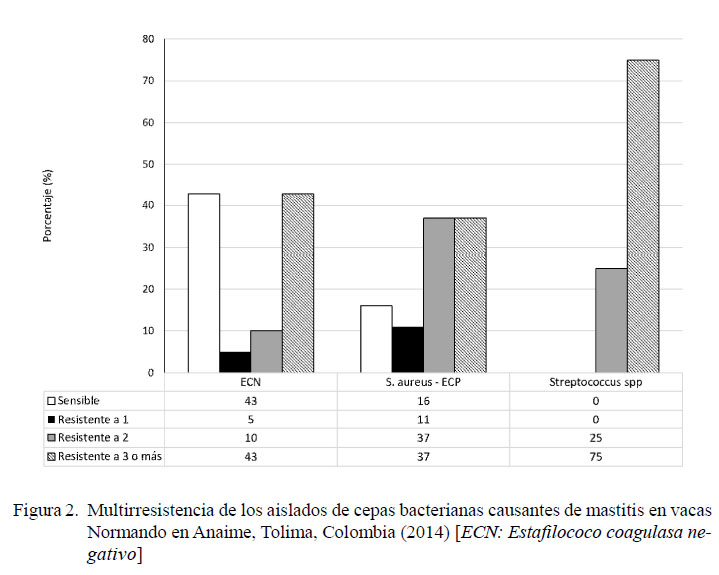
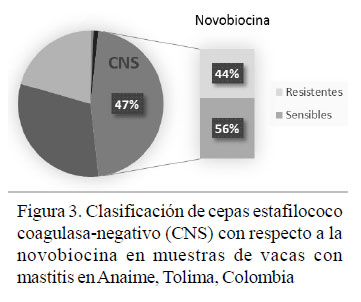
El 58 y 52% de las cepas positivas a CNS presentó resistencia a la penicilina y eritromicina, respectivamente. Estas cepas tuvieron alta sensibilidad al trimetropimsulfametoxazole (95%) y a la tetraciclina (90%) (Figura 1), mientras que 14% de las cepas presentaron multirresistencia (Figura 2). En la Figura 3 se observa su clasificación con respecto a la novobiocina.
El 74 de las cepas positivas a S. aureus mostró resistencia a la penicilina y el 79% presentó sensibilidad a tetraciclina, sulbactam/ cefoperazona y trimetropim sulfamexotazole (Figura 1), en tanto que 21% de ellas presentó resistencia a tres o más antibióticos (Figura 2).
El 88% de las cepas positivas a Streptococcus spp mostró alta resistencia a la eritromicina, y el 75% presentó sensibilidad a tetraciclina y trimetropim sulfametoxazole (Figura 1). El 75% de los aislados fueron multirresistentes (Figura 2).
DISCUSIÓN
El 43.4% de prevalencia de mastitis subclínica en este estudio fue similar al 42.4% encontrado en el oriente antioqueño colombiano (Trujillo et al., 2011), pero ligeramente superior al 39.5% reportado en el altiplano norte deAntioquia (Ramírez et al., 2014). Por otro lado, Andrade et al. (2104) reportan una prevalencia de 3.3% en el altiplano boyacense en vacas con ordeño mecánico. En relación con otros países de Sudamérica, Ruiz et al. (2011) señala una prevalencia de 39.9% bajo condiciones de ordeño manual en Pernambuco, Brasil, y Gómez-Quispe et al. (2015) reportan una prevalencia de 65.6% en Abancay, Perú, en este caso sin tener en cuenta el grado trazas en la prueba de CMT, al igual que en este estudio.
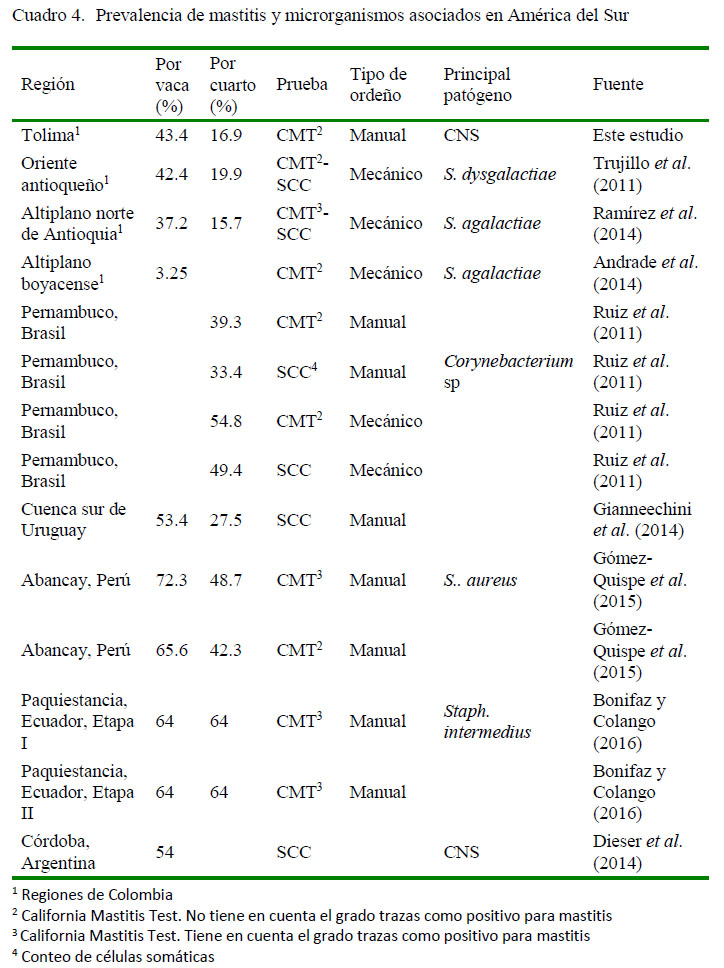
La mastitis subclínica a nivel del cuarto, sin considerar al grado trazas como positivo, mostró una prevalencia de 16.9%, dato similar a otras regiones de Colombia (11.3% en Montería, Córdoba [Calderón et al., 2011],16.5% en el altiplano norte deAntioquia [Ramírez et al., 2014] y 19.9% en el oriente antioqueño [Trujillo et al., 2011]). Cercano a este rango se observan resultados en América Latina, como en el caso de México en un área conformada por cuatro regiones donde se obtuvo una prevalencia del 20.5% (Olivares-Pérez et al., 2015), mientras que se registró 27.5% en la cuenca lechera del sur de Uruguay (Gianneechini et al., 2014) mediante conteo de células somáticas, de 39.3% en Pernambuco, Brasil (Ruiz et al., 2011) y de 43.3% enAbancay, Perú (Gómez-Quispe et al., 2015). Datos comparativos sobre la prevalencia y principal microorganismo aislado de mastitis bovina subclínica en países de Suramérica se presentan en el Cuadro 4.
En el presente estudio, 2% de las vacas presentaron mastitis clínica; resultado que se encuentra dentro de los rangos en otras regiones de Colombia (1.7% en el altiplano norte de Antioquia [Ramírez et al., 2011] y 3.8% en el orienteAntioqueño [Trujillo et al., 2011]), pero menores que el 6.4% en Rondón de Pará, Brasil (Oliveira et al.,2011)yel 3%en Etiopía (Belayneh et al., 2014). Por otro lado, la prevalencia de afección clínica a nivel del cuarto fue de 0.72%, ligeramente inferior al 1.1% encontrada en Montería, Colombia (Calderón et al., 2011) y al 1.3% en lo reportado en Rondón de Pará, Brasil (Oliveira et al., 2011).
Existen estudios que demuestran que los cuartos anteriores son más propensos a presentar una mayor frecuencia de reacciones positivas, especialmente el anterior derecho (Lancelot et al., 1997); no obstante, en este estudio no se observaron diferencias significativas entre la afección de los cuartos, similar a los resultados de Gómez-Quispe et al. (2015).
Bacterias CNS, consideradas tradicionalmente como flora normal de la piel de la vaca, fueron aisladas con mayor frecuencia en muestras, tanto de mastitis clínica (80%, 8/10) como subclínica (44.8%, 82/183). Este estudio coincide con la afirmación de varios autores sobre la emergencia de CNS como patógeno causante de mastitis (Pyörälä y Taponen, 2009; El-Jakee et al., 2013; Björk et al., 2014; Hosseinzadeh y Dastmalchi, 2014).Aunque enColombianose habíanreportado estudios donde CNS fuera el principal causante de mastitis, varias investigaciones muestran que fue el segundo patógeno aislado de cuartos con mastitis subclínica (Calderón y Rodríguez, 2008; Ramírez et al., 2011; Trujillo et al., 2011), utilizando CMT como herramienta diagnóstica y, en algunos casos, además, SCC (Ramírez et al., 2011; Trujillo et al., 2011). Por otro lado, CNS fue el principal causante de mastitis bovina (clínica y subclínica) en Guanajato, México (León-Galván et al., 2015) y en la región de Rondón de Pará, Brasil (Oliveira et al., 2011). La literatura actual contiene varios estudios detallando análisis con resultados contradictorios sobre si infecciones intramamarias (IMI) con patógenos menores como los CNS presentan un riesgo de adquirir una nueva IMI por patógenos mayores (Reyher, 2012).
CNS mostró resistencia a la penicilina y a la eritromicina en más de la mitad de sus aislados, a diferencia de los resultados de Gianneechini et al. (2014) y Moser et al., (2013), donde el 33.3 y 39% de las bacterias mostraron resistencia a la penicilina y solo el 3.9 y 5%, respectivamente, presentó resistencia a la eritromicina. En este estudio, el porcentaje de resistencia (53%) de CNS a dos o más antibióticos fue mayor que el 30.6% presentado por CNS en Córdoba, Argentina (Raspanti et al., 2016). Por otro lado, la clasificación con respecto a la novobiocina fue cerca de 50% para cada grupo, diferente a 81% para los novobiocina-sensibles y 19% para los novobiocina-resistentes encontrado por Thorberg et al. (2009).
S. aureus es considerado uno de los principales patógenos de distribución mundial, causantes de mastitis, principalmente de tipo clínico, ya que una vez establecido en la glándula mamaria es difícil de erradicar (De Vliegher et al., 2012). En el presente estudio fue el segundo patógeno aislado (31.1%), frecuencia menor al 87.6% encontrada en Montería, Colombia por Calderón et al. (2011), pero mayor al 8% reportado en el altiplano norte de Antioquia por Ramírez et al. (2014). Fue aislado también como segundo patógeno causante de mastitis en fincas lecheras de Córdoba, Argentina (Dieser et al., 2014) y de Paquiestancia, Ecuador (Bonifaz y Colango, 2016).
La resistencia que presentó S. aureus a la penicilina (74%) y a la eritromicina (47%) fue más alta en otros estudios (Pellegrino et al., 2011; Valero et al., 2010; Gianneechini et al., 2014), pero coincidió en la alta sensibilidad al trimetropim sulfa y a la tetraciclina con el estudio de Gianneechini et al. (2014).Asimismo, el 37% de cepas de S. aureus multirresistentes a tres o más antibióticos fue mucho más elevado que el 19% de cepas reportadas por Pellegrino et al. (2011) en Argentina, aunque en ese estudio no solo se estudió leche procedente de casos con mastitis.
La frecuencia de 21.9% de Streptococcus spp en muestras de mastitis subclínica fue similar al 19.5% reportado por Giannenchi et al. (2014) en Uruguay, pero mayor al 14.6% mencionado por Ruiz et al. (2011) en Brasil y el 8.8% de Dieser et al. (2014) en Argentina. Asimismo, se halló una alta resistencia de esta bacteria a la eritromicina (88%), mientras que en el estudio de Giannenchi et al. (2014) fue solo del 2.9%. Todas las muestras positivas a Streptococcus spp presentaron resistencia a dos o más antibióticos, a diferencia de lo encontrado por Ruiz et al. (2011), quienes hallaron multirresistencia en el 11.1% de las muestras.
CONCLUSIONES
-
Se presenta una alta frecuencia de mastitis de tipo subclínico causada por cepas estafilococo coagulasa-negativo (CNS).
-
Se presentó una alta resistencia de los principales microorganismos aislados (CNS, Staphylococcus aureus y Streptococcus spp) a la penicilina y a la eritromicina. Además, los tres grupos bacterianos mostraron multirresistencia, especialmente Streptococcus spp.
Agradecimientos
A la Universidad Cooperativa de Colombia, por su apoyo financiero a través del Comité Nacional de Investigación (CONADI); a la Federación de Ganaderos del Tolima, especialmente al Dr. Gustavo Barragán y a la funcionaria Claudia Marcela Torres; a Yolanda Vergara, Luisa Prieto, Nelson Quintero y Daniel Camargo, médicos veterinarios, quienes participaron en la ejecución de este proyecto, y a las personas en las fincas quienes hicieron posible la realización de este trabajo.
LITERATURA CITADA
1. Alcaldía de Cajamarca. 2017. Nuestro Municipio. [Internet]. Disponible en: http://www.cajamarca-tolima.gov.co/ informacion_general.shtml [ Links ]
2. Andrade R, Caro Z, Dallos A. 2014. Prevalencia de mastitis subclínica bovina y su etiología infecciosa en fincas lecheras del altiplano boyacense (colombia). Rev Cient FCV-LUZ 24: 305-310. [ Links ]
3. Belayneh R, Belihu K, Tesfaye A. 2014. Microbiological study on bacterial causes of bovine mastitis and its antibiotics susceptibility patterns in East Showa Zone, Akaki District, Ethiopia. J Vet Med Anim Health 6: 116-122. doi: 10.5897/JVMAH2013.027 [ Links ]
4. Björk S, Båge R, Kanyima B, André S, Nassuna-Musoke M, Owiny D, Persson Y. 2014. Characterization of coagulase negative staphylococci from cases of subclinical mastitis in dairy cattle in Kampala, Uganda. Ir Vet J 67:12. doi: 10.1186/2046-0481-67-12 [ Links ]
5. Boldyreva EM. 2014. Current challenges in global dairy farming: cattle diseases. J Dairy Vet Anim Res 1(2): 00008. [ Links ]
6. Bonifaz N, Conlago F. 2016. Prevalencia e incidencia de mastitis bovina mediante la prueba de California Mastitis Test con identificación del agente etiológico, en Paquiestancia, Ecuador. La Granja: Revista de Ciencias de la Vida 24(2): 43-52. doi: 10.17163/ lgr.n24.2016.04 [ Links ]
7. Calderón A, Rodríguez V, Arrieta B, Germán J, Máttar S. 2011. Prevalencia de mastitis bovina en sistemas doble propósito en Montería (Colombia): etiología y susceptibilidad antibacteriana. Rev Colomb Cienc Pec 24: 19-28. [ Links ]
8. Calderón A, Rodríguez V. 2008. Prevalencia de mastitis bovina y su etiologia infecciosa en sistemas especializados en producción de leche en el altiplano cundiboyacense (Colombia). Rev Colomb Cienc Pec 21: 582-589. [ Links ]
9. Campos P, Rangel DN, Borba L, Urbano S, Novaes L, Galvão J, Sales D, De Aguiar E. 2016. Quality indicators of tank milk in different production systems of tropical regions. Cienc Agrarias 37: 2819-2830. [ Links ]
10. [CBMQRN] Canadian Bovine Mastitis and Milk Quality Research Network. 2015. Universidad de Montreal. [Internet]. Available in: http:// w w w . m e d v e t . u m o n t r e a l . c a / r e s e a u _ m a m m i t e / e n / p a g e . p h p ? p=23&tm=h&niv=2 [ Links ]
11. [CLSI] Clinical and Laboratory Standards Institute. 2007. Performance standards for antimicrobial susceptibility testing. Document M100-S18. 8th ed. Wayne, PA, USA: CLSI. [ Links ]
12. Condron R. 2013. Dairy sector initiatives. In: OIE Global Conference on the Responsible and Prudent Use of Antimicrobial Agents for Animals. Paris, France: OIE. [ Links ]
13. Dangnaw G. 2015. Public health significance of bovine mastitis. World J Biol Med Sci 2(4): 20-31. [ Links ]
14. De Vliegher S, Fox L, Piepers S, McDougall S, Barkema HW. 2012. Invited review: mastitis in dairy heifers: nature of the disease, potential impact, prevention, and control. J Dairy Sci 95: 1025-1040. doi: 10.3168/jds.2010-4074 [ Links ]
15. Dieser SA, C Vissio, MC Lasagno, CI Bogni, AJ Larriestra, LM Odierno. 2014. Prevalence of pathogens causing subclinical mastitis in Argentinean dairy herds. Pak Vet J 34: 124-126. [ Links ]
16. El-Jakee JK, Aref NE, Gomaa AM, El-Hariri MD, Galal HM, Omar SA, Samir A. 2013. Emerging of coagulase negative staphylococci as a cause of mastitis in dairy animals: an environmental hazard. Int J Vet Sci Med 1(2):74-78. doi: 10.1016/j.ijvsm.2013.-05.006 [ Links ]
17. [FAO] Organización de las Naciones Unidas para la Alimentación y la Agricultura. 2017. OECD-FAO Agricultural Outlook 2016-2025. [Internet]. Available in: http://www.oecdilibrary. org/agricul-ture-and-food/oecdfao- agricultural-outlook-2016-2025/ dairy-and-dairy-products_agr_outlook- 2016-11-en [ Links ]
18. [FEDEGAN] Federación Colombiana de Ganaderos. 2015. Estadísticas producción. [Internet]. Disponible en: http://www.fedegan.org.co/ [ Links ]
19. Gianneechini R, Concha C, Delucci I, Gil J, Salvarrey L, Rivero R. 2014. Mastitis bovina, reconocimiento de los patógenos y su resistencia antimicrobiana en la Cuenca Lechera del Sur de Uruguay. Vet Montevideo 50: 4-32. [ Links ]
20. Gomes F, Saavedra M, Henriques M, Coenye T. 2016. Bovine mastitis disease/pathogenicity: evidence of the potential role of microbial biofilms. Pathog Dis 74 (3): ftw006. doi: 10.1093/ femspd/ftw006 [ Links ]
21. Gómez-Quispe O, Santivañez C, Arauco F, Espezua O, Manrique J. 2015. Criterios de interpretación para California Mastitis Test en el diagnóstico de mastitis subclínica en bovinos. Rev Inv Vet Perú 26: 86-95. doi: 10.15381/ rivep.v26i1.10912 [ Links ]
22. Heikkilä A, Nousiainen JI, Pyörälä S. 2012. Costs of clinical mastitis with special reference to premature culling. J Dairy Sci 95: 139-50. doi: 10.3168/ jds.2011-4321 [ Links ]
23. Hosseinzadeh S, Dastmalchi SH. 2014. Staphylococcal species associated with bovine mastitis in the North West of Iran: emerging of coagulase-negative staphylococci. Int J Vet Sci Med 2(1): 27-34. doi: 10.1016/j.ijvsm.2014.02.001 [ Links ]
24. Lancelot R, Faye B, Lescourret F. 1997. Factors affecting the distribution of clinical mastitis among udder quarters in French dairy cow. Vet Res J 28: 45-53. [ Links ]
25. León-Galván MF, Barboza-Corona, Lechuga-Arana A, Valencia-Posadas M, Aguayo DD, Cedillo-Pelaez C, Martínez-Ortega EA, et al. 2015. Molecular detection and sensitivity to antibiotics and bacteriocins of pathogens isolated from bovine mastitis in family dairy herds of central Mexico. Biomed Res Int 615153. doi: 10.1155/2015/ 615153 [ Links ]
26. Mellenberg R, Roth C. 2000. Hoja de información de la prueba de mastitis California (CMT). Michigan State University. [Internet]. Disponible en: http://milkquality.wisc.edu/wp-content/ uploads/2011/09/hoja-de-informacion-dela- pruebe-de-mastit is-calif orni a_ spanish.pdf [ Links ]
27. Murphy SC, Martin NH, Barbano DM, Wiedmann M. 2016. Influence of raw milk quality on processed dairy products: how do raw milk quality test results relate to product quality and yield? J Dairy Sci 99: 10128-10149. doi: 10.3168/jds.2016-11172 [ Links ]
28. Ministerio de Agricultura y Desarrollo Rural. 2015. Implementación política para mejorar la competitividad del sector lácteo nacional. Colombia. [Internet]. Disponible en: https://www.minagricultura. gov.co/ministerio/direcciones/ D oc ume n t s/ d . a n gi e / p r ogr ama% - 20de%20avance%20presupuestal%- 202015.pdf [ Links ]
29. Ministerio de Agricultura y Desarrollo Rural. 2017. Sistema de información de gestión y desempeño de organizaciones de cadena. [Internet]. Disponible en: https://sioc.minagricultura.- gov.co/Pages/SIOC.aspx [ Links ]
30. Moser A, Stephan R, Ziegler D, Johler S. 2013. Species distribution and resistance profiles of coagulase-negative staphylococci isolated from bovine mastitis in Switzerland. Schweiz Arch Tierheilkd 155: 333-338. doi: 10.1024/ 0036-7281/a000468 [ Links ]
31. [NMC] National Mastitis Council. 2004. Procedures for collecting milk samples. [Internet]. Available in: http:// www.nmco nl i ne .org/ wp-c ont e nt / uploads/ 2016/09/Proce dures-for- Collecting-Milk-Samples.pdf [ Links ]
32. [NMC] National Mastitis Council. 2016. Glossary of terms [Internet]. Available in: http://www.nmconline.org/ wp-content/uploads/2016/08/Glossaryof- Terms.pdf [ Links ]
33. [OIE] Organización Mundial de Sanidad Animal. 2015. Resistencia a los antimicrobianos. [Internet]. Disponible en: http://www.oie.int/fileadmin/Home/ e s p / M e d i a _ C e n t e r / d o c s / p d f / Fact_sheets/ANTIBIO_ES.pdf [ Links ]
34. Olivares-Pérez J, Kholif AE, Rojas- Hernández S, Elghandour M, Salem A, Bastida A, Velázquez-Reynoso D, et al. 2015. Prevalence of bovine subclinical mastitis, its etiology and diagnosis of antibiotic resistance of dairy farms in four municipalities of a tropical region of Mexico. Trop Anim Health Prod 47: 1497-1504. doi: 10.1007/s11250- 015-0890-8 [ Links ]
35. Oliveira CM, Sousa M, Silva N, Mendonça C, Silveira J, Oaigen R, Andrade S, Barbosa J. 2011. Prevalência e etiologia da mastite bovina na bacia leiteira de Rondon do Pará, estado do Pará. Pesq Vet Bras 31: 104- 110. doi: 10.1590/S0100-736X2011000- 200002 [ Links ]
36. [OMS] Organización Mundial de la Salud. 2016. Resistencia a los antimicrobianos. Centro de prensa. Nota descriptiva. [Internet]. Disponible en: http:// www.who.int/mediacentre/factsheets/ fs194/es/ [ Links ]
37. Pellegrino MS, Frola ID, Odierno LM, Bognia CI. 2011. Mastitis bovina: resistencia a antibióticos de cepas de Staphylococcus aureus aisladas de leche. REDVET 12(7). [Internet]. Disponible en: http://www.veterinaria.org/revistas/ redvet/n070711/071110.pdf [ Links ]
38. Pyörälä S, Taponen S. 2009. Coagulase- negative staphylococci-emerging mastitis pathogens. Vet Microbiol 34: 3- 8. doi: 10.1016/j.vetmic.2008.09.015 [ Links ]
39. Ramírez N, Arroyave O, Cerón M, Jaramillo M, Cerón J, Palacio, LG. 2011. Factores asociados a mastitis en vacas de la microcuenca lechera del altiplano norte de Antioquia, Colombia. Rev Med Vet 22: 31-42. doi: 10.19052/ mv.562 [ Links ]
40. Ramírez N, Keefe G, Dohoo I, Sánchez J, Arroyave O, Cerón J, Jaramillo M, Palacio LG. 2014. Herd- and cow-level risk factors associated with subclinical mastitis in dairy farms from the High Plains of the northern Antioquia, Colombia. J Dairy Sci 97: 4141-4150. doi: 10.3168/jds.2013-6815 [ Links ]
41. Raspanti C, Bonetto C, Vissio C, Pellegrino M, Reinoso E, Dieser S, Bogni C, Larriestra A, Odierno L. 2016. Prevalence and antibiotic susceptibility of coagulase-negative Staphylococcus species from bovine subclinical mastitis in dairy herds in the central region of Argentina. Rev Argent Microbiol 48: 50-56. doi: 10.1016/ j.ram.2015.12.001 [ Links ]
42. Reyher K, Haine HR, Dohoo I, Revie CW. 2012. Examining the effect of intramammary infections with minor mastitis pathogens on the acquisition of new intramammary infections with major mastitis pathogens- a systematic review and meta-analysis. J Dairy Sci 95: 6483- 6502. doi: 10.3168/jds.2012-5594 [ Links ]
43. Ruiz AK, Ponce P, Gomes G, Mota RA, Sampaio E, Lucena ER, Benone S. 2011. Prevalencia de mastitis bovina subclínica y microorganismos asociados: comparación entre ordeño manual y mecánico, en Pernambuco, Brasil. Rev Salud Anim 33: 57-64. [ Links ]
44. Saini V, McClure JT, Léger D, Keefe GP, Scholl DT, Morck DW, Barkema HW. 2012 Antimicrobial resistance profiles of common mastitis pathogens on Canadian dairy farms. J Dairy Sci 95: 4319-4332. doi: 10.3168/jds.2012-5373 [ Links ]
45. Salas P, Calle S, Falcón N, Pinto C, Espinoza J. 2013. Determinación de residuos de antibióticos betalactámicos mediante un ensayo inmunoenzimático en leche de vacas tratadas contra mastitis. Rev Inv Vet Perú 24: 252-254. doi: 10.15381/rivep.v24i2.2519 [ Links ]
46. Santiago-Neto W, Machado G, Paim D, Campos T, Cardoso M, Marisa RI, Corbellini L. 2014. Relação da idade na presença de bactérias resistentes a antimicrobianos em rebanhos leiteiros no Rio Grande do Sul. Pesq Vet Bras 34: 613-620. [ Links ]
47. Sinha MK, Thombare NN, Mondal B. 2014. Subclinical mastitis in dairy animals: incidence, economics, and predisposing factors. Scientific World J ID 523984. doi: 10.1155/2014/523984 [ Links ]
48. Thorberg B, Danielsson ML, Emanuelson U, Persson K. 2009. Bovine subclinical mastitis caused by different types of coagulase-negative staphylococci. J Dairy Sci 92: 4962-4970. doi: 10.3168/jds.2009-2184 [ Links ]
49. Trujillo CM, Gallego AF, Ramírez N, Palacio LG. 2011. Prevalencia de mastitis en siete hatos lecheros del oriente antioqueño. Rev Colomb Cienc Pecu 24: 11-18. [ Links ]
50. Valero-LK, Olivares Y, Perozo A, Valbuena E, Boscán L, Colina G, Briñez W. 2010. Susceptibilidad a los agentes antimicrobianos en cepas de Staphylococcus aureus aisladas en leche de bovinos con mastitis subclínica y leche de tanque. Rev Científica FCVLuz 20: 367-376. [ Links ]
Recibido: 20 de abril de 2017
Aceptado para publicación: 15 de agosto de 2017