Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.29 no.1 Lima ene./mar. 2018
http://dx.doi.org/10.15381/rivep.v29i1.14161
ARTÍCULOS PRIMARIOS
Helmintos en Pelecanus thagus y Spheniscus humboldti de la costa de Lima, Perú
Helminths in Pelecanus thagus and spheniscus humboldti of the coast of Lima, Peru
José Angulo-Tisoc1,5, Marco Quispe Huacho2, Manuel Tantaleán Vidaurre3, Jonatan Mikhail Del Solar Velarde4
1 Centro de Investigaciones IVITA, sede Maranganí, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Cusco, Perú
2 Laboratorio de Análisis Clínicos, Veterinaria Bandy Pet´s, Lima, Perú
3 Laboratorio de Parasitología en Fauna Silvestre y Zoonosis, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos, Lima, Perú
4 Programa de Pós-graduação em Zootecnia, Universidade Federal da Bahia, Brasil
5 E-mail: jangulot@unmsm.edu.pe
RESUMEN
En junio de 2012, a raíz de un fenómeno marino que produjo mortandad de aves de varias especies marinas, se estudiaron los endoparásitos en dos pelícanos (Pelecanus thagus) y dos pingüinos (Spheniscus humboldti) hallados muertos en la playa del distrito de Chorrillos, Lima-Perú. Se realizó la obtención de helmintos del tracto digestivo en ambas especies aplicando el método de Travassos. Fueron identificados en Pelecanus thagus los nematodos Contracaecum rudolphii y Syngamus trachea, el cestodo Tetrabothrius sp, el trematodo Galactosomum puffini y el acantocéfalo Corynosoma sp. En Spheniscus humboldti, el trematodo Cardiocephaloides physalis y los nematodos Contracaecum pelagicum y Cyathostoma phenisci. Syngamus trachea, Galactosomum puffini, Corynosoma sp y Contracaecum pelagicum son considerados nuevos reportes en Pelecanus thagus en el Perú. Además, Spheniscus humboldti puede ser considerado nuevo hospedero de Cardiocephaloides physalis y Cyathostoma phenisci.
Palabras clave: helmintos; Pelecanus thagus; Spheniscus humboldti; Perú
ABSTRACT
In June 2012, as a result of a marine phenomenon that resulted in the death of birds of several species of seabirds, endoparasites were studied in two pelicans (Pelecanus thagus) and two penguins (Spheniscus humboldti) found dead on the beach in the district of Chorrillos, Lima (Peru). The helminths were obtained from the digestive tract in both species using the Travassos protocols. The nematodes Contracaecum rudolphii and Syngamus trachea, the cestode Tetrabothrius sp, the trematode Galactosomum puffini and the acanthocephalan Corynosoma sp were identified in Pelecanus thagus. In Spheniscus humboldti, the trematode Cardiocephaloides physalis and the nematodes Contracaecum pelagicum and Cyathostoma phenisci were identified. Syngamus trachea, Galactosomum puffini, Corynosoma sp and Contracaecum pelagicum are considered new reports in Pelecanus thagus in Peru. In addition, Spheniscus humboldti can be considered new host of Cardiocephaloides physalis and Cyathostoma phenisci.
Key words: helminths; Pelecanus thagus; Spheniscus humboldti; Peru
INTRODUCCIÓN
El pelícano de la costa peruana (Pelecanus thagus) es un ave marina residente de la Corriente de Humboldt, presente desde el norte de Perú hasta la costa central de Chile (Simeone et al., 2003). Es una especie predadora que consume principalmente anchoveta (Engraulis ringens) y otros peces pelágicos (Guillén, 1990), que son capturados mediante buceo a poca profundidad o por cleptoparasitismo (Duffy, 1980). Asimismo, el pingüino de Humboldt (Spheniscus humboldti), es también un ave endémica de la costa del Pacífico de América del Sur, entre Perú y Chile, que se alimenta principalmente de peces, siendo los cefalópodos y crustáceos sus alimentos secundarios (Herling et al., 2005; Yáñez et al., 2012).
Ambas especies costeras participan en el ciclo de vida como hospedadores definitivos de algunos helmintos, siendo los peces marinos los hospedadores intermediarios o paraténicos (Fagerholm y Overstreet, 2009). Se dispone de estudios en el continente americano sobre la carga parasitaria en Pelecanus occidentalis y Phalacrocorax brasilianus (Dyer et al., 2002; Dronen et al., 2003; Torres et al., 2005; Monteiro et al., 2011; Violante-González et al., 2011), asimismo son más comunes los estudios de helmintofauna en Spheniscus magellanicus (Gonzales-Acuña et al., 2008; Díaz et al., 2010; Rezende et al., 2013), existiendo únicamente un trabajo previo sobre parásitos gastrointestinales en S. humboldti de Chile (Gonzales-Acuña et al., 2008).
En Perú, los estudios son escasos para P. thagus (Sarmiento et al., 1999; Vásquez y Chávez, 1962) e inexistentes para S. humboldti. El objetivo del presente estudio fue identificar los endoparásitos en P. thagus y S. humboldti que fueron hallados muertos a causa de un fenómeno marino desconocido que produjo mortandad en varias especies de invertebrados y vertebrados de la costa peruana en 2012.
MATERIALES Y MÉTODOS
Se estudiaron dos pelícanos (P. thagus) y dos pingüinos (S. humboldti) que se recogieron de la playa de Chorrillos (Lima, Perú) (12° 112 113 S, 77° 12 163 W) en junio de 2012. La colecta de los helmintos se llevó a cabo en el Laboratorio de Parasitología de Animales Silvestres y Zoonosis de la Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos (UNMSM) en Lima.
Para la obtención de estadios adultos de los parásitos procedentes del tracto digestivo se aplicaron técnicas convencionales (Travassos, 1950). Las muestras fueron pro-cesadas empleando un tamiz circular de 80 hilos por pulgada. Los trematodos, cestodos y acantocéfalos recuperados se lavaron en solución fisiológica y se fijaron con formol al 10%, previo prensado entre dos láminas portaobjetos. Finalmente, se colorearon con carmín acético de Semichon y montaron en bálsamo de Canadá previa decoloración, deshidratación y diafanización. Los nematodos se fijaron con alcohol al 70% caliente (6065 °C) y se clarificaron en una mezcla de alcohol con fenol.
Los parásitos fueron observados con un microscopio (Leica DM750,Alemania) y fueron fotografiados. Además, se tomaron las medidas referenciales (en mm). Las muestras se encuentran archivadas en el laboratorio de la institución.
RESULTADOS
Helmintos en P. thagus
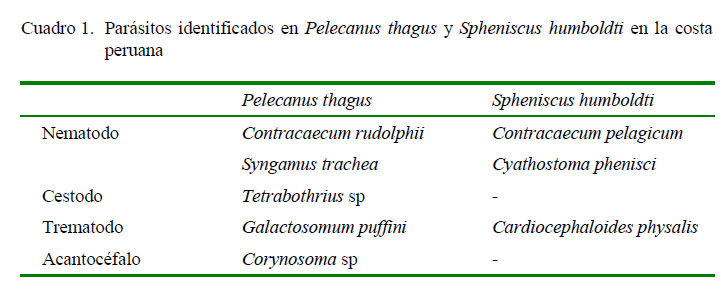
Se identificaron dos nematodos, un trematodo, un cestodo y un acantocéfalo (Cuadro 1).
Nematoda
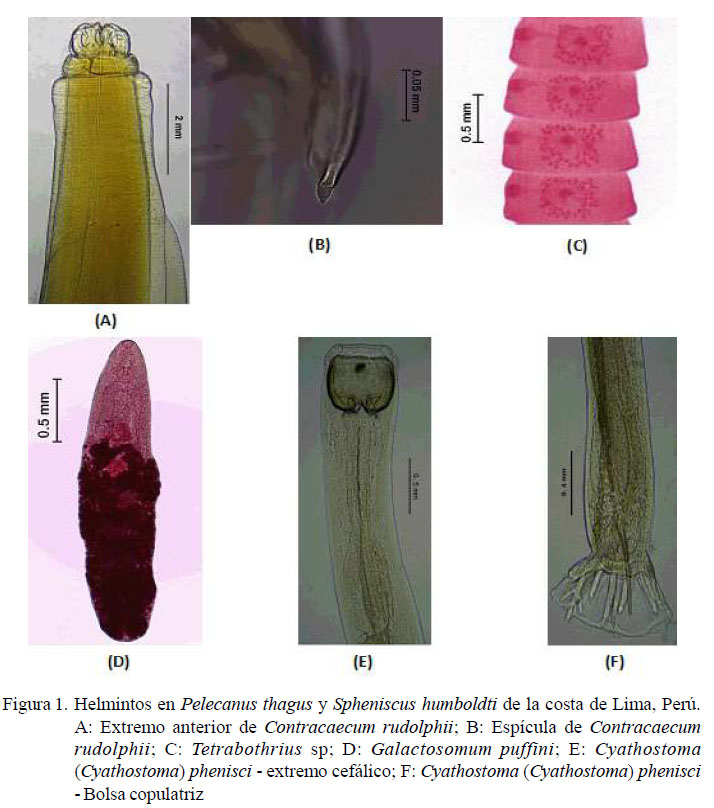
Familia Anisakidae (Railliet y Henry, 1912; Skrjabin y Karokhin, 1945) Contracaecum rudolphii Hartwich, 1964 (Figura 1A, B)
Se colectaron 15 machos y 22 hembras. Los machos miden entre 25 y 33 mm y las hembras entre 30 y 53 mm. Presentan boca rodeada de tres labios hexagonales con papilas e interlabios desarrollados. Los machos poseen numerosas papilas caudales (aproximadamente 35 pares), y espículas aladas largas con terminación característica de la especie.
Localización: Proventrículo
Número de especímenes estudiados: 12
Espécimen: Col. PAS-FCB No 456
Familia Syngamidae Leiper, 1912
Syngamus trachea (Montagu, 1811)
Machos y hembras unidos en cópula. El macho mide entre 3 y 7 mm y la hembra entre 13 y 22 mm. Tienen collar peribucal. Presenta una cápsula bucal gruesa y de 6 a 10 dientes en el fondo. Los huevos poseen opérculo en ambos polos.
Localización: Tráquea
Número de especímenes estudiados: Seis machos y seis hembras
Espécimen depositado: Col. PAS-FCB No 457
Cestoda
Familia Tetrabothriidae Linton, 1891
Tetrabothrius sp. (Figura 1C)
Se revisaron siete proglótidos maduros de un segmento de estróbila. Los proglótidos son más anchos que largos. Los maduros miden 1.1 mm de ancho, con poros genitales unilaterales y atrio genital musculoso. Presentan cerca de 45 testículos. Ovario central y lobulado, rodeado de testículos. Glándula vitelógena anterior al ovario.
Localización: Intestino
Número de especímenes estudiados: Cuatro proglótidos maduros
Espécimen: Col. PAS-FCB No 458
Trematoda
Familia Heterophyidae Odhner, 1914
Galactosomum puffini Yamaguti, 1941 (Figura 1D)
Mide de 1.3 a 1.8 mm. Cuerpo lingüiforme, cubierto de espinas. Ventosa oral subterminal y acetábulo con pre-faringe larga. Los ciegos intestinales llegan cerca del extremo posterior del cuerpo. Presentan gonotylo. Testículos ovalados y de posición levemente oblicua. La región prostática de la vesícula seminal es larga. Acetábulo situado anterior y dorsal al gonotylo. Ovario pre-testicular.
Vitelógenas laterales se inician antes del ovario hasta el extremo posterior.
Localización: Intestino
Número de especímenes estudiados: Tres
Espécimen: Col. PAS-FCB No 459
Acantocephala
Familia Polymorphidae Meyer, 1931
Corynosoma sp.
Un ejemplar inmaduro que mide 4.5 mm. Parte anterior del tronco ensanchada y con espinas, las cuales corren en una banda por la cara ventral, llegando cerca del extremo posterior.
Localización: Intestino
Número de especímenes estudiados: Uno
Espécimen: Col. PAS-FCB No 460
Helmintos en S. humboldti
Dos nematodos y un trematodo (Cuadro 1)
Nematoda
Familia Anisakidae (Railliet y Henry, 1912)
Skrjabin y Karokhin, 1945
Contracaecum pelagicum Johnston y Mawson, 1942
Los machos miden 18 a 21 mm y las hembras de 25 a 35 mm. Boca rodeada de tres labios e interlabios bifurcados y de menor tamaño que los labios. El macho presenta la cola curvada ventralmente y con numerosas papilas, las espículas largas y aladas terminan adelgazadas. Tanto machos como hembras presentan estriaciones transversales formando una especie de collar.
Localización: Estómago
Número de especímenes estudiados: Siete
Espécimen: Col. PAS-FCB No 461
Familia Syngamidae Leiper, 1912
Cyathostoma (Cyathostoma) phenisci Baudet, 1937 (Figura 1E, F)
El macho mide entre 20 y 23 mm y la hembra entre 55 y 65 mm. Se caracterizan porque la abertura de la cápsula bucal carece de collar y en el fondo de la cápsula se sitúan seis dientes. El macho carece de gubernáculo.
Localización: Tráquea
Número de especímenes estudiados: Cinco
Espécimen: Col. PAS-FCB No 462
Trematoda
Familia Strigeidae Railliet, 1919
Cardiocephaloides physalis (Lutz, 1927)
Sudarikov, 1959
Mide 20 mm. Su cuerpo presenta un segmento anterior y posterior; el anterior lleva 2 expansiones laterales.
Localización: Intestino
Número de especímenes estudiados:
Uno
Espécimen: Col. PAS-FCB No 463
DISCUSIÓN
El género Contracaecum (Anisakidae) comprende más de 50 especies que parasitan aves piscívoras y mamíferos de agua dulce, salobre y sistemas marinos (Anderson, 2000). En aves acuáticas constituyen un complejo de especies a dilucidarse mediante métodos genéticos moleculares (Mattiucci et al., 2008).
Los especímenes estudiados tienen los detalles diagnósticos señalados en la literatura (Hartwich, 1964), especialmente a nivel de las espículas del macho que identifican a C. rudolphii. Esta especie fue reportada en diversas aves marinas de Chile, Brasil y EEUU; así, por ejemplo, en Phalacrocorax olivaceus, Phalacrocorax brasilianus y Phalacrocorax erythrorhynchos (Torres et al., 1991, 2005; Kinsella et al., 2004; Amato et al., 2006). En Perú existen solo dos reportes en P. thagus (Vásquez y Chávez, 1962; Sarmiento et al., 1999). Análisis genéticos describieron dos variedades europeas de esta especie, la C. rudolphii A y B, pudiendo haber una coexistencia entre ambas (Szostakowska y Fagerholm, 2012). También se describen las especies C y D en Australia (Shamsi, 2014).Asimismo, se han demostrado diversas diferencias genéticas en C. rudolphii, identificándose una nueva especie denominada Contracaecum bioccai (Mattiucci et al., 2008).
C. pelagicum Johnston y Mawson 1942 posiblemente presenta un ciclo con hospedadores invertebrados paraténicos como copépodos, eufáusidos y anfípodos y hospedadores intermediarios vertebrados paraténicos como peces teleósteos, los cuales son presas del pingüino como hospedador definitivo (Garbin et al., 2013). Asimismo, diversos reportes señalan la presencia de C. pelagicum enpingüinos deBrasil,Argentina y Chile (Gonzales-Acuña et al., 2008; Díaz et al., 2010; Rezende et al., 2013). En estudios de lesiones en P. carbo y S. humboldti se ha observado que C. rudolphii se encuentra asociado con gastritis severa y ulcerosa en los sitios de fijación y gastritis granulomatosa difusa en áreas adyacentes, pero al no afectar la condición corporal, posiblemente pueda existir un equilibrio entre este y el hospedador (Rokicki et al., 2011). Sin embargo, otros estudios hacen referencia que este podría ser una causa de mortalidad (Yáñez et al., 2012).
El nematodo Syngamus ha sido reportado en Brasil, México y Perú en P. brasilianus, Phalacrocorax bougainvillii y P. occidentalis (Vásquez y Chávez, 1962; Sarmiento et al., 1999; Monteiro et al., 2011; Violante-González et al., 2011). Además, en Gallus gallus en las localidades peruanas de Lima, Loreto y Pasco (Chávez y Zaldívar, 1967). Este reporte sería el primer registro en S. humboldti en la costa peruana. Con relación al daño que produce, Bush y Montali (1977) indican que tiene la capacidad de adherirse a la mucosa traqueal y producir obstrucción casi completa.
Tetrabothrius Rudolphi 1819 fue anotado como uno de los géneros con mayor representación entre los parásitos descritos en aves, agrupando a más de 50 especies (Gonzales-Acuña et al., 2008). Una especie no determinada fue reportada en P. occidentalis thagus y P. erythrorhynchus en Perú, Puerto Rico y EEUU (Vásquez y Chávez, 1962; Dyer et al., 2002; Dronen et al., 2003).
El trematodo G. puffini Yamaguti 1941 fue registrado en P. occidentalis de Panamá y EEUU (Hutton y Sogandares-Bernal, 1960; Dronen et al., 2003) y en Sula nebouxii en México (Rubio-Godoy et al., 2011). En Perú ha sido reportado Galactosomum sp en Larus pipixcan y Sterna hirundo (Tantaleán et al., 1992).
Las especies del género Corynosoma Lühe 1904 tienen un ciclo evolutivo que incluye como hospedadores intermediarios a crustáceos en ciclos acuáticos, artrópodos en ciclos terrestres y peces como hospedadores paraténicos (Brockerhoff y Smales, 2002). Han sido reportadas en S. magellanicus en Argentina (Pazos et al., 2003), P. olivaceus y Larus dominicanus en Chile (Torres et al., 1991, 1992) y en P. occidentalis thagus en EEUU. (Dronen et al., 2003). Estas especies de parásitos ocasionan daños en el intestino de aves destruyendo las vellosidades y criptas glandulares (Hinojosa-Sáez y Gonzales-Acuña, 2005), probablemente comprometiendo la capa muscular intestinal (Torres et al., 1993).
En cuanto a C. phenisci Baudet 1937, diversos estudios en aves la registran, como en P. occidentalis y P. erythrorhynchus (Courtney y Forrester, 1974; Overstreet y Curran, 2005), Gavia immer (Kinsella y Forrester, 1999), Phalacrocorax atriceps (Oyarzún-Ruiz y Muñoz-Alvarado, 2015); así como en S. demersus en África (Kanarek et al., 2013). En Perú, se registró Cyathostoma sp en P. occidentalis en Ica (Sarmiento et al., 1999).
C. physalis fue registrada en S. magellanicus de Brasil (Rezende et al., 2013), Argentina (Díaz et al., 2010) y Chile (Gonzales-Acuña et al., 2008). En Perú fue solamente reportada en Larus modestus (Tschudi), P. bougainvilleii y Puffinus griseus (Gmelin) (Tantaleán et al., 1992).
Finalmente, a pesar de haber encontrado una variedad de parásitos helmintos en las dos especies en estudio, probablemente estos parásitos no hayan ocasionado su muerte.
CONCLUSIONES
-
Se considera a Syngamus trachea, Galactosomun puffini, Corynosoma sp y Contracaecum pelagicum como nuevos registros para el Perú.
-
Spheniscus humboldti es un nuevo hospedero para el nematodo Cyathostoma phenisci y el trematodo Cardiocephaloides physalis.
LITERATURA CITADA
1. Amato JF, Monteiro CM, Amato SB. 2006. Contracaecum rudolphii Hartwich (Nematoda, Anisakidae) from the neotropical cormorant, Phalacrocorax brasilianus (Gmelin) (Aves, Phalacrocoracidae) in southern Brazil. Rev Bras Zool 23: 1284-1289. doi: 10.1590/S0101-81752006000400046 [ Links ]
2. Anderson RC. 2000. Nematode parasites of vertebrates: their development and transmission. 2nd ed. Wallingford, UK: CABI Pub. 672 p. [ Links ]
3. Brockerhoff AM, Smales LR. 2002. Profilicollis novaezelandensis n. sp. (Polymorphidae) and two other acanthocephalan parasites from shore birds (Haematopodidae and Scolopacidae) in New Zealand, with records of two species in intertidal crabs (Decapoda: Grapsidae and Ocypodidae). Syst Parasitol 52: 55-65. doi: 10.1023/ A:1015011112900 [ Links ]
4. Bush RM, Montali RJ. 1977. Principles of zoological animal medicine. Scope 21: 9-24. [ Links ]
5. Chávez CE, Zaldívar R. 1967. Zooparasites of livestock in Peru. Foreign Agricultural Research Grant Project. Departament of Agriculture, USA. 85 p. [ Links ]
6. Courtney CH, Forrester DJ. 1974. Helminth parasites of the brown pelican in Florida and Louisiana. Proc Helminthol Society Washington 41: 89-93. [ Links ]
7. Díaz JI, Cremonte F, Navone GT. 2010. Helminths of the Magellanic penguin, Spheniscus magellanicus (Sphenisciformes), during the breeding season in Patagonian Coast, Chubut, Argentina. Comp Parasitol 77: 172-177. doi: 10.1654/4441.1 [ Links ]
8. Dronen NO, Blend CK, Anderson CK. 2003. Endohelminths from the brown pelican, Pelecanus occidentalis, and the American white pelican, Pelecanus erythrorhynchus, from Galveston Bay, Texas, USA, and checklist of pelican parasites. Comp Parasitol 70: 140-154. doi: 10.1654/1525-2647(2003)070- [0140:EFTBPP]2.0.CO;2 [ Links ]
9. Duffy DC. 1980. Patterns of piracy by Peruvian seabirds: a depth hypothesis. Ibis 122: 521-525. doi: 10.1111/j.1474- 919X.1980.tb00910.x [ Links ]
10. Dyer WG, Jr EHW, Mignucci- Giannoni AA, Jiménez-Marrero NM, Bunkley-Williams L, Moore DP, Pence DB. 2002. Helminth and arthropod parasites of the brown pelican, Pelecanus occidentalis, in Puerto Rico, with a compilation of all metazoan parasites reported from this host in the Western Hemisphere. Avian Pathol 31:441-448. DOI:10.1080/ 0307945021000005815. [ Links ]
11. Fagerholm HP, Overstreet RM. 2008. Ascaridoid Nematodes: Contracaecum, Porrocaecum, and Baylisascaris. In: Atkinson CT, Thomas NJ, Hunter DB (eds). Parasitic diseases of wild birds. USA: Wiley-Blackwell. p. 413-433. [ Links ]
12. Garbin LE, Mattiucci S, Paoletti M, Diaz JI, Nascetti G, Navone GT. 2013. Molecular identification and larval morphological description of Contracaecum pelagicum (Nematoda: Anisakidae) from the anchovy Engraulis anchoita (Engraulidae) and fish-eating birds from the Argentine North Patagonian Sea. Parasitol Int 62: 309- 319. doi: 10.1016/j.parint.2013.03.001 [ Links ]
13. González-Acuña D, Kinsella JM, Lara J, Valenzuela-dellarossa G. 2008. Parásitos gastrointestinales en pingüino de Humboldt (Spheniscus humboldti) y pingüino de Magallanes (Spheniscus magellanicus) en las costas del centro y centro sur de Chile. Parasitol Latinoam 63: 58-63. doi: 10.4067/S0717-77122008000100010 [ Links ]
14. Guillén V. 1990. Alimentación del pelicano o alcatraz Pelecanus thagus en la isla Macabi. Bol Lima 12: 85-88. [ Links ]
15. Hartwich G. 1964. Revision der Vogelparasitischen Nematoden Mitteleuropas II. Die Gattung Contracaecum Railliet & Henry, 1912 (Ascaridoidea). Zoologisches Museum Berlin. 40: 15-53. doi: 10.1002/mmnz.19590350107 [ Links ]
16. Herling C, Culik BM, Hennicke JC. 2005. Diet of the Humboldt penguin (Spheniscus humboldti) in northern and southern Chile. Mar Biol 147: 13-25. doi: 10.1007/s00227-004-1547-8 [ Links ]
17. Hinojosa-Sáez A, González-Acuña D. 2005. Estado actual del conocimiento de helmintos en aves silvestres de Chile. Gayana (Concepc) 69: 241-253. doi: 10.4067/S0717-65382005000200004 [ Links ]
18. Hutton RF, Sogandares-Bernal F. 1960. Studies on helminth parasites from the coast of Florida. II. Digenetic trematodes from shore birds of the west coast of Florida. I. Bull Marine Sci 10: 40-54. [ Links ]
19. Kanarek G, Horne EC, Zaleoeny G. 2013. Cyathostoma (Cyathostoma) phenisci Baudet, 1937 (Nematoda: Syngamidae), a parasite of respiratory tract of African penguin Spheniscus demersus: morphological and molecular characterization with some ecological and veterinary notes. Parasitol Int 62: 416-422. doi: 10.1016/ j.parint.2013.05.002 [ Links ]
20. Kinsella JM, Forrester DJ. 1999. Parasitic helminths of the common loon, Gavia immer, on its wintering grounds in Florida. J Helm Soc Wash 66: 1-6. [ Links ]
21. Kinsella JM, Spalding MG, Forrester DJ. 2004. Parasitic helminths of the American white pelican, Pelecanus erythrorhynchos, from Florida, USA. Comp Parasitol 71: 29-36. doi: 10.1654/ 4092 [ Links ]
22. Mattiucci S, Paoletti M, Olivero-Verbel J, Baldiris R, Arroyo-Salgado B, Garbin L, Navone G, Nascetti G. 2007. Contracaecum bioccai n. sp. from the brown pelican Pelecanus occidentalis (L) in Colombia (Nematoda: Anisakidae): morphology, molecular evidence and its genetic relationship with congeners from fish-eating birds. Syst Parasitol 69: 101- 121. doi: 10.1007/s11230-007-9116-4 [ Links ]
23. Monteiro CM, Amato JFR, Amato SB. 2011. Helminth parasitism in the Neotropical cormorant, Phalacrocorax brasilianus, in Southern Brazil: effect of host size, weight, sex, and maturity state. Parasitol Res 109: 849-855. doi: 10.1007/s00436-011-2311-x [ Links ]
24. Overstreet RM, Curran SS. 2005. Parasites of the American white pelican. Gulf Caribb Res 17: 31-48. doi: 10.18785/ gcr.1701.04 [ Links ]
25. Oyarzún-Ruiz P, Muñoz-Alvarado P. 2015. Cormorán imperial, Phalacrocorax atriceps (Aves, Phalacrocoracidae): nuevo hospedero para un parásito respiratorio, Cyathostoma (Cyathostoma) phenisci (Nematoda, Syngamidae). Rev Biol Mar Oceanogr 50: 353- 358. doi: 10.4067/S0718-19572015000- 300013 [ Links ]
26. Pazos G, Laurenti S, Díaz J. 2003. Helmintofauna del pingüino de Magallanes (Spheniscus magellanicus) en Península Valdés, provincia del Chubut: resultados preliminares. Rev Chil Hist Nat 2: 85-94. [ Links ]
27. Rezende GC, Baldassin P, Gallo H, Silva RJ. 2013. Ecological aspects of helminth fauna of Magellanic penguins, Spheniscus magellanicus (aves: Spheniscidae), from the Northern Coast of the State of São Paulo, Brazil. Braz J Biol 73: 61-66. doi: 10.1590/S1519- 69842013000100008 [ Links ]
28. Rokicki J, Soltysiak Z, Dziekoñska- Rynko J, Boruciñska J. 2011. Pathology associated with Contracaecum rudolphii (Nematoda: Anisakidae) infection in the great cormorant Phalacrocorax carbo (L. 1758). Helminthologia 48: 29-35. doi: 10.2478/ s11687-011-0006-6 [ Links ]
29. Rubio-Godoy M, de León GPP, Mendoza-Garfias B, Carmona-Isunza MC, la Mora AN, Drummond H. 2011. Helminth parasites of the bluefooted booby on Isla Isabel, México. J Parasitol 97: 636-641. doi: 10.1645/GE- 2675.1 [ Links ]
30. Sarmiento L, Tantaleán M, Huiza A. 1999. Nemátodos parásitos del hombre y de los animales en el Perú. Rev Per Parasitol 14: 9-65. [ Links ]
31. Shamsi S. 2014. Recent advances in our knowledge of Australian anisakid nematodes. Int J Parasitol Parasites Wildl 3: 178-187. doi: 10.1016/ j.ijppaw.2014.04.001 [ Links ]
32. Simeone A, Luna-Jorquera G, Bernal M, Garthe S, Sepúlveda F, Villablanca R, Ellenberg U, et al. 2003. Breeding distribution and abundance of seabirds on islands off north-central Chile. Rev Chil Hist Nat 76: 323-333. doi: 10.4067/S0716- 078X2003000200016 [ Links ]
33. Szostakowska B, Fagerholm HP. 2012. Coexistence and genetic variability of Contracaecum rudolphii A and Contracaecum rudolphii B (Nematoda: Anisakidae) in cormorants, Phalacrocorax carbo sinensis, in the Baltic region. J Parasitol 98: 472-478. doi: 10.1645/GE-2884.1 [ Links ]
34. Tantaleán M, Sarmiento L, Huiza A. 1992. Digeneos (Trematoda) del Perú. Bol Lima 14: 47-84. [ Links ]
35. Torres P, Ruíz E, Gesche W, Montefusco A. 1991. Gastrointestinal helminths of fish-eating birds from Chiloe Island, Chile. J Wildl Dis 27: 178-179. doi: 10.7589/0090-3558-27.1.178 [ Links ]
36. Torres P, Contreras A, Cubillos V, Gesche W, Montefusco A, Rebolledo C, Mira A, et al. 1992. Parasitismo en peces, aves piscívoras y comunidades humanas ribereñas de los lagos Yelcho y Tagua-Tagua, X Región de Chile. Arch Med Vet 24: 77-92. [ Links ]
37. Torres P, Schlatter R, Montefusco A, Gesche W, Ruiz E, Contreras A. 1993. Helminth parasites of piscivorous birds from lakes in the south of Chile. Mem Inst Oswaldo Cruz 88: 341-343. doi: 10.1590/S0074-02761993000200028 [ Links ]
38. Torres P, Ortega J, Schlatter R. 2005. Nematode parasites of the digestive tract in Neotropic cormorant chicks (Phalacrocorax brasilianus) from the River Cruces Ramsar site in southern Chile. Parasitol Res 97: 103-107. doi :10.1007/ s00436-005-1372-0 [ Links ]
39. Travassos L. 1950. Introdução ao estudo da Helmintologia. Rev Brasil Biol 173 p. [ Links ]
40. Vásquez M, Chávez C. 1962. Contribución al estudio de los parásitos de las aves guaneras, Phalacrocorax bougainvillii Lesson (Guanay) y Pelecanus occidentalis thagus (Alcatraz). Rev Fac Med Vet Lima 15: 157-230. [ Links ]
41. Violante-González J, Monks S, Gil- Guerrero S, Rojas-Herrera A, Flores- Garza R, Larumbe-Morán E. 2011. Parasite communities of the neotropical cormorant Phalacrocorax brasilianus (Gmelin) (Aves, Phalacrocoracidae) from two coastal lagoons in Guerrero state, Mexico. Parasitol Res 109: 1303- 1309. doi: 10.1007/s00436-011-2377-5 [ Links ]
42. Yañez F, Fernández I, Campos V. V, Mansilla M, Valenzuela A, González H, Rodríguez C, et al. 2012. First pathological report of parasitic gastric ulceration in Humboldt penguin (Spheniscus humboldti) along the coast of south central Chile. Lat Am J Aquat Res 40: 448-452. doi: 10.3856/vol40- issue2-fulltext-20 [ Links ]
Recibido: 22 de junio de 2017
Aceptado para publicación: 6 de noviembre de 2017