Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.29 no.2 Lima abr./jun. 2018
http://dx.doi.org/10.15381/rivep.v29i2.14490
ARTÍCULOS PRIMARIOS
Disposición plasmática de danofloxacina al 2.5% en cabras
Plasma disposition of danofloxacin 2.5% in goats
Carlos A. Errecalde1,3, Guillermo F. Prieto1, Carlos F. Lüders2
1 Cátedra de Farmacología, Departamento de Clínica Animal, Facultad de Agronomía y Veterinaria, Universidad Nacional de Río Cuarto, Argentina
2 Cátedra de Farmacología, Escuela de Medicina Veterinaria, Facultad de Recursos Naturales, Universidad Católica de Temuco, Chile
3 E-mail: cerrecalde@ayv.unrc.edu.ar
RESUMEN
Se determinaron parámetros farmacocinéticos de danofloxacina al 2.5% tras su aplicación endovenosa e intramuscular en hembras caprinas adultas. Los niveles plasmáticos se cuantificaron por HPLC con detector de fluororescencia establecido a 295 nm de excitación y 490 nm de emisión utilizando fase móvil compuesta por agua, acetonitrilo y trietilamina (79:19:1 v/v/v) ajustada a pH 3.0. En cada vía de aplicación, utilizando los datos de concentraciones plasmáticas versus tiempo en cada animal se determinaron parámetros farmacocinéticos con el software PK Solution 2.0. El límite de cuantificación del ensayo fue de 0.0048 µg/ml. El perfil cinético exhibido por danofloxacina en caprinos es similar al conjunto de fluoroquinolonas en animales domésticos. La aplicación intramuscular provee rápida absorción, genera una Cmáx de 0.36 ± 0.13 µg/ml a los 55.1 ± 13.8 minutos y exhibe amplia distribución en el organismo y biodisponibilidad (F) del 109.7 ± 19.8%. Danofloxacina mostró discreta permanencia en el organismo, según expresan los valores conseguidos en el t½β= 4.35 horas (EV), 4.32 horas (IM) y en el TMR= 5.9 horas (EV), 6.7 horas (IM). La aplicación intramuscular es equiparable para la vía endovenosa, pero el uso racional requiere el ajuste posológico para asegurar el éxito clínico-terapéutico debido que las relaciones plasmáticas de Cmáx y ABC respecto la CIM90 de M. haemolytica de 9 y 41, respectivamente, son insuficientes para asegurar eficacia clínica-microbiológica.
Palabras clave: caprinos; farmacocinética; fluoroquinolonas
ABSTRACT
Pharmacokinetic parameters of danofloxacin at 2.5% were determined after intravenous and intramuscular application in adult goat females. Plasma levels were quantified by HPLC with fluorescence detector set at 295 nm excitation and 490 nm emission using mobile phase composed of water, acetonitrile and triethylamine (79:19:1 v/v/v) adjusted to pH 3.0. In each route of application, using plasma concentrations versus time data in each animal, pharmacokinetic parameters were determined with PK Solution 2.0 software. Quantification limit of the assay was 0.0048 µg/ml. The kinetic profile exhibited by danofloxacin in goats was similar to that of fluoroquinolones in domestic animals. The intramuscular application provides rapid absorption, produces a Cmax of 0.36 ± 0.13 µg/ml at 55.1 ± 13.8 minutes, and exhibits wide distribution in the organism and bioavailability (F) of 109.7 ± 19.8%. Danofloxacin showed a slight permanence in the organism, according to the values obtained in t½β = 4.35 hours (EV), 4.32 hours (IM) and in the TMR = 5.9 hours (EV), 6.7 hours (IM). Intramuscular and intravenous application are comparable, but rational use requires dosage adjustment to ensure clinical and therapeutic success, because plasma Cmax/ MIC90 and ABC/ MIC90 ratios of 9 and 41, respectively in relation to MIC of M. haemolytica, are insufficient to ensure clinical-microbiological efficacy.
Key words: fluoroquinolones; goat; pharmacokinetic
INTRODUCCIÓN
Las fluoroquinolonas son antimicrobianos sintéticos provistos de notables propiedades farmacocinéticas relacionadas con su uso terapéutico, entre las cuales se destacan la moderada permanencia en el organismo y la amplia difusión tisular, consecuencia del carácter liposoluble y la escasa unión a las proteínas plasmáticas (Čonková et al., 2009; Papich y Riviere, 2009). Estas sustancias desarrollan acciones bactericidas rápidas mediante el bloqueo de la enzima ADNgirasa, cuya cinética de muerte celular es concentración dependiente.
Diversos ensayos clínicos realizados con fluoroquinolonas demuestran la importancia terapéutica de las relaciones establecidas entre parámetros dosis dependiente tales como la concentración máxima (Cmáx) y el área bajo la curva (ABC), frente la concentración inhibitoria mínima (CIM90 de microorganismos susceptibles, como índices predictores de eficacia antimicrobiana y clínica (Čonková et al., 2009; Baggot y Giguère, 2013; Giguère y Dowling, 2013). El cociente Cmáx/CIM >8 redujo la expresión de resistencia bacteriana mientras la relación ABC/CIM >125 fue requisito para lograr la erradicación bacteriana y prevenir el crecimiento de microorganismos (Lees et al., 2008; Baggot y Giguère, 2013; Giguère y Dowling, 2013).
Danofloxacina es una fluoroquinolona de tercera generación que solo se aplica en animales domésticos sobre gérmenes Gram negativos, algunos Gram positivos y ciertos micoplasmas (Ayling et al., 2000; Čonková et al., 2009; Papich y Riviere, 2009). En presencia de Mannheimia haemolytica se estableció la CIM en >0.04 µg/ml (Shojaee Aliabadi y Lees, 2003; Grobbel et al., 2007).
Los antecedentes cinéticos disponibles de danofloxacina revelan pronta absorción por administración intramuscular (Shojaee Aliabadi y Lees, 2003; Čonková et al., 2009; Karademir et al., 2015). En rumiantes, la Cmáx fue de 0.3 µg/ml (McKellar et al., 1998; Atef et al., 2001) antes de una hora de la aplicación (Karademir et al., 2015).
Se encontró en diversas especies animales que la biodisponibilidad (F) por aplicación parenteral fue superior al 65% (McKellar et al., 1998; Shem-Tov et al., 1998) y pronta distribución desde el compartimento central (Shem-Tov et al., 1998; Atef et al., 2001; Sappal et al., 2009). Esto es como consecuencia de la incorporación de un anillo piperazínico que promueve el ingreso a los tejidos y, simultáneamente, reduce los efectos indeseables (Brown, 1996) y el extenso volumen de distribución (Vd), cuyos valores son de 1.4 l/kg en caprinos (Atef et al., 2001) y entre 3.4 y 4.3 l/kg en bovinos (Apley y Upson, 1993). Estos resultados insinúan notable disposición tisular, primordialmente en el árbol respiratorio (Apley y Upson, 1993; McKellar et al., 1998), donde se encontraron niveles superiores a la CIM de patógenos respiratorios que subsisten entre 4 y 12 horas (Apley y Upson, 1993).
Danofloxacina experimenta moderada permanencia en el organismo (McKellar et al., 1998; Sappal et al., 2009), según expresa la vida media de eliminación (t½β) hallada de 1.3 horas en caprinos (Atef et al., 2001), entre 2.9 a 7.4 horas en bovinos (Apley y Upson, 1993; Friis, 1993; Shojaee Aliabadi y Lees, 2003), de 2.08 horas (Shem-Tov et al., 1998) a 3.3 horas en ovinos (McKellar et al., 1998; Karademir et al., 2015) y de 5.4 y 6.9 horas en porcinos, para la aplicaciones endovenosa e intramuscular, respectivamente (Richez et al., 1996).
Las propiedades farmacocinéticas, el amplio espectro de acción y la potencia demostrada, sugieren el empleo de danofloxacina en enfermedades respiratorias producidas por gérmenes susceptibles en rumiantes, porcinos y aves (Brown, 1996; Čonková et al., 2009), sin embargo, son limitados los informes farmacocinéticos en caprinos, circunstancia que motivó el presente estudio con el propósito de establecer parámetros farmacocinéticos plasmáticos, luego de la aplicación de una dosis única por las vías intravenosa e intramuscular.
MATERIALES Y MÉTODOS
En un diseño cruzado de tratamiento se utilizaron seis cabras criollas adultas no gestantes, clínicamente sanas y de 30.5 ± 8.3 kg de peso, seleccionadas al azar de una población de 80 animales. Las cabras se encontraban en pastoreo libre durante el día y suplementación con grano de maíz molido durante el encierre nocturno. Tres animales recibieron una dosis única de 1.25 mg/kg de mesilato de danofloxacina al 2.5% (Advocin®, Pfizer) en forma de bolus en la vena yugular derecha y tres animales idéntica dosis, pero aplicada en el músculo semitendinoso izquierdo. Luego de dos semanas se intercambiaron los tratamientos.
Posterior a la administración se obtuvieron muestras de sangre de la vena yugular izquierda (3-4 ml) en tubos heparinizados a los 5, 10,15, 20, 30 min y 1, 2, 3, 4, 6, 8, 10, 12 y 24 h. Las muestras fueron centrifugadas de inmediato durante 15 min a 1000 g y conservadas a -20 °C hasta su análisis.
El ensayo preparativo consistió en la extracción líquido-líquido del analito utilizando 200 µl de muestra, 200 µl de agua deionizada, 800 µl de metanol y 20 µl de balofloxacina como estándar interno.
El conjunto se sometió a agitación por vórtex durante 30 s y luego de 30 min se centrifugó a 1220 g durante 25 minutos a 4 °C. La separación y cuantificación se realizó por HPLC utilizando un equipo HewlettPackard serie 1050, provisto de bomba isocrática, inyector manual Rheodyne 7125, loop de 100 µl, columna Luna C-18 y guardacolumnas Phenomenex C-18, asociado a un fluorómetro Hewlett -Packard, serie 1046-A de longitud de onda regulable e integrador de la misma marca, serie 3395, mediante una elusión isocrática en fase reversa con flujo de 0.8 ml/min, 50 µl de volumen de inyección de muestra y lectura en detector de fluorescencia establecido a 295 nm de excitación y 490 nm de emisión, utilizando fase móvil compuesta por agua, acetonitrilo y trietilamina (79:19:1 v/v) ajustada a pH 3 con ácido ortofosfórico, según Bottcher et al. (2001).
De los cromatogramas correspondientes a las corridas de las muestras del ensayo cinético y los patrones de concentración conocidos, se tomaron los valores del área de pico provistos por danofloxacina y el estándar interno, balofloxacina. De ambos se obtuvo un cociente utilizado para la confección de la curva de calibración y establecer las concentraciones plasmáticas de danofloxacina por regresión lineal simple (r2= 0.99), según Nouws y Ziv (1976). Los datos individuales de concentración de danofloxacina en función del tiempo para cada vía de administración se analizaron mediante el modelo farmacocinético no compartimental utilizando el software PK Solution v. 2.0 (Farrier, 1999) con el propósito de calcular parámetros farmacocinéticos robustos como el ABC y la constante de velocidad de eliminación (β).
Juntamente con el dato de dosis administrada, se calcularon otros parámetros como el volumen de distribución (Vd), clearance total (Cl ) y la vida media de eliminación (t β). Para evaluar la normalidad de estas variables se realizó la prueba de Shapiro-Wilk. Posteriormente y de acuerdo con dichos resultados, las diferencias entre las variables se analizaron mediante la Prueba de T y el Test de Wilcoxon para muestras relacionadas. La biodisponibilidad (F) intramuscular se determinó mediante la ecuación: F= ABC El límite de cuantificación del ensayo fue de 0.0048 µg/ml.
RESULTADOS Y DISCUSIÓN
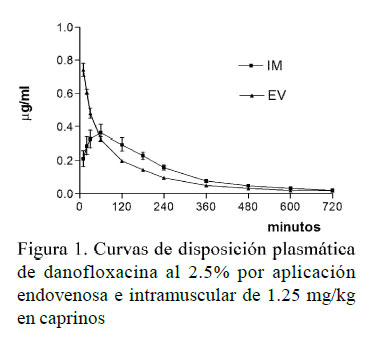
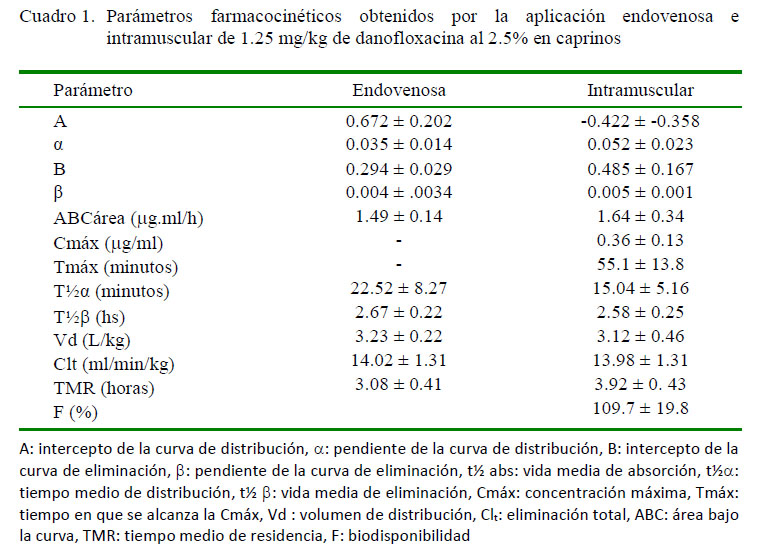
El método empleado permitió establecer el antimicrobiano a los 10 min pos-aplicación, similar a otras experiencias (Mann y Frame, 1992) y hasta 12 h después de la aplicación, excediendo al método microbiológico (Ateff et al., 2001). La Figura 1 representa las curvas de disposición plasmáticas generadas por aplicación la aplicación endovenosa e intramuscular de 1.25 mg/kg de danofloxacina en cabras. El Cuadro 1 indica el valor promedio (± DE) de los parámetros cinéticos por ambas vías de administración.
Las variables farmacocinéticas analizadas no arrojaron diferencias significativas. La aplicación intramuscular provee rápida absorción, similar a lo informado en bovinos (Apley y Upson, 1993; Shojaee Aliabadi y Lees, 2003), porcinos (Mann y Frame, 1992), caprinos (Atef et al., 2001), ovinos (McKellar et al., 1998), generando una Cmáx ligeramente menor al informado en ovinos (McKellar et al., 1998) con idéntica dosis. Asà mismo, el Tmáx es próximo al observado en bovinos y porcinos (Mann y Frame, 2001) y ovinos (McKellar et al., 1998).
Danofloxacina exhibe pronta distribución en concordancia con experiencias en otras especies domésticas (Atef et al., 2001; Giles et al., 1991; Mann y Frame, 1992). Los extensos valores de Vd obtenidos insinúan excelente capacidad para difundirse hacia territorios extravasculares conforme lo comunicado en ovinos (McKellar et al., 1998) y bovinos (Apley y Upson, 1993).
La permanencia de danofloxacina en el organismo resultó discreta, según expresan los parámetros TMR y la vida media de eliminación. Este valor fue similar al informado en bovinos (Mann y Frame, 2001), ligeramente menor al logrado en ovinos (McKellar et al., 1998; Karademir et al., 2015) y muy inferior al obtenido en cerdos (Mann y Frame, 2001).
La fracción plasmática disponible (F) luego de la aplicación intramuscular fue óptima (109.7 ± 19.8%), semejante a la reportada en búfalos (Sappal et al., 2009), ovinos (McKellar et al., 1998) y porcinos (Richez et al., 1996). Pese a estas diferencias, los resultados obtenidos son similares a los informados en experiencias similares desarrolladas en porcinos (Mann y Frame, 1992; Richez et al., 1996), ovinos (McKellar et al., 1998; Karademir et al., 2015) y bovinos (Mann y Frame, 1992) y se corresponden con el perfil farmacocinético exhibido por el conjunto de fluoroquinolonas en animales domésticos (Čonková et al., 2009; Papich y Riviere, 2009; Giguère y Dowling, 2013).
Según la máxima sensibilidad de M. haemolytica reportada frente a danofloxacina (Shojaee Aliabadi y Lees, 2003; Grobbel et al., 2007), en este estudio se lograron relaciones plasmáticas por aplicación intramuscular de Cmáx/CIM< de 9 y 41, respectivamente; valores próximos a los informados en terneros con idéntica dosis (Shojaee Aliabadi y Lees, 2003), pero distantes de los cocientes requeridos para avalar la eficacia clínica-microbiológica (Čonková et al., 2009; Baggot y Giguère, 2013; Giguère y Dowling, 2013), aunque estos refieren solo a niveles plasmáticos.
En consecuencia, similar a lo informado en terneros (Errecalde et al., 2005), en los caprinos resulta indispensable adecuar la posología y el ritmo de administración según la sensibilidad del microorganismo patógeno involucrado. No obstante, el éxito terapéutico reportado en presencia de patologías respiratorias aplicando dosis similares a la empleada en este estudio (Brown, 1996; Čonková et al., 2009), se correspondería con los elevados niveles de danofloxacina obtenidos en esos tejidos (Apley y Upson, 1993; McKellar et al., 1998).
CONCLUSIONES
-
El método de determinación utilizado es útil para cuantificar danofloxacina en plasma caprino.
-
El análisis de las curvas de disposición plasmática del antimicrobiano y la inexistencia de diferencias significativas en los parámetros cinéticos más relevantes entre ambas vías estudiadas permite afirmar que la aplicación intramuscular de danofloxacina es equiparable a la intravenosa.
-
El perfil cinético exhibido por danofloxacina en caprinos es similar al obtenido por el conjunto de fluoroquinolonas, pero el uso racional requiere el ajuste posológico para asegurar el éxito clínico-microbiólogico en esta especie.
LITERATURA CITADA
1. Apley M, Upson D. 1993. Lung tissue concentrations and plasma pharmacokinetics of danofloxacin in calves with acute pneumonia. Am J Vet Res 54: 937- 943. [ Links ]
2. Atef M, El-Gendi A, Amer M, Abb ElAty A. 2001. Some pharmacokinetic data for danofloxacin in healthy goats. Vet Res Commun 25: 367-377. [ Links ]
3. Ayling RD, Baker SE, Peek ML, Simon AJ, Nicholas RA. 2000. Comparison of in vitro activity of danofloxacin, florfenicol, oxytetracycline, spectinomycin and tilmicosin against recent field isolates of Mycoplasma bovis. Vet Rec 146: 745-747. [ Links ]
4. Baggot J, Giguère S. 2013. Principles of antimicrobial drug bioavailability and disposition. In: Giguère, J, Prescott JF, Dowling P (eds). Antimicrobial therapy in veterinary medicine. 5th ed. USA: John Wiley. p 41-77. [ Links ]
5. Böttcher S, Baum H, Hoppe-Tychy T, Benz C, Sonntag H. 2001. An HPLC assay and a microbiological assay to determine levofloxacin in soft tissue, bone, bile and serum. J Pharm Biomed Anal 25: 197-203. [ Links ]
6. Brown SA. 1996. Fluoroquinolones in animal health. J Vet Pharm Ther 19: 114. doi: 10.1111/j.1365-2885.1996.- tb00001.x [ Links ]
7. Čonková E, Èellárov A, Váczi E, Sabová L. 2009. Quinolones from the point of view of pharmacology and veterinary indications (a review). Folia Vet 53: 175-185. [ Links ]
8. Errecalde CA, Prieto GF, Lüders CF, García Ovando H. 2005. Farmacocinética plasmática de danofloxacina en terneros. Rev Univ Nacional de Río Cuarto 25: 143-149. [ Links ]
9. Farrier D. 1999. PK Solution 2.0 Noncompartmental pharmacokinetics data analysis. Summit Research Services. Ashland, USA. [ Links ]
10. Giguère S, Dowling P. 2013. Fluoroquinolones. In: Giguère, J, Prescott JF, Dowling P (eds). Antimicrobial therapy in veterinary medicine. 5th ed. USA: John Wiley. p 295-314. [ Links ]
11. Grobbel M, Lübke-Becker A, Wieler LH, Froyman R, Friederichs S, Filios S. 2007. Comparative quantification of the in vitro activity of veterinary fluoroquinolones. Vet Microbiol 124: 7381. doi: 10.1016/j.vetmic.2007.03.017 [ Links ]
12. Karademir U, Boyacioglu M, Kum C, Sekkin S. 2015. Comparative pharmacokinetics of enrofloxacin, danofloxacin and marbofloxacin following intramuscular administration in sheep. Small Ruminant Res 133: 108-111. doi: 10.1016/ j.smallrumres.2015.09.007 [ Links ]
13. Lees P, Svendsen O, Wiuff C. 2008. Strategies to minimize the impact of antimicrobial treatment on the selection of resistant bacteria. In: Guardabassi L, Jensen L, Kruse H (eds). Guide to antimicrobial use in animals. UK: Blackwell Publishing. p 77-101. [ Links ]
14. Mann D, Frame G. 1992. Pharmacokinetics study of danofloxacin in cattle and swine. Am J Res 53: 1022-1026. [ Links ]
15. Nouws JMF, Ziv G. 1976. The effect of storage at 4 °C on antibiotic residues in kidney and meet tissues of dairy cows. Tijdschr Diergeneesk 101: 11411153. [ Links ]
16. McKellar Q, Gibson I, Mc Cormack R. 1998. Pharmacokinetics and tissue disposition of danofloxacin in sheep. Biopharm Drug Dispos 19: 123-129. doi: 10.1002/(SICI)1099-081X(199803) 19:2<123::AID-BDD89>3.0.CO;2-G [ Links ]
17. Papich MG, Riviere JE. 2009. Fluoroquinolone antimicrobial drugs. In: Giguère, J, Prescott JF, Dowling P (eds). Antimicrobial therapy in veterinary medicine. 5th ed. USA: John Wiley. p 983-1011. [ Links ]
18. Richez P, Pedersen Mörner A, De Jong A, Monlouis J. 1996. Plasma pharmacokinetics of parenterally administered danofloxacin and enrofloxacin in pigs. J Vet Pharm Ther 20: 41-42. [ Links ]
19. Sappal R, Chaudhary RK, Sandhu HS, Pritam Kaur Sidhu PK. 2009. Pharmacokinetics, urinary excretion and plasma protein binding of danofloxacin following intravenous administration in buffalo calves (Bubalus bubalis). Vet Res Commun 33: 659-667. doi: 10.1007/ s11259-009-9215-6 [ Links ]
20. Shem-Tov M, Ziv G, Glickman A, Saran A. 1997. Pharmacokinetic and penetration of danofloxacin from the blood into the milk of ewes. Vet Res 28: 571-579. doi: 10.1046/j.1365-2885.1998.00137.x [ Links ]
21. Shojaee Aliabadi F, Lees P. 2003. Pharmacokinetic-pharmacodynamic integration of danofloxacin in the calf. Res Vet Sci 74: 247-259. doi: 10.1016/ S0034-5288(03)00005-5 [ Links ]
Recibido: 13 de septiembre de 2017
Aceptado para publicación: 18 de enero de 2018