Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.29 no.3 Lima jul./set. 2018
http://dx.doi.org/10.15381/rivep.v29i3.14766
ARTÍCULOS PRIMARIOS
Comunidad fitoplanctónica de la cuenca del río Itaya en Loreto, Perú
Phytoplankton Community Of The Itaya River Basin In Loreto, Peru
Rosa Ismiño1,3, Grace Montalván2, Aurea García1, José Maco1, Salvador Tello1, Juan José Palacios1, Luciano Rodríguez1
1 Programa de Investigación para el Uso del Agua y sus Recursos (AQUAREC), Instituto de Investigaciones de la Amazonía Peruana (IIAP), Iquitos, Perú
2 Universidad Nacional Agraria La Molina, Lima, Perú
3 E-mail: rayo14@hotmail.com
RESUMEN
Se evaluó la comunidad fitoplanctónica en 21 muestras colectadas en siete lugares de la cuenca del río Itaya. Se identificaron 69 especies pertenecientes a 40 géneros, 20 familias y 6 divisiones. El grupo de mayor abundancia fue Bacillariophytas (51%), seguida de Chlorophytas (31%), Euglenophytas (11%), Cyanophytas (5%), y otros (2%) correspondientes a Xanthophyta y Chrysophyta. Las especies mejor representadas fueron Surirella ovalis, Navicula sp y Pinnularia sp. Para este ecosistema, se registró una densidadentre100a13 000ind/l-1 (individuosporlitro)deuntotalde24 500ind/l-1,con una riqueza de 11 a 27 especies y una abundancia de 23 a 55 individuos. El análisis de diversidad según Shannon-Wiener fue de 7.26 a 25 unidades de especies efectivas, con una equidad de Pielou de 0.84-0.97, lo que indica que las poblaciones fueron homogéneas. En lo que se refiere al índice de similaridad muestra que las comunidades fitoplanctónicas estaban formadas por tres grupos con una similaridad de 35%. Según el índice diatómico (IDG), se concluye que las aguas del río Itaya podrían estar contaminadas en los puntos de muestreo.
Palabras clave: fitoplancton; composición; diversidad; río Itaya; Amazonía peruana
ABSTRACT
The phytoplankton community was evaluated in 21 samples collected in seven sites in the Itaya river basin. In total, 69 species belonging to 40 genera, 20 families and 6 divisions were identified. The most abundant group was Bacillariophytas (51%), followed by Chlorophytas (31%), Euglenophytas (11%), Cyanophytas (5%), and others (2%) corresponding to Xanthophyta and Chrysophyta. The best represented species were Surirella ovalis, Navicula sp and Pinnularia sp. For this ecosystem, the density was between 100 to 13 000 ind/l-1 (individuals per litre) out of a total of 24 500 ind/l-1, with a richness of 11 to 27 species and an abundance of 23 to 55 individuals. The analysis of diversity according to Shannon-Wiener was from 7.26 to 25 units of effective species, with an equity of Pielou of 0.84-0.97, which indicates that the populations were homogeneous. Regarding the similarity index, it shows that the phytoplankton communities were formed by three groups with a similarity of 35%. According to the diatomic index (IDG), it is concluded that the water of the Itaya river could be contaminated at the sampling points.
Key words: phytoplankton; composition; diversity; Itaya river; Peruvian Amazon
INTRODUCCIÓN
En los sistemas fluviales de inundación, como el Amazonas, las microalgas constituyen el primer eslabón de la cadena trófica, considerados como proveedores de oxígeno en los ambientes acuáticos donde habitan (Acleto, 1986, 1998) y uno de los indicadores biológicos más importantes de la alteración del medio acuático (Loza, 1994). El fitoplancton es proveedor de proteínas, aceites, carbohidratos, vitaminas, minerales y otros alimentos a los diferentes componentes de la cadena trófica acuática, además de antibióticos, fungicidas, enzimas y otros componentes para la salud de los organismos acuáticos (Prieto et al., 2005).
La abundancia y distribución del fitoplancton proporciona información para evaluar la calidad de los cuerpos de agua y son la base de la distribución de los nutrientes que limita el proceso productivo primario con consecuencias para el resto de la cadena alimenticia. Son pocos los estudios de bioprospección fitoplanctónica en laAmazonía Peruana, destacando los de Núñez-Avellaneda et al. (2006), Cobos et al. (2012) e Ismiño et al. (2014).
En este estudio se presenta información sobre la composición y abundancia de la comunidad fitoplanctónica del río Itaya, como una contribución para el establecimiento de criterios de manejo de los recursos acuáticos existentes.
MATERIALES Y MÉTODOS
Área de Estudio
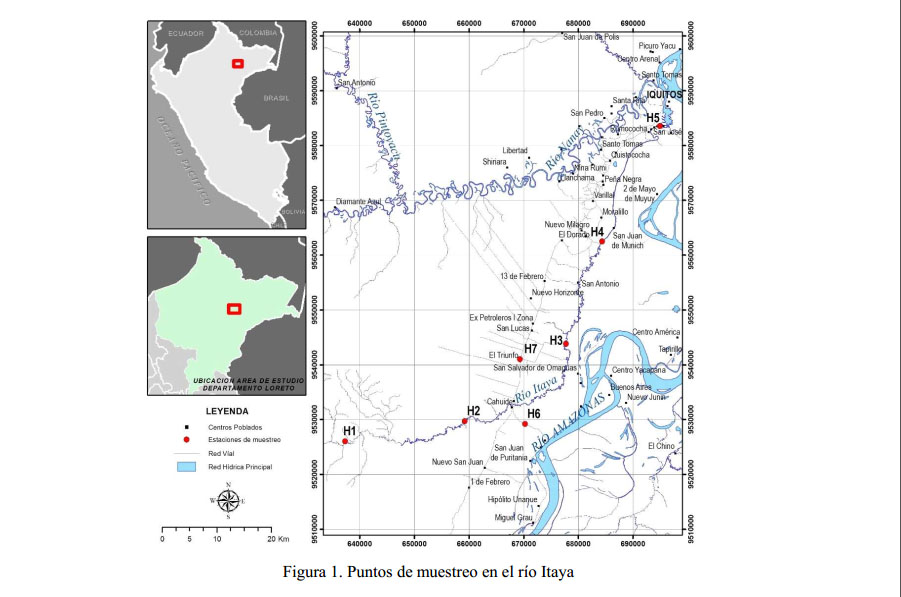
El río Itaya, afluente del río Amazonas, nace en el llano amazónico. En la naciente, el curso principal tiene una dirección de NOSE hasta unirse con la quebrada Nauta, con un recorrido de O-E hasta el caserío Nuevo San Martín, y a partir de allí se torna ligeramente de SO-NE hasta llegar a la desembocadura en el río Amazonas, a la altura de la ciudad de Iquitos. Tiene una longitud aproximada de 172 km, en su recorrido presenta sinuosidades y un ancho que varía de 21.8 m en la zona alta hasta 250 m en la desembocadura (IIAP-AECI-GORE LORETO, 2000).
En la mayor parte de su curso presenta meandros cerrados y pequeños que han dado origen a ambientes lénticos pequeños como cochas y tipishcas (lagunas) que se forman por el estrangulamiento de un meandro. El lecho lo conforman sedimentos finos como arena, arcilla y limo.
El estudio fue realizado en varios sectores del río Itaya: Villa Belén, 12 de Octubre, Unión, San Carlos, Belén, Nuevo San Juan y Triunfo, entre setiembre y octubre de 2011, coincidiendo con el periodo de aguas bajas ( Figura 1). Para el efecto, se establecieron siete estaciones de muestreo con las siguientes coordenadas: H1 (naciente del río Itaya X = 637406 Y= 9526039; H2 (12 de Octubre) X = 659298 Y= 9529757; H3 (Unión) X = 677793 Y= 9543846; H4 (San Carlos) X = 684430 Y= 9562514; H5 (Belén) X = 694980 Y= 9583602; H6 (Quebrada Sábalo) X = 670310 Y= 9529239; H7 (Quebrada Líndero) X = 669400 Y= 9541038.
Colecta de Muestras
Se tomaron tres muestras de agua en cada estación de muestreo (n=21) a una profundidad de 30 cm, filtrando 100 litros con una malla de 30 µm. Las muestras se fijaron en una solución de formol al 5%. En cada estación de muestreo se registró la temperatura del aire y del agua, pH, oxígeno disuelto, sólidos totales disueltos (TDS) y conductividad eléctrica, utilizando un multiparámetro YSY 550 con precisión de 0.1 ºC y 0.1 mg/l.
Identificación de Microalgas
Las muestras fueron homogenizadas para la cuantificación de fitoplancton. Luego se tomó una alícuota de 2 ml, que fue depositada en la cámara Neubauer y analizada mediante microscopio. La identificación de las algas fue a nivel de especie, utilizando diversas claves taxonómicas (Edmondson, 1959; Fernández, 1982; Bourrelly, 1968,1970, 1972; Prescott, 1982; Bicudo y Menezes, 2005).
Análisis Estadístico
Para el análisis estadístico se utilizó el método de múltiples variables que permite identificar posibles asociaciones entre datos ambientales, utilizando la media (m), la desviación estándar (S) y el coeficiente de variación de Pearson (CV). Asimismo, para evaluar la calidad del agua en cada punto de muestreo se utilizó el Índice Diatómico General (IDG) (Rivas et al., 2010), constituyéndose en indicadores de calidad a corto plazo.
RESULTADOS Y DISCUSIÓN
Características Físicas y Químicas del Agua
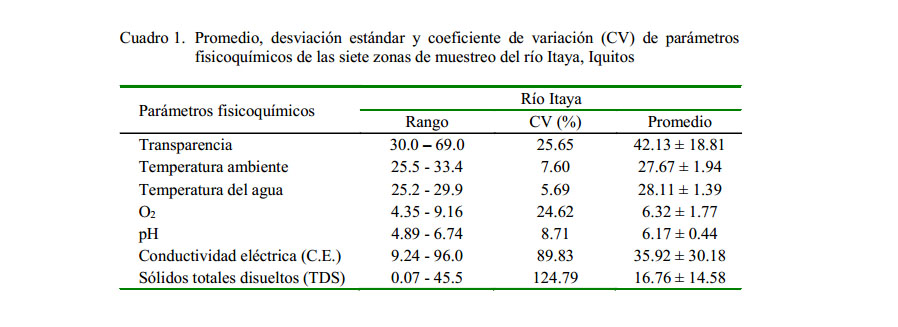
El río Itaya presenta características físicas y químicas típicas de un río de agua negra (Maco, 2006). Los valores de pH tienden a la acidez, variando entre 4.89 a 6.74. La conductividad eléctrica varió entre 9.24 a 96 µS/cm, considerándose como valores bajos y que son característicos de los cuerpos de agua que nacen en el llano amazónico, lo que hace que los ríos sean diferentes en cuanto a su mineralización (Núñez-Avellaneda y Duque, 2001), presentando los mayores valores en el sector bajo del río.
Los sólidos totales disueltos (TDS) variaron entre 0.07 y 45.5 mg/l, registrando valores más bajos en las partes altas del río, en tanto que los valores altos fueron registrados cerca de la desembocadura, frente a la ciudad de Iquitos. Los valores de oxígeno disuelto variaron de 4.35 a 9.16 mg/l, con tendencia a ser menores en el sector bajo del río. La temperatura del agua osciló entre 25.2 y 29.9 °C, en tanto que la temperatura ambiente varío entre 25.5 y 33.4 °C, donde las temperaturas más bajas fueron registradas en la cabecera del río y en algunos tributarios ( Cuadro 1).
Composición del Fitoplancton
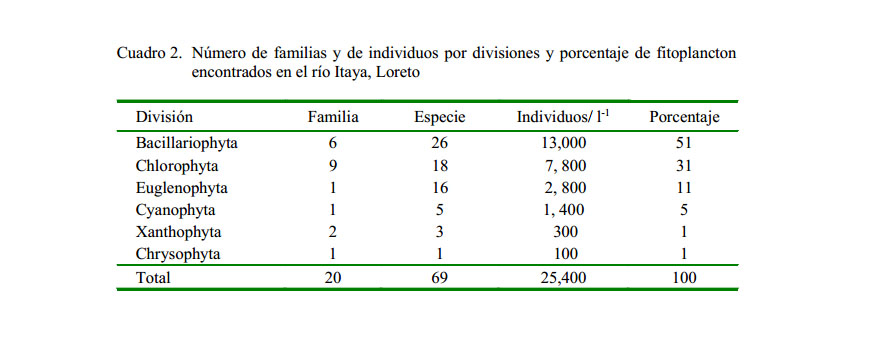
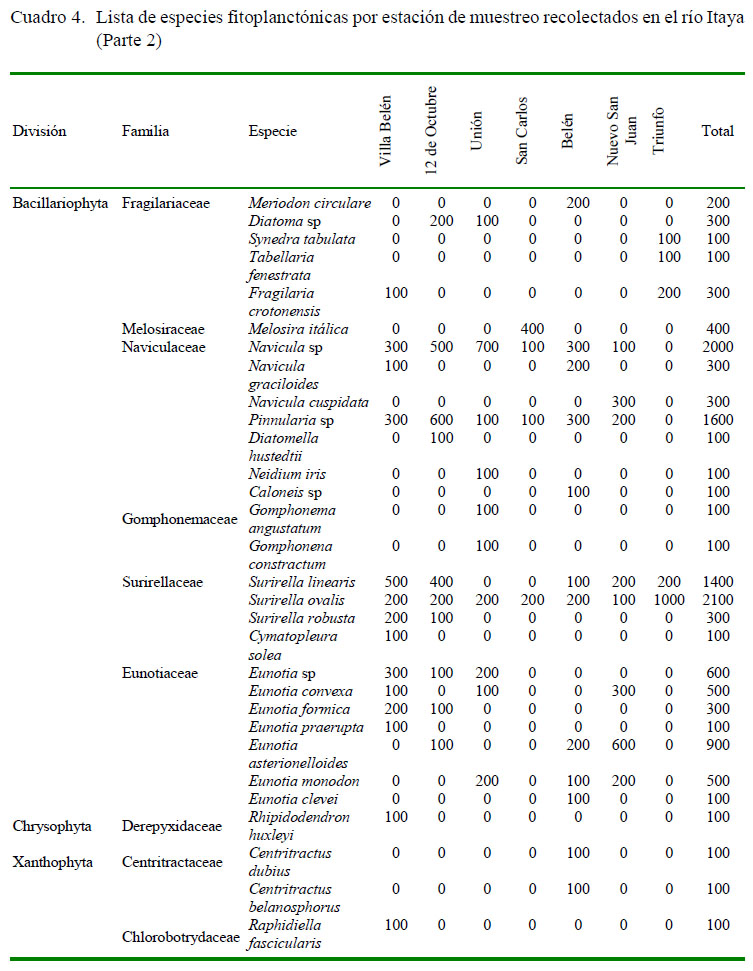
Se identificaron en total 69 especies de fitoplancton reunidas en 40 géneros, 20 familias y 6 divisiones en los diversos ambientes acuáticos del río Itaya. El número de especies de este grupo taxonómico reportado para el Perú varía de un río a otro. El número de especies identificadas en los ríos Arabela, Curaray y Napo, que nacen en las estribaciones de los Andes (Ismiño et al., 2014) fue similar a lo reportado en este estudio. Por otro lado, el río Putumayo reporta un total de 293 especies de fitoplancton (Núñez-Avellaneda et al., 2006), mientras que en el sector del bajo río Urubamba, que tiene su naciente en los Andes peruanos, se registró 170 especies (Ortega et al., 2010). Sin embargo, en cuerpos de aguas cercanas a las ciudades de Tarapoto (San Martín) y Yurimaguas (Loreto) solo se reportaron 74 especies (Navas, 2014), probablemente debido a que estos cuerpos de agua están fuertemente impactados por las actividades urbanas e industriales que vierten sus desechos a estos ríos y quebradas.
De las especies fitoplanctónicas identificadas, 26 pertenecen al grupo de las Bacillariophytas (51%), 18 a Chlorophytas (31%), 16 a Euglenophytas (11%), 5 a Cyanophytas (5%), y otros (2%) que pertenecen a Xanthophyta y Chrysophyta. En el primer grupo destacan Surirella ovalis (210 células/l), Navicula sp (200 cel/l) y Pinnularia sp (160 cel/l). Dentro de las Chlorophytas, las especies más representativas fueron Oedogonium sp (200 cel/l) y Cosmarium sp (120 cel/l). El grupo de las Bacillariophytas presentaron alta diversidad y fueron las que aportaron mayor densidad en todas las estaciones de muestreo. Las Chlorophytas fueron las más abundantes con nueve familias, en tanto que los otros grupos solo presentaron 1 o 2 familias, que es una característica propia de este ambiente.
En un trabajo realizado en el Itaya, pero en cuerpos lénticos (cochas), se reporta la presencia de Chlorofitas (100%), entre ellas Chlorella (Cobos et al., 2012), a diferencia de este estudio donde predominaron las Bacillariophytas (50%) en cuerpos lóticos (ríos).
El número total de individuos registrado fue de 25 400 cel/l, constituido principalmente por Bacillariophytas (13 000 cel/l), seguida de Chlorophytas (7800 cel/l), Euglenophytas (2800 cel/l), Cyanophytas (1400 cel/l) y otros como Xanthophyta y Chrysophyta, cuyos valores fueron distintos a los que encontraron López y Vela (2011) en la cocha Llanchama (río Nanay), alcanzando un promedio de 12 259 cel/l, constituido principalmente por Chlorophytas (Cuadro 2).
Las Bacillariophytas (Pinnularia sp y Surirella ovalis) fueron las algas con mayor representatividad durante el tiempo de estudio y estuvieron presentes en todas las estaciones de muestreo, en tanto que Surirella linearis y Navicula sp estuvieron presentes en 6 de las 7 zonas de muestreo. Las algas Bacillariophytas juegan un papel importante en los ambientes acuáticos donde se encuentran debido a que se distribuyen por toda la capa fótica y producen la mayor cantidad de materia orgánica, constituyendo los pilares fundamentales de los ecosistemas de agua dulce (Prado et al., 2010). El grupo en mención tiene la habilidad de responder rápidamente al cambio del medio por que su crecimiento depende de la incorporación directa de sustancias disueltas en el agua (nutrientes, sales, metales), de allí que pueden ser de gran utilidad como factores de referencia del medio en el que se encuentran (Toro et al., 2003). Ellas están presentes a lo largo del río y ecológicamente son mejor conocidas que otros grupos (Round et al., 1993).
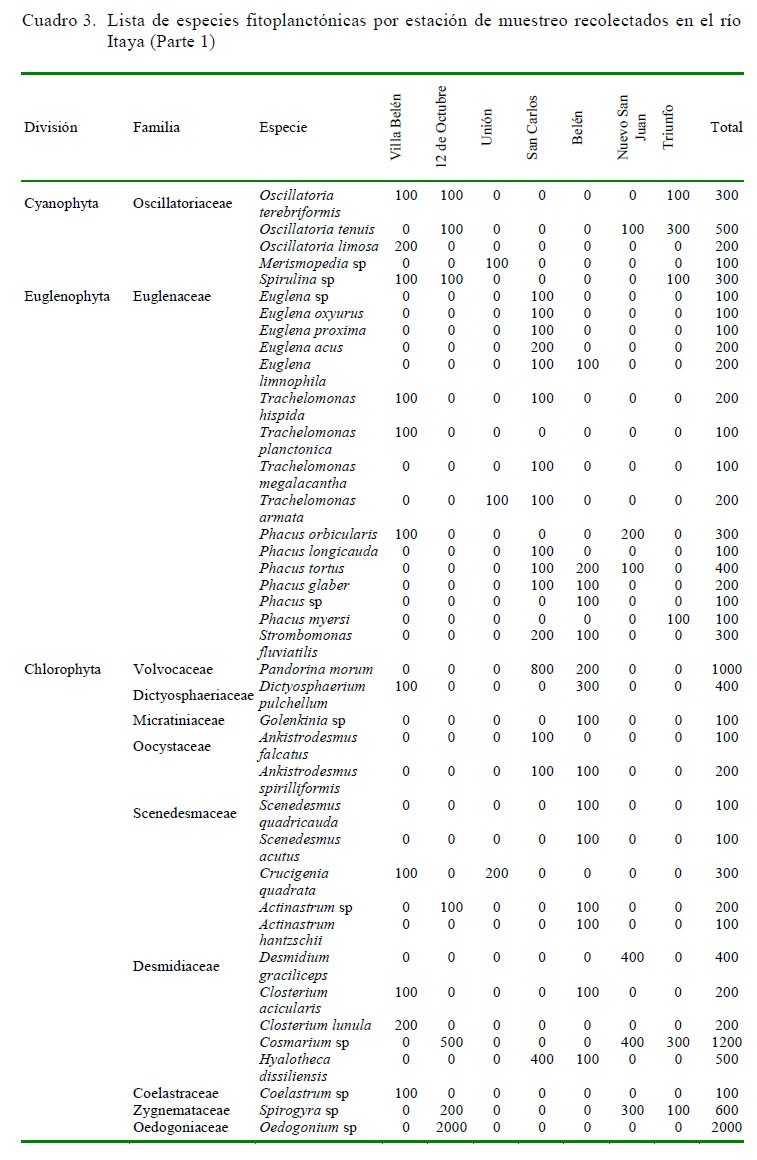
Otras divisiones de algas reportadas en este estudio estuvieron poco representadas, estando restringidas entre 1 y 3 zonas de muestreo, lo cual podría deberse al estrés por falta de nutrientes. Algunas especies de fitoplancton han desarrollado mecanismos estratégicos particulares que comprenden diferente tipo de adaptaciones (Reynolds, 2012) ( Cuadro 3 y Cuadro 4).
Las estaciones con mayor número de organismos fitoplanctonicos registrados fueron en 12 de octubre con 5500 cel/l y en Villa Belén con 4000 cel/l, ambos en la sección alta de río, probablemente por los aportes de nutrientes de acuerdo a las fluctuaciones en el nivel del río asociada con el periodo hidrológico (Ramírez-Gil yAjíaco-Martínez, 2001). Por otro lado, la estación con menor registro de individuos fue la Unión con 2300 cel/l ( Cuadro 5).
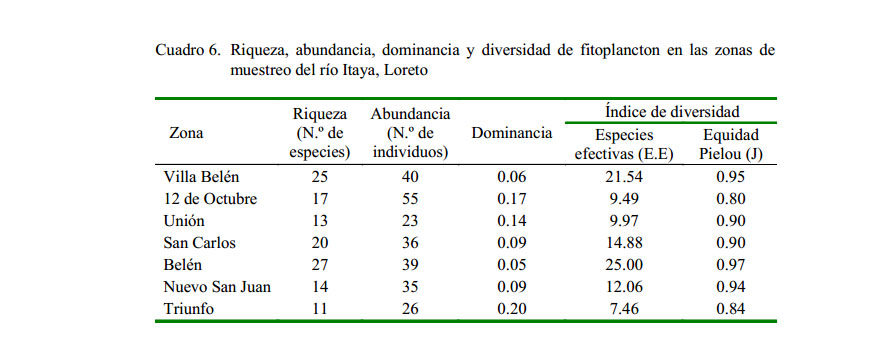
La diversidad de organismos fitoplanctónicos en los cuerpos de agua del río Itaya muestra una diversidad media según las especies efectivas. Esto puede deberse a que el muestreo realizado coincidió con la época de vaciante, lo cual influye en el volumen del transporte de sedimentos y la concentración de nutrientes en las estaciones de muestreo, trayendo como consecuencia un nivel aceptable de productividad primaria del fitoplancton. Los registros variaron entre 7.46 a 25 unidades (11 a 25 especies con mayor probabilidad de salir en los muestreos). La dominancia tuvo estimaciones entre 0.06 y 0.20 (de 0 a 20% de probabilidad de extraer dos individuos de la misma especie en un muestreo).
La estación de Belén fue la que presentó la mayor diversidad fitoplanctónica (Especies efectivas = 25), donde el índice de equidad de Pielou (J) mostró valores que variaron entre 0.80 y 0.95, el cual refleja una población bastante homogénea. En esta zona se observa mayor descarga doméstica y de sustancias orgánicas, lo que favorecen o sirven como abono para el crecimiento de las microalgas. Dicha zona tiene tendencia a la eutrofización. Sánchez (1996) encontró diversidades entre 12.18 y 54.6 especies efectivas (E.E.), ligeramente mayores al presente estudio. Así mismo, Peña y Pinilla (2002) reportó 33.1 y 200.3 E.E., datos relativamente más altos a lo encontrado en el estudio (Cuadro 6).
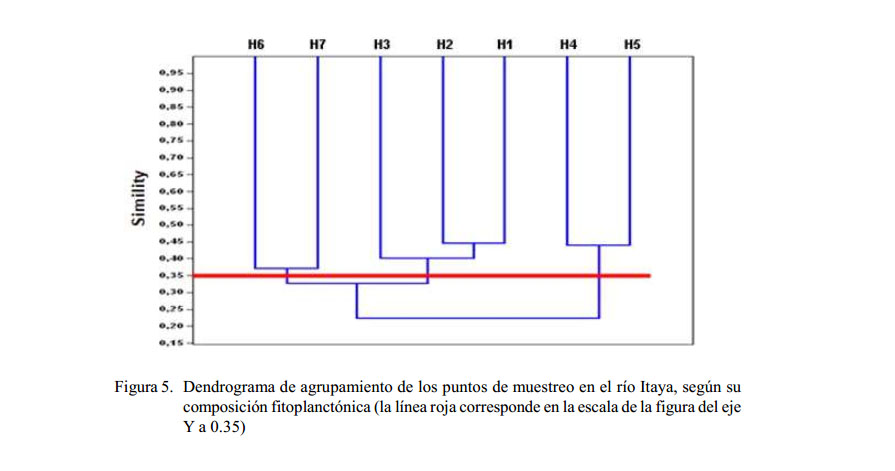
Las zonas de muestreo que tuvieron la mayor similitud de composición y estructura fitoplanctónica, según el índice cuantitativo de Morisita (0.45) y el índice de Bray Curtis (0.36) fueron los puntos H1 (Villa Belén) y H2 (12 de Octubre). En la Figura 5 se observan tres grupos con un 35% de similaridad, donde el primer grupo está conformado por las estaciones H6 y H7 (Nuevo San Juan y Triunfo), el segundo grupo por las estaciones H1, H2 Y H3 (Villa Belén , 12 de Octubre y Unión) y el tercer grupo conformado por las estaciones H4 y H5 (San Carlos y Belén).
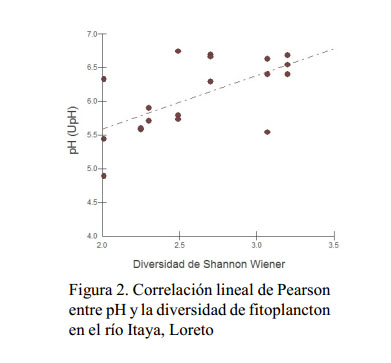
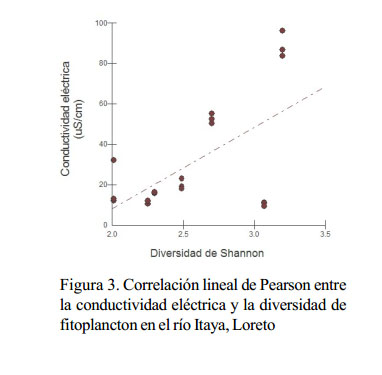
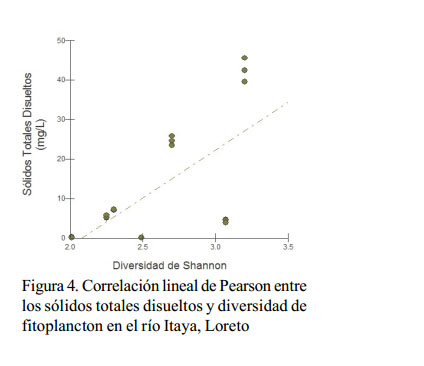
La diversidad fitoplanctónica presenta una relación positiva con el pH, conductividad y con los sólidos disueltos del agua donde la diversidad se incrementa a medida que estos factores aumentan (Figura 2, Figura 3 y Figura 4).
Estructura Comunitaria
El análisis de agrupamiento entre los puntos de muestreo del fitoplancton permitió diferenciar tres grupos de similaridad entre sí, cada uno formado por el periodo de vaciante en el cual se realizó el muestreo: el grupo I (H1, H2, H3) estuvo asociado a las muestras de la parte alta y media de la cuenca con valor promedio de diversidad de 2.54 y 18 especies; el grupo II estuvo conformado por H4 y H5, aglomeró las muestras de la media y baja donde se encuentra la desembocadura del río, y estuvo caracterizado por valores promedios de diversidad (2.95) y con 23 especies; el grupo III (H6 y H7), asociado a las estaciones de la cuenca, con pequeños tributarios que cruzan la carretera Iquitos-Nauta, exhibió valores promedios de diversidad (2.25) y 12 especies.
Los ambientes de las estaciones del río Itaya muestran fuertes variaciones temporales en sus características limnológicas como resultado de las fluctuaciones de los pulsos de inundación, produciendo notable influencia sobre la estructura y dinámica de las comunidades (Neiff, 1996; Junk, 1997). Los tres grupos del dendrograma permitieron diferenciar al 35% de similaridad (Figura 5).
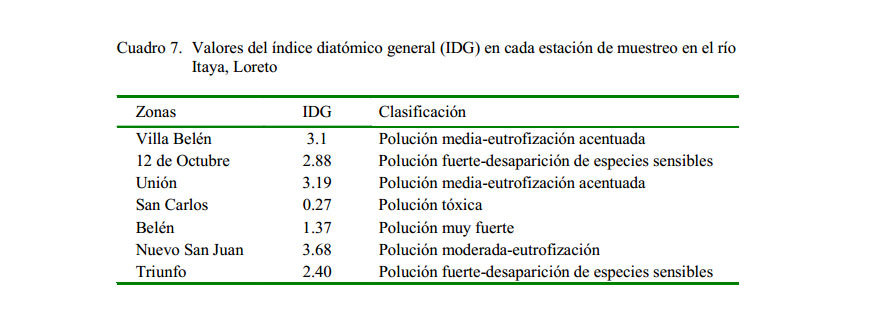
Para evaluar la calidad de las aguas de cada punto de muestreo se utilizó el Índice Diatómico General (IDG), tomando como principio que las diatomeas son organismos sensibles a la eutrofización y a la contaminación orgánica e inorgánica, reaccionando de forma rápida a las modificaciones de la calidad de agua; constituyéndose de esta manera en indicadores de calidad a corto plazo (Toro et al., 2003).
Según el IDG, todo el río Itaya está contaminado, aunque en diferente grado, manteniendo un rango de calidad entre polución media a polución fuerte, habiendo un punto de muestreo con polución tóxica (H4) con poblaciones por debajo de los 10 ind/mm2. Estos resultados muestran el estado trófico que podría ser natural o inducido por contaminación antropogénica. El crecimiento de la población ha llevado al aumento considerable de las necesidades del agua, de allí que los cuerpos de agua sufren contaminación debido principalmente al depósito de sedimentos por malas prácticas agrícolas y también de aguas servidas. La lluvia ácida, que aporta dióxido de azufre (SO2) y de nitrógeno (NO2) aumenta por el uso doméstico, agropecuario e industrial; sin embargo, cada día aumenta el deterioro de la calidad del agua. Entre las acciones humanas que modifican o afectan los sistemas acuáticos se encuentra la deforestación y la eliminación de residuos en los cursos de agua ( Cuadro 7).
LITERATURA CITADA
1. Acleto C. 1986. Algas marinas del Perú de importancia económica. Lima: Museo de Historia Natural, UNMSM. 107 p. [ Links ]
2. Acleto C. 1998. Introducción a las algas. Lima: Ed Escuela Nueva. 383 p. [ Links ]
3. Bicudo C, Menezes M. 2005. Gêneros de algas de águas continentais do Brasil chave para identificacão e descricões. Brasil: RIMA. 489 p. [ Links ]
4. Bourrelly P. 1968. Les algues d’eau douce. II. Les algues jaunes et brunes. Paris: N. Boubee et Cie. 438 p.
5. Bourrelly P. 1970. Les algues d’eau douce. III. Les algues blues et rouges. Paris: N. Boubee et Cie. 512 p.
6. Bourrelly P. 1972. Les algues d´ eau douce. I. Les algues vertes. Paris: N. Boubee et Cie. 572 p. [ Links ]
7. Cobos M, Castro J, Del Águila J, Soplín H. 2012. Identificación de microalgas oleaginosas en el área de concesión para conservación, cuenca alta del río Itaya. Loreto-Perú. Ciencia Amazónica 2(2): 162-168. [ Links ]
8. Edmondson WT. 1966. Fresh-water biology. 2nd ed. New York: Jhon Wiley & Sons. 1248 p. [ Links ]
9. Fernández H A, 1982. Guía para el estudio de las algas. Trujillo, Perú: Talleres gráficos IVP. 263 p. [ Links ]
10. Ismiño R, García A, Sánchez H, Chota W, Vargas G, Nolorbe C, Tello S, García-Dávila C. 2014. Comunidad fitoplanctónica en los ríos Curaray, Arabela y Napo (Amazonia peruana). FoliaAmazónica 23: 139-148. [ Links ]
11. Junk WJ. 1997. Structure and function of the large central Amazonian river floodplains synthesis and discussion. In: Junk WJ (ed). The central Amazon floodplain: ecology of a pulsing system. Berlin: Springer. p 445-472. [ Links ]
12. Loza AS. 1994. El nanofitoplancton de las bahías de Vita y Jururú, Cuba. Cienc Biol 27: 90-106. [ Links ]
13. Maco J. 2006. Tipos de ambientes acuáticos de la amazonia peruana. Folia Amazonica 15(1-2): 131-140. [ Links ]
14. Navas VM. 2014. Manual técnico. Loricáridos de importancia en la región de San Martín. Tarapoto, Perú: Estilos Gráficos. 50 p. [ Links ]
15. Neiff JJ. 1996. Large rivers of South America: toward the new approach Verh Internat Verein Limnol 26: 167-180. doi: 10.1080/03680770.1995.11900701 [ Links ]
16. Nuñez-Avellaneda M, Duque SR. 2001. Estudio del fitoplancton en ambientes acuáticos de laAmazonía colombiana. En: Echeverri J, Franky C, Zarate C (eds). Imani Mundo. Estudios del río Putumayo (Amazonía Colombo Peruana). Bogota, Colombia. Ed Uniblos. [ Links ]
17. Nuñez-Avellaneda M, Marin ZY, Alonso JC, Ríos E, Andrade-Sossa C, Freitas A, Gaya R. 2006. Los ambientes de pesca en la frontera Colombo-Peruana del río Putumayo. En: Agudelo E, Alonso JC, Moya LA (eds). Perspectivas de la pesca y la acuicultura en el área de integración fronterizo Colombo-Peruano de río Putumayo. Bogotá DC, Colombia: Ed Scripto. p 31-45. [ Links ]
18. Ortega H, Chocano L, Samanez I. 2010. Biota acuática en la Amazonia peruana: diversidad y usos como indicadores ambientales en el bajo Urubamba (Cuzco-Ucayali). Rev Peru Biol 17: 29-35. doi: 10.15381/rpb.v17i1.47 [ Links ]
19. Prado M, Bucheli R, Calderón G. 2010. Composición, distribución y abundancia del plancton en sistemas fluviales de la provincia de Los Ríos, Ecuador. Bol Cient Téc 20(6): 1-52. [ Links ]
20. Peña V, Pinilla G. 2002. Composición distribución y abundancia de la comunidad fitoplanctónica de la ensenada de Utría, Pacífico colombiano. Rev Biol Mar Oceanogr 37: 67-81. doi: 10.4067/S0718-19572002000100008 [ Links ]
21. Prescott GW.1982. Algae the western great lakes area (with an illustrated key to the genera of desmids and freshwater diatoms). USA: Lubrecht & Cramer.977p. [ Links ]
22. Prieto M, Mogollón M, Castro A, Sierra L. 2005. Efecto del medio y condiciones de cultivo en productividad de tres diatomeas marinas con potencial acuícola. MVZ-Cordoba 10(1): 544-554. doi: 10.21897/rmvz.476 [ Links ]
23. Ramírez-Gil H, Ajíaco-Martínez R. 2001. La pesca en la baja Orinoquia colombiana: una visión integral. Colombia: Instituto Nacional de Pesca y Acuicultura. 255 p. [ Links ]
24. Reynolds C. 2012. Environmental requirements and habitat preferences of phytoplankton: chance and certainty in species selection. Botánica Marina 55: 1-17. doi: 10.1515/bot.2011.121 [ Links ]
25. Rivas AW, Gómez RE, Monterrosa AJ. 2010. Consideraciones generales para el estudio y monitoreo de diatomeas en los principales ríos de el Salvador. Formulación de una guía metodológica estandarizada para determinar la calidad ambiental de las aguas de los ríos de El Salvador, utilizando insectos acuáticos. El Salvador: Ed Universitaria UES. 48 p. [ Links ]
26. Round FE, Crawford RM, Mann DG. 1993. The diatoms, biology and morfology of genera. UK: Cambrige University. 747 p. [ Links ]
27. Sánchez E. 1996. Caracterización especial del fitoplancton nerítico en el Pacífico. Tesis de Pregrado. Cali, Colombia: Universidad del Valle. 60 p. [ Links ]
28. Toro J, Schuster J, Kurosawa J, Araya E, Contreras M. 2003. Diagnóstico de la calidad de agua en sistemas lóticos utilizando diatomeas y macroinvertebrados bentónicos como indicadores del río Maipo (Santiago: Chile). XVI Congreso Chileno de Ingeniería Hidráulica. Chile. [ Links ]
Recibido: 6 de noviembre de 2017
Aceptado para publicación: 18 de mayo de 2018