Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.29 no.3 Lima jul./set. 2018
http://dx.doi.org/10.15381/rivep.v29i3.14771
ARTÍCULOS PRIMARIOS
Detección de parvovirus canino tipo 2 (CPV-2) mediante PCR en perros de Lima Metropolitana
Detection of canine parvovirus type 2 (CPV-2) by PCR in dogs from Lima, Peru
Raquel Quino Q.1, Rocío Rímac B.2, Luis Luna E.2, Lenin Maturrano H.1,3, Raúl Rosadio A.2
1 Laboratorio de Zootecnia y Producción Agropecuaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
2 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
3 E-mail: amaturranoh@unmsm.edu.pe / lenin.maturrano@gmail.com
RESUMEN
El objetivo del estudio fue la detección de parvovirus canino tipo 2 (CPV-2) en perros jóvenes de la ciudad de Lima con/sin sintomatología clínica compatible con parvovirosis mediante la técnica de PCR, usando cebadores que pueden permitir la amplificación de un fragmento del gen codificante de la proteína VP2. Se colectaron hisopados rectales de 78 perros menores a un año y sin historia de vacunaciones previas, de los cuales 39 individuos tuvieron un diagnóstico clínico de parvovirosis canina y los otros 39 fueron animales clínicamente sanos. Para la extracción de ADN viral se usó el método fast boiling, donde las muestras fueron sometidas a un hervido a 100 °C por 10 minutos con posterior centrifugación para extraer el sobrenadante, el cual fue usado como molde para la reacción de PCR. Se usaron cebadores específicos que amplifican un fragmento de 1316 pares de bases del gen VP2 del virus CPV-2, utilizando como control positivo una vacuna comercial. El virus fue detectado en el 62% de animales con diagnóstico clínico de la enfermedad con PCR convencional, no siendo detectado en perros clínicamente sanos. La no detección de CPV-2 en animales con diagnóstico clínico compatibles a parvovirosis en el 38% de los casos indicaría la presencia de otro agente etiológico como causante del cuadro sintomatológico, recomendándose el uso de técnicas complementarias para el correcto diagnóstico de la enfermedad.
Palabras clave: parvovirus canino; hisopados rectales; diagnóstico clínico; PCR
ABSTRACT
The objective of the study was the detection of canine parvovirus type 2 (CPV-2) in young dogs of Lima city with and without clinical symptoms compatible with parvovirus by the PCR technique using primers that can allow the amplification of a fragment of the gene coding for the protein VP2. Rectal swabs were collected from 78 dogs younger than one year old and without a history of previous vaccinations, of which 39 individuals had a clinical diagnosis of canine parvovirus and the other 39 were clinically healthy animals. For the extraction of viral DNA, the fast boiling method was used. Samples were boiled at 100 °C for 10 minutes and then centrifuged to extract the supernatant, which was used as a template for the PCR reaction. Specific primers that amplify a 1316 base pair fragment of the VP2 gene of the CPV-2 virus were used, using a commercial vaccine as a positive control. The virus was detected in 62% of animals with clinical diagnosis of the disease with conventional PCR, not being detected in clinically healthy dogs. The non-detection of CPV-2 in animals with a clinical diagnosis compatible with parvovirus in 38% of cases would indicate the presence of another etiological agent as the cause of the clinical signs, and therefore, recommending the use of complementary techniques for the correct diagnosis of the disease.
Key words: canine parvovirus; rectal swabs; clinic diagnosis; PCR
INTRODUCCIÓN
El virus del parvovirus canino (CPV) pertenece al género Protoparvovirus, familia Parvoviridae y subfamilia Parvovirinae (Cotmore et al., 2014). Es un virus de cadena simple y polaridad negativa (ss ADN), teniendo un genoma de 5.2 kb de tamaño (Nandi y Kumar, 2010; Maya et al., 2012). Actualmente se sabe que existen dos tipos de parvovirus canino, CVP-1 y CPV-2; asimismo, se debe tener en cuenta que de este último derivan otras tres variantes: CPV-2a, CPV-2b y CPV-2c, debido a una variación en el aminoácido de la posición 426 de la proteína VP-2 (Buonavoglia et al., 2001; Pérez et al., 2014; Chiang et al., 2016).
La importancia de los virus que pertenecen al género Protoparvovirus radica en la alta mortalidad en animales, siendo la especie Carnivore protoparvovirus 1, el que incluye al CPV-1, CPV-2 y el virus de la panleucopenia felina que afecta a perros y gatos, y la especie Ungulate parvovirus 1 que incluye al parvovirus del porcino, conocido por el alto índice de mortalidad y repercusión económica en la industria porcina (Parker y Parris, 1997; Cotmore et al., 2014). Por otro lado, el CPV-2 es uno de los principales agentes involucrados en la enteritis hemorrágica en crías de perros, provocando una elevada tasa de mortalidad (Maya et al., 2012).
La parvovirosis canina es una enfermedad que surge en los años 70, siendo reconocida por primera vez en 1978 (Pérez et al., 2012). Es causada por el parvovirus canino tipo 2 (CPV-2) y transmitida vía fecal-oral o mediante fomites, donde las heces de los animales infectados poseen gran cantidad de partículas virales. El virus tiende a mantenerse por largos periodos de tiempo en las superficies y el ambiente y es altamente resistente a temperaturas ambientales, debido a la ausencia de envoltura (Hurtado, 2012), de allí que la enfermedad se presenta con mayor frecuencia en meses cálidos (Ernst et al., 1992). Las razas Rottweiler, Doberman, Pitbull y Pastor Alemán son consideradas como las más susceptibles a adquirir la infección, pero afecta principalmente a todos los perros menores de un año, siendo factores de riesgo para la presentación de la enfermedad una alta carga de parásitos y falla en la transferencia de anticuerpos vía calostro o en la etapa del destete (Hurtado, 2012; Dubina, 2013). Los principales signos clínicos son vómitos y diarreas hemorrágicas con la consecuente deshidratación, shock y muerte (Desario et al., 2005; Aldaz et al., 2013).
Esta enfermedad y las variantes antigénicas del CPV-2 se han extendido en América del Sur y en el mundo (Zhao et al., 2013). Países como Estados Unidos, Vietnam, Italia, España, Uruguay, Chile,Argentina, Brasil, Cuba y Ecuador han determinado no solo la presencia de la enfermedad en su respectiva zona, sino también las variantes antigénicas del virus (Pérez et al., 2007; Nakamura et al., 2004; Aldaz et al., 2013; Fontana et al., 2013; Gallo et al., 2015).
No existe información respecto a la prevalencia de infección, frecuencia de presentación de animales con signos clínicos ni del comportamiento del virus en el Perú; sin embargo, se reconoce que la enfermedad está presente (Gamboa, 1980). La existencia de técnicas rápidas y altamente sensibles de detección, como la Reacción en Cadena de la Polimerasa (PCR) permitiría establecer un diagnóstico situacional del virus en nuestro medio. El objetivo del presente estudio fue la detección del virus mediante la técnica de PCR en perros con sintomatología clínica compatible con parvovirosis y perros clínicamente sanos.
MATERIALES Y MÉTODOS
Muestras
Se obtuvieron 78 muestras de hisopados rectales de perros (Canis lupus familiaris) menores de un año y que no habían sido vacunados. Un grupo estuvo compuesto por canes con diagnóstico clínico compatible con parvovirosis canina, y el otro grupo por animales clínicamente sanos. Todas las muestras fueron tomadas en la Clínica de Animales Menores de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos (UNMSM) y en clínicas veterinarias privadas ubicadas en los distritos de Villa el Salvador, Carabayllo, Surco y Chorrillos (Lima). En la historia clínica de los animales enfermos se describieron signos como fiebre, vómitos y diarreas hemorrágicas.
Diseño Experimental
El número de muestras fue estimado mediante la fórmula de tamaño muestral para una proporción, considerando una proporción de 72% de presentación de la infección en caninos clínicamente enfermos (Sosa, 2009) y un error de 10%. Así, la fórmula n = (1.962x0.72x0.28)/0.12 indicó una población a muestrear de 78 perros. Asimismo, se calcularon los valores predictivos positivos y negativos para evaluar el diagnóstico clínico frente al diagnóstico molecular. Esto con el fin de determinar el porcentaje de animales que son considerados clínicamente infectados por parvovirus, pero negativos a la PCR.
Extracción de ADN Viral
Para la extracción de ADN viral de los hisopados rectales se utilizó una modificación del método fast boiling descrito por Schunk et al. (1995). Las muestras fueron homogeneizadas y hervidas a 100 °C con 500 µl de PBS estéril durante 10 minutos y centrifugadas a 1000 g por 15 minutos para extraer el sobrenadante.
PCR Convencional
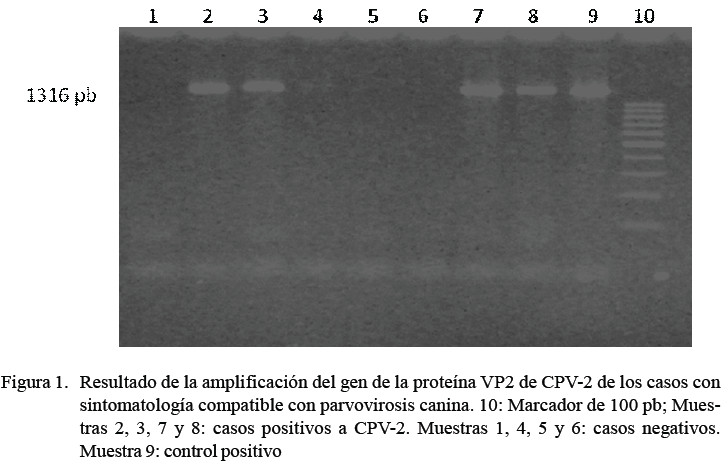
Se usaron cebadores descritos por Ikeda et al. (2000) que amplifican un fragmento de 1316 pb del gen de la proteína VP2 del CPV2 (Cuadro 1). La mezcla de reacción de PCR siguió las siguientes condiciones: Buffer PCR 1X, 0.4 mM de dNTPs, 1 mM de cebador F1, 1 mM de cebador R3, 2 mM de MgCl2 y 1 U de Taq DNA polimerasa (Taq DNA polymerase, Thermo Scientific). La amplificación se llevó a cabo en un termociclador AB 2700 (Applied Biosystems), a una desnaturalización inicial de 95 °C durante 5 min, seguido de 30 ciclos de desnaturalización (95 °C durante 1 min), hibridación (42 °C durante 1.45 min) y extensión (72 °C durante 1.45 min), con una extensión final a 72 °C durante 7 min. Los productos amplificados fueron sometidos a electroforesis en geles de agarosa al 1% y usando bromuro de etidio como colorante revelador. Como control positivo se tomó como referencia la vacuna comercial Vanguard® Plus CPV (Pfizer), que usa la cepa NL-35-D (CPV-2a), la cual fue sometida al mismo protocolo de extracción de ADN (Sosa, 2009; Pérez et al., 2012).
RESULTADOS
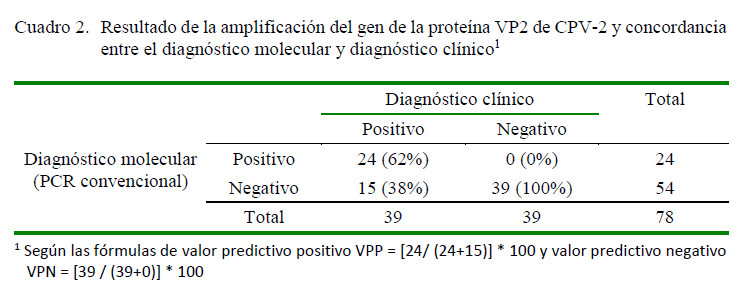
Se obtuvo 62% (24/39) de positivos a CPV-2 por PCR convencional en el grupo de animales clínicamente enfermos, generando un amplicón de 1316 pb (Figura 1), no hallándose positivos en el segundo grupo (Cuadro 2).
En comparación con la técnica de PCR para el diagnóstico de la infección por CPV2 ,el cálculo de los valores predictivos para el diagnóstico clínico, considerando los datos del Cuadro 2 fueron los siguientes: valor predictivo positivo: 62% y valor predictivo negativo: 100%. Esto indica que el 62% de individuos son diagnosticados clínicamente como parvovirosis y positivos a la infección por PCR, y el restante 38% son considerados clínicamente infectados por parvovirus, pero negativos a la prueba de PCR.
DISCUSIÓN
La parvovirosis canina es una enfermedad causada por el virus del parvovirus canino, el cual se caracteriza por presentar principalmente un cuadro gastroentérico en cachorros, pudiendo llegar a causar la muerte (Duque et al., 2017).Actualmente, en las clínicas veterinarias es usual el diagnóstico de la enfermedad en base a los signos clínicos y condiciones de animal; sin embargo, este diagnóstico no es definitivo para su determinación (Puentes et al., 2012).
El PCR es una técnica altamente sensible para la detección del virus, debido a que requiere poca cantidad de ADN para lograr la amplificación (Lorenz, 2012). Asimismo, se ha comprobado que mientras se trabaje con una adecuada cantidad de material fecal, el método de ebullición rápida muestra buenos resultados, y de esta manera se puede disminuir los costos y el tiempo empleado en el procedimiento (Schunk et al., 1995; Peng et al., 2013).
Los resultados del grupo de 39 animales clínicamente enfermos difieren de los resultados descritos por Gamboa (1980), quién encontró 93.5% (29/31) de positividad en este tipo de perros, diferencia que pudo deberse al aumento de la frecuencia de enfermedades con signos clínicos similares a la parvovirosis.Asimismo,Sosa (2009)reporta 72% de positividad al virus en animales clínicamente compatibles en un estudio de detección de CPV-2 por medio de PCR convencional realizado en Uruguay. Es importante resaltar que esta enfermedad no posee signos patognomónicos que la diferencie de enfermedades similares, ya que es fácilmente confundible con enfermedades bacterianas, virales o parasitarias. Por otro lado, las variaciones en estas proporciones están sujetas al diagnóstico clínico subjetivo del médico veterinario encargado del caso.
Para el grupo de perros clínicamente sanos, Gamboa (1980) encontró 65% (13/20) de positividad mediante la prueba de hemaglutinación indirecta, mientras que en este estudio no se encontraron perros positivos. Estos resultados podrían deberse al mejor estado sanitario de las mascotas en comparación al año de muestreo del estudio previo. Asimismo, en el estudio de Gamboa se detectó el anticuerpo (Ac) para el virus, lo cual sugiere que la simple exposición del animal frente al agente puede producir anticuerpos frente al virus, sin presentar la enfermedad, lo que explicaría la cantidad de positivos en su prueba.
Los valores predictivo positivo y negativo de 62 y 100%, respectivamente, sugieren que de cada 100 perros con diagnóstico clínico a parvovirosis canina, solo 62 serán positivos a PCR convencional. Estos resultados alertan que 39 animales serían tratados bajo los mismos protocolos y cuidados que si estuvieran con la enfermedad sin estarlo realmente, repercutiendo en el pronóstico y la recuperación del paciente. Es así que, sería altamente recomendable el uso de una técnica complementaria al diagnóstico clínico dado por el médico tratante. Por otro lado, es importante resaltar la presencia de una nueva variante en el país donde la protección de las vacunas comerciales no sería eficaz (Oshima et al., 2008).
CONCLUSIÓN
Se puede lograr la amplificación de un fragmento de 1316 pb del gen de la proteína VP2 de la CPV-2 a partir de hisopados rectales en el 61% (24/39) de las cepas positivas a parvovirus por diagnóstico clínico mediante el protocolo de extracción y de PCR presentado en este trabajo.
Agradecimientos
Se agradece a los doctores Efraín González, Tito Gonzáles y Jhon Acuña que permitieron la colección de muestras en sus respectivas clínicas. Asimismo, se agradece la colaboración especial al Dr. Rubén Pérez de la Universidad de la República de Uruguay por su constante apoyo.
LITERATURA CITADA
1. Aldaz J, García J, Calleros L, Sosa K, Iraola G, Marandino A, Hernández M, Panzera Y, Pérez R. 2013. High local genetic diversity of canine from Ecuador. Vet Microbiol 166: 214-219. doi: 10.1016/j.vetmic.2013.06.012 [ Links ]
2. Buonavoglia C, Martella V, Pratelli A, Tempesta M, Cavalli A, Buonavoglia D, Bozzo G, et al. 2001. Evidence for evolution of canine parvovirus type 2 in Italy. J Gen Virol 82: 3021-3025. doi: 10.1099/0022-1317-82-12-3021 [ Links ]
3. Chiang S, Wu H, Chiou M, Chang M, Lin C. 2016. Identification of a novel canine parvovirus type 2c in Taiwan. Virol J 13: 160. doi: 10.1186/s12985-0160620-5 [ Links ]
4. Cotmore S, Agbanje M, Chiorini J, Mukha D, Pintel D, Qiu J, Soderlund M, et al. 2014. The family Parvoviridae. Arch Virol 159: 1239-1247. doi: 10.1007/s00705-013-1914-1 [ Links ]
5. Desario C, Decaro N, Campolo M, Cavalli A, Cirone F, Elia G, Martella V, et al. 2005. Canine parvovirus infection: which diagnostic test for virus? J Virol Methods 126: 179-185. doi: 10.1016/j.jviromet.2005.02.006 [ Links ]
6. Dubina L. 2013. Deteccâo e caracterizacâo de parvovirus canino e coronavirus canino. Tesis Doctoral. Porto Alegre: Univ. Federal de Rio Grande do Sul. 74 p. [ Links ]
7. Duque Y, Echeverri M, Trejos J, Ruiz J. 2017. Prevalence and molecular epidemiology of canine parvovirus 2 in diarrheic dogs in Colombia, South America: a possible new CPV-2a is emerging? Vet Microbiol 201: 56-61. doi: 10.1016/j.vetmic.2016.12.039 [ Links ]
8. Ernst S, Martin R, Thibaut J. 1992. Distribución temporal de la parvovirosis clínica en una población canina hospitalaria de Valdivia, Chile (1981-1990): distribución temporal y determinantes climáticos. Avances Cienc Vet 2: 99-104. doi: 10.5354/0719-5273.2010.4488 [ Links ]
9. Fontana D, Rocha P, Cruz R, López L, Melo A, Silveira M, Aguiar D, Pescador. 2013. A phylogenetic study of canine parvovirus type 2c in midwestern Brazil. Pes Vet Bras. 33: 214-218. doi: 10.1590/S0100-736X2013000200013 [ Links ]
10. Gallo C, Romanutti C, Wilda M, D’Antuono A, Keller L, Bucci, M, Giacomodonato M, et al. 2015. Evolución del parvovirus canino: la cepa 2c continúa siendo prevalente en la población canina de Argentina. En: II Congreso Latinoamericano de Virología. Argentina: Sociedad Argentina de Virología.
11. Gamboa N. 1980. Comprobación serológica de la gastroenteritis hemorrágica aguda canina por parvovirus en el área de Lima. Tesis de Médico Veterinario. Lima: Univ. Nacional Mayor de San Marcos. 41 p. [ Links ]
12. Hurtado D. 2012. Nueva perspectiva de la parvovirosis canina en el sur del valle de Aburra. Tesis de Médico Veterinario. Antioquía: Corporación Universitaria Lasallista. 51 p. [ Links ]
13. Ikeda Y, Mochizuki M, Naito R, Nakamura K, Miyazawa T, Mikami T, Takahashi T. 2000. Predominance of canine parvovirus (CPV) in unvaccinated cat populations and emergence of new antigenic types of CPVs in cats. Virology 278: 13-19. doi: 10.1006/viro.2000.0653 [ Links ]
14. Lorenz T. 2012. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis Exp 63: e3998. doi: 10.3791/3998 [ Links ]
15. Maya L, Calleros L, Francia L, Hernández M, Iraola G, Panzera Y, Sosa K, Pérez R. 2012. Phylodynamic analysis of canine parvovirus in Uruguay: evidence of two successive invasions by different variants.Arch Virol 158: 11331141. doi: 10.1007/s00705-012-1591-5 [ Links ]
16. Nakamura M, Tohya Y, Miyazawa T, Mochizuki M, Phung H, Nguyen N, Huynh L, et al. 2004. A novel antigenic variant of canine parvovirus from a Vietnamese dog. Arch Virol 149: 22612269. doi: 10.1007/s00705-004-0367-y [ Links ]
17. Nandi S, Kumar M. 2010. Canine parvovirus: current perspective. Indian J Virol 21: 31-44. doi: 10.1007/s13337010-0007-y [ Links ]
18. Oshima T, Hisaka M, Kawakami K, Kishi M, Tohya Y, Mochizuki M. 2008. Chronological analysis of canine parvovirus type 2 isolates in Japan. J Vet Med Sci 70: 769-775. doi: http://doi.org/10.1292/jvms.70.769. [ Links ]
19. Parker J, Parrish C. 1997. Canine parvovirus host range is determined by the specific conformation of an additional region of the capsid. J Virol 71: 92149222. [ Links ]
20. Peng X, Yu K, Deng G, Jiang Y, Wang Y, Zhang G, Zhou H. 2013. Comparison of direct boiling method with commercial kits for extracting fecal microbiome DNA by Illumina sequencing of 16S rRNS tags. J Microbiol Methods 95: 455-462. doi: 10.1016/j.mimet.2013.07.015 [ Links ]
21. Pérez R, Francia L, Romero V, Maya L, Lopez I, Hernández M. 2007. First detection of canine parvovirus type 2c in South America. Vet Microbiol 124: 147-152. doi: 10.1016/j.vetmic.2007.04.028 [ Links ]
22. Pérez R, Bianchi P, Calleros L, Francia L, Hernández M, Maya L, Panzera Y, et al. 2012. Recent spreading of a divergent canine parvovirus type 2a (CPV-2a) strain in a CPV-2c homogenous population. Vet Microbiol 155: 214-219. doi: https:// doi.org/10.1016/j.vetmic.2011.09.017 [ Links ]
23. Pérez R, Calleros L, Marandino A, Sarute N, Iraola G, Grecco S, Blanc H, et al. 2014. Phylogenetic and genome-wide deep-sequencing analyses of canine parvovirus reveal co-infection with field variants and emergence of a recent recombinant strain. Plos One 9: e111779. doi: https://doi.org/10.1371/journal.pone.0111779 [ Links ]
24. Puentes R, Eliopulos N, Pérez R, Franco G, Sosa K, Biachi P, Furtado A, et al. 2012. Isolation and characterization of canine parvovirus type 2c (CPV-2c) from symptomatic puppies. Braz J Microbiol 43: 1005-1009. doi: 10.1590/S151783822012000-3000022 [ Links ]
25. Schunck B, Kraft W, Truyen U. 1995. A simple touch-down polymerase chain reaction for the detection of canine parvovirus and feline panleukopenia virus in feces. J Virol Methods 55: 427-433. doi:10.1016/0166-0934(95)00069-3 [ Links ]
26. Sosa K. 2009. Estudio de la diversidad del parvovirus canino tipo 2 (CPV-2) mediante el análisis de repetidos en el genoma viral. Tesis de Biólogo. Montevideo: Univ. de la República. 51 p. [ Links ]
27. Zhao Y, Lin Z, Lu C, Zeng X, Hou J. 2013. Genotyping and pathobiologic characterization of canine parvovirus circulating in Nanjing, China. Virol J 10: 272. doi: 10.1186/1743-422X-10-272 [ Links ]
Recibido: 15 de noviembre de 2017
Aceptado para publicación: 19 de mayo de 2018