Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Investigaciones Veterinarias del Perú
Print version ISSN 1609-9117
Rev. investig. vet. Perú vol.30 no.1 Lima Jan./Mar. 2019
http://dx.doi.org/10.15381/rivep.v30i1.15680
ARTÍCULOS PRIMARIOS
Efecto de las lipoproteínas de baja densidad y la trehalosa sobre la actividad enzimática antioxidante del semen bovino criopreservado
Effect of low-density lipoproteins and trehalose on antioxidant enzymatic activity of cryopreserved bovine semen
Elizabeth Varela G.1,4, Benjamín A. Rojano2, Giovanni Restrepo B.3
1 Politécnico Colombiano Jaime Isaza Cadavid, Antioquia, Colombia
2 Facultad de Ciencias, Universidad Nacional de Colombia, sede Medellín, Antioquia, Colombia
3 Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia, sede Medellín, Antioquia, Colombia
4 E-mail: elvarelagi@unal.edu.co
RESUMEN
El objetivo de este estudio fue evaluar la capacidad antioxidante enzimática del semen bovino criopreservado con diferentes fuentes de lipoproteínas de baja densidad (LDL) y trehalosa (T). Diez eyaculados seleccionados a partir de cinco toros fueron criopreservados bajo los tratamientos: LDL (8% m/v), T (100 mM), TLDL (T 100 mM y LDL 8% m/v), yema de huevo centrifugada (YHC, 20% v/v) y yema de huevo (YH, 20% v/v) como tratamiento control. Se evaluó la capacidad enzimática antioxidante de la catalasa (CAT), la superóxido dismutasa (SOD) y la glutatión peroxidasa (GPx) del semen bovino luego de la descongelación por espectrofotometría y su relación con los parámetros cinéticos espermáticos. Se utilizó un modelo completamente al azar. La normalidad de las variables se validó mediante la prueba de Kolmogorov-Smirnov. Las fuentes de variación se evaluaron a través de un modelo mixto. La comparación de las medias entre los tratamientos se llevó a cabo utilizando la prueba de Tukey. Los tratamientos YH, YHC y LDL aumentaron la actividad antioxidante de CAT y GPx y se correlacionaron positivamente con los parámetros cinéticos y la integridad de la membrana espermática (p<0.05). No se encontraron diferencias entre LDL y TLDL con respecto a la actividad de CAT y GPx. La actividad enzimática de SOD fue similar en todos los tratamientos en comparación con el control (YH). T no mejoró la actividad antioxidante de las enzimas utilizadas. Se concluye que los diluyentes con YH, YHC y LDL mejoran la actividad antioxidante de CAT y GPx, generando una correlación positiva con la calidad seminal.
Palabras clave: antioxidantes; criopreservación del semen; estrés oxidativo
ABSTRACT
The aim of this study was to evaluate the enzymatic antioxidant capacity of cryopreserved bovine semen with different sources of low-density lipoproteins (LDL) and trehalose (T). Ten ejaculates selected from five bulls were cryopreserved under the treatments: LDL (8% m/v), T (100 mM), TLDL (100 mM T and 8% m/v LDL), centrifuged egg yolk (CEY, 20% v/v) and egg yolk (EY, 20% v/v) as control treatment. After the semen thawing process, the antioxidant enzymatic capacity of catalase (CAT), superoxide dismutase (SOD) and glutathione peroxidase (GPx) of bovine semen were evaluated by spectrophotometry plus its relationship with spermatic kinetic parameters. A completely random model was used. The normality of the variables was validated by the KolmogorovSmirnov test. The sources of variation were evaluated through a mixed model. The comparison of the adjusted means between the treatments was carried out using the Tukey test. EY, CEY and LDL treatments increased the antioxidant activity of CAT and GPx and correlated positively with the kinetic parameters and the integrity of the sperm membrane (p<0.05). No differences were found between LDL and TLDL with respect to the activity of CAT and GPx. The enzymatic activity of SOD was similar in all treatments compared to the control (EY). T did not improve the antioxidant activity of the enzymes used. It is concluded that the diluents with EY, CEY and LDL improve the antioxidant activity of CAT and GPx, generating a positive correlation with the seminal quality.
Key words: antioxidants; cryopreservation of semen; oxidative stress
INTRODUCCIÓN
La criopreservación de los espermatozoides bovinos es una herramienta utilizada en la biotecnología reproductiva para difundir el germoplasma de animales genéticamente valiosos (Anzar y Graham, 1995). Este procedimiento genera diferentes tipos de estrés en los espermatozoides, entre ellos el estrés oxidativo, el cual es ocasionado por la excesiva producción de especies reactivas de oxígeno (ERO) (Chen et al., 2015), que disminuyen el perfil de las enzimas antioxidantes (Bilodeau et al., 2000), debido a la alta susceptibilidad de los espermatozoides (Andrabi, 2009), a pesar de que cuentan con sistemas de defensa antioxidante enzimático.
El sistema de defensa antioxidante enzimático está compuesto por la superóxido dismutasa (SOD), la catalasa (CAT), la glutatión peroxidasa (GPx) y la reductasa, las cuales son importantes para mantener la viabilidad, la integridad de la membrana plasmática y acrosomal, la movilidad y elADN de los espermatozoides bovinos (Hu et al., 2010; Asadpour et al., 2012; Lecewicz et al., 2017; Lone et al., 2018). Las consecuencias del estrés oxidativo se pueden disminuir suplementando los diluyentes de congelación con antioxidantes. Se ha sugerido que la inclusión de SOD (100 U/ml) en los diluyentes con yema de huevo (YH) (20% v/v) puede mejorar la tolerancia de los espermatozoides de los toros (Bos taurus) (Baie et al., 2017) y gayal (Bos frontalis) a la criopreservación (Perumal, 2014).
Adicionalmente, se ha demostrado que tanto la adición de lipoproteínas de baja densidad (LDL) (8% v/v) como de trehalosa (T) (100 mM), mejora la actividad de CAT y GPx en los espermatozoides bovinos, reflejándose en los parámetros de calidad seminal posdescongelación en comparación con la YH (20% p/v). Sin embargo, se requieren más estudios para determinar la capacidad antioxidante de la trehalosa (100 mM) en el semen de bovino criopreservado (Hu et al., 2010, 2011). La YH es considerada una fuente importante de LDL, responsable de la resistencia al choque térmico y la mejora de la movilidad, a través de la prevención de la pérdida de los fosfolípidos de la membrana (Amirat et al., 2004; Cardoso et al., 2010). Sin embargo, se reporta la presencia de otros componentes de la YH como las HDL, las cuales afectan el metabolismo espermático (Nau et al., 2003).
Una alternativa está en el uso de yema de huevo centrifugada (YHC), la cual conserva las LDL y posee una menor cantidad de otros constituyentes de la YH como chalazas, proporcionando una mayor protección de la movilidad, de la integridad de membrana y de la morfología de los espermatozoides en los procesos de congelación-descongelación (Nouri et al., 2013). La YHC se ha evaluado con buenos resultados en la congelación de espermatozoides caninos (Restrepo et al., 2017) y equinos (Nouri et al., 2013). El objetivo de este estudio fue evaluar la capacidad antioxidante enzimática del semen bovino criopreservado con diferentes fuentes de lipoproteínas de baja densidad (LDL) y trehalosa (T).
MATERIALES Y MÉTODOS
Animales
Se seleccionaron 10 eyaculados de cinco toros sanos y sexualmente maduros de razas Angus y Holstein (Bos taurus) ubicados en granjas del departamento de Antioquia, Colombia. Los toros se mantuvieron bajo condiciones controladas de manejo y alimentación. El procedimiento de la colecta fue supervisado y asesorado por un veterinario para evitar el estrés y la incomodidad en los animales. Todos los procedimientos fueron aprobados por el comité de ética y experimentación con animales del Politécnico Colombiano Jaime Isaza Cadavid.
Colecta y Evaluación Seminal
Las muestras de semen se colectaron una vez a la semana durante 10 semanas mediante el uso de un electroeyaculador (Electrojac 6, EEUU). Primero, el toro fue inmovilizado mecánicamente en un brete, se cortó el pelo del prepucio y se indujo la micción con un masaje estimulante. El orificio del prepucio se lavó con una solución salina y se secó con una toalla de papel. Posteriormente, se realizó una evacuación rectal antes de insertar la sonda y encender el electroeyaculador, cuyo voltaje aumentó automáticamente (Baie et al., 2017).
El eyaculado se recogió en una bolsa de plástico estéril. Se estimó su color y se determinó el volumen, pH, concentración de espermatozoides y movilidad masal e individual utilizando un tubo de recolección de vidrio graduado, tiras indicadoras de pH (Merck KGaA, Darmstadt, Alemania), un espectrofotómetro específico Spermacue® (Minitube, Alemania) y un microscopio de contraste de fase (Eclipse E200, Nikon, Japón) (Domínguez et al., 2008), respectivamente. Los requerimientos mínimos de calidad seminal para procesar los eyaculados fueron: 70% de movilidad total y una concentración espermática de 500x106 espermatozoides/ml (Khumran et al., 2015).
Dilución y Suplementación del Semen
Las muestras de semen se diluyeron en alícuotas separadas a una concentración final de 30x106 espermatozoides/ml en el diluyente Triladyl® (Minitube, Alemania), previamente preparado de acuerdo con las especificaciones del fabricante. Luego se suplementaron para los diferentes tratamientos con yema de huevo de gallina (YH, 20% v/v), yema de huevo de gallina centrifugada (YHC, 20% v/v), lipoproteínas de baja densidad (LDL, 8% v/v), trehalosa (T, 100 mM) (Merck, Alemania) o TLDL (T 100 mM y LDL 8% v/v). La YHC se obtuvo de acuerdo con el protocolo descrito por Montoya et al. (2017) y las LDL se obtuvieron mediante el protocolo descrito por Hu et al. (2011). Las muestras de semen diluido se colocaron en un Equitainer (Hamilton Biovet, EEUU) a 4 °C para ser transferidas al Laboratorio de Andrología del Politécnico Colombiano Jaime Isaza Cadavid (Bello, Antioquia, Colombia).
Congelación y Descongelación del Semen
Las muestras de semen diluido fueron equilibradas a 4 °C por 1 h en un refrigerador y luego se empacaron en pajillas de 0.25 ml (IMV, Francia) y se sellaron con alcohol de polivinilo (Merck, Alemania). Posteriormente, se colocaron en racks para pajillas a 4 cm por encima de la superficie del vapor de nitrógeno líquido (LN ) durante 15 min, para finalmente almacenarse en un tanque con LN . Después de una semana, dos pajillas de cada tratamiento fueron descongeladas en baño de agua a 37 °C durante 1 min. La evaluación de la actividad enzimática antioxidante del semen criopreservado se realizó después de la descongelación (Khumran et al., 2015).
Actividad Antioxidante Enzimática
Para medir la actividad de GPx se preparó una solución de reacción compuesta por 790 µl medio de incubación (buffer fosfato de potasio, EDTA 1 mM, pH 7.7), 20 µl glutatión reducida (2 mM), 30 µl enzima glutatión reductasa (0.15 U/ml), 10 µl azida (0.4 mM), 10 µl NADPH (0.1 mM), 50 µl peróxido de hidrógeno (H O , 0.5 mM) y 90 µl muestra de semen descongelado. Se midió el descenso en la absorbancia por espectrofotometría. Las lecturas se realizaron en celdas de cuarzo a 340 nm durante 5 min (Tavilani et al., 2008).
Para la SOD, se adaptó el protocolo de Weydert y Cullen (2010) para evaluar el sistema NADH (dinucleótido de nicotinamida y adenina reducida, 156 µM, pH 7.4) / PMS (metosulfato de fenazina, 10 µM, pH 7.4). Para esto, se preparó una solución de reacción compuesta por 60 µl NBT (5 mM), 60 µl NADH, 15 µl muestra de semen descongelado y 25 µl PMS. Las lecturas se realizaron en multipozos a 560 nm cada 45 s durante 180 s para calcular el incremento de la absorbancia por segundo.
La actividad de CAT se evaluó mediante la medición de la desaparición del H O . Se preparó una solución buffer fosfato de potasio (10 mM, pH 7.0) que contenía: EDTA (1 mM), Tritón x-100 (0.1%) y H O (20 mM). La solución de reacción estuvo compuesta por 1080 µl buffer fosfato de potasio y 45 µl muestra de semen descongelado. Las lecturas se realizaron en celdas de cuarzo. Se midió el descenso de la absorbancia por espectrofotometría a 240 nm durante 3 min. Una unidad de CAT se definió como 1 µmol H O consumido por minuto. Las lecturas para las tres enzimas se realizaron mediante un espectrofotómetro 6405 UV/Vis (Jenway, Burlington, EEUU) (Aebi, 1984).
Análisis Estadístico
Se utilizó un modelo de bloques al azar, donde el efecto de los tratamientos se bloqueó por el eyaculado y el toro. Se validó la normalidad de los datos a través de la prueba Kolmogorov-Smirnov. Las fuentes de variación se evaluaron a través de un modelo lineal generalizado (GLM) y la comparación de las medias entre los tratamientos se realizó mediante la prueba de Tukey. Se definió la pajilla de semen como unidad experimental. Todos los análisis se desarrollaron utilizando el software SAS 9.2.
RESULTADOS Y DISCUSIÓN
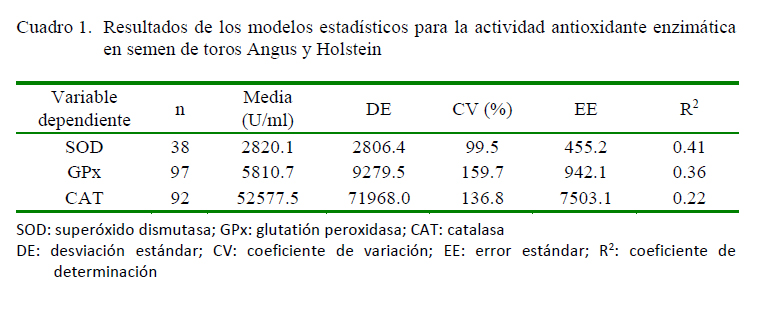
Los valores encontrados para la actividad enzimática antioxidante del semen criopreservado (Cuadro 1) fueron superiores a los reportados por Lecewicz et al. (2015). Sin embargo, se conoce que la actividad enzimática antioxidante podría incrementarse por el aporte de los diferentes componentes de los diluyentes, como la YH (Restrepo et al., 2016); un medio rico en antioxidantes no enzimáticos como la vitamina E, la vitamina B12, la biotina y la fosvitina (Seuss-Baum, 2007).
Adicionalmente, el efecto del animal y de sus eyaculados mostró tener gran influencia al ser significativo en los modelos estadísticos ajustados para cada enzima antioxidante (p<0.05). Sin embargo, estos factores sumados al efecto del tratamiento explicaron apenas parcialmente la variabilidad de los resultados, lo cual se refleja en los coeficientes de variación (R2), todos por debajo del 50% (Cuadro 1). Es posible que otros efectos debidos a componentes no evaluados tengan mayor influencia sobre los resultados que los evaluados en este estudio.
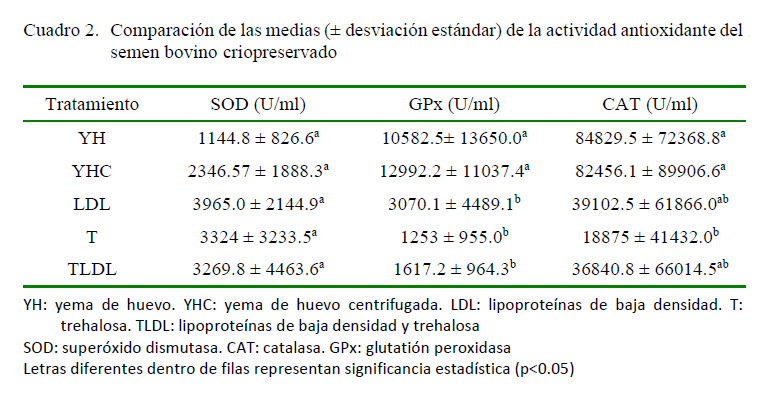
Se ha encontrado una correlación directa entre la vitamina E y la actividad enzimática antioxidante de CAT en el suero humano (Ondreicka et al., 1998), una asociación entre la vitamina B12 y la actividad de CAT en la sangre humana (Lee et al., 2016) y una correlación positiva entre los niveles de biotina en la sangre con las enzimas GSH, GPx y CAT (Al-Qudah e Ismail, 2012). Dichas correlaciones podrían darse también en el semen bovino criopreservado. Esto explicaría la mayor actividad de las enzimas CAT y GPx en el semen criopreservado en los medios suplementados con YH y YHC (Cuadro 2). Además, la actividad del sistema enzimático antioxidante de la YH fue similar a la encontrada en la YHC, lo cual permite deducir que en la YHC permanecen la mayoría de enzimas antioxidantes, así como otros componentes como cofactores que favorecen su actividad.
Por otra parte, se ha reportado que las LDL (8%) y la T (100 mM) potencian la actividad de CAT y GPx, aunque los niveles de SOD no se ven afectados por estos suplementos en comparación con la YH (20%) (Hu et al., 2010, 2011). Los resultados de este estudio evidencian que los medios que contenían LDL, tanto purificada (LDL y TLDL) o como un componente natural (YH y YHC), presentaron mayor actividad de CAT. Adicionalmente, no hubo cambios en los niveles de SOD para ninguno de los tratamientos (Cuadro 2).
De acuerdo con Iqbal et al. (2016), aunque se ha sugerido que la concentración óptima de T para la criopreservación de semen es 100 mM, una concentración de 30 mM mejora la actividad de las enzimas antioxidantes del semen bovino. Así mismo, la actividad de CAT, SOD y el glutatión total son mayores después de la dilución y antes del enfriamiento, mientras que CAT y glutatión total son mayores posdescongelación, lo cual incluso influye en las tasas de fertilidad in vivo. Esto sugiere que posiblemente la concentración T (100 mM) empleada en esta investigación, no necesariamente promueve de la mejor manera la actividad antioxidante enzimática del semen bovino, lo que lleva a plantear la evaluación de otras concentraciones de este disacárido.
Se sugiere que los procesos de congelación conducen a la pérdida de la actividad de defensa antioxidante, principalmente a causa de la alteración de las enzimas antioxidantes (Isachenko et al., 2004). En este orden de ideas, es congruente que la suplementación del diluyente de congelación con YH o YHC mejore la actividad enzimática antioxidante del semen y como tal, pueda tener un efecto positivo sobre la calidad seminal posdescongelación. En tal sentido, se ha reportado una correlación positiva entre las enzimas antioxidantes y los parámetros de calidad del semen (Lone et al., 2018). Así mismo, diferentes estudios informan que la suplementación con estas enzimas mejora la calidad posdescongelación del semen bovino (Asadpour et al., 2012; Perumal 2014), lo cual podría atribuirse a la acción conjunta de los antioxidantes que ocasiona una mayor protección en contra de las ERO (Ghiselli et al., 2000). Es así que una alternativa para potenciar el efecto crioprotector de los medios que no contienen YH o sus derivados y en su lugar se suplementan con LDL y/o T podría ser la inclusión de otros agentes antioxidantes enzimáticos y no enzimáticos.
CONCLUSIONES
-
Los diluyentes suplementados con yema de huevo (YH), yema de huevo centrifugada (YHC) y lipoproteínas de baja densidad (LDL) potencian la actividad antioxidante de la catalasa y la glutatión peroxidasa del semen bovino criopreservado, lo cual podría ser determinante en la calidad espermática posdescongelación.
-
La suplementación del medio de congelación para semen bovino con diferentes fuentes de LDL y trehalosa no influye en la actividad antioxidante de la superóxido dismutasa posdescongelación.
-
El uso de YHC en el diluyente para la congelación de semen bovino es una alternativa promisoria dado su efecto promotor de la actividad enzimática antioxidante posdescongelación, sumado a la eliminación de componentes de la YH con efectos deletéreos sobre la calidad seminal.
Agradecimientos
Al personal de los laboratorios de Biotecnología Animal del Politécnico Colombiano Jaime Isaza Cadavid y Ciencia de los Alimentos de la Universidad Nacional de Colombia, sede Medellín, por su ayuda en la fase experimental de este estudio. Al Politécnico Colombiano Jaime Isaza Cadavid, por la financiación de esta investigación.
Literatura citada
1. Aebi H. 1984. Catalase in vitro. Methods Enzymol 105: 121-126. doi: 10.1016/S0076-6879(84)05016-3 [ Links ]
2. Al-Qudah KM, Ismail ZB. 2012. The relationship between serum biotin and oxidant/antioxidant activities in bovine lameness. Res Vet Sci 92: 138-141. doi: 10.1016/j.rvsc.2010.10.017 [ Links ]
3. Amirat L, Tainturier D, Jeanneau L, Thorin C, Gérard O, Courtens J, Anton M. 2004. Bull semen in vitro fertility after cryopreservation using egg yolk LDL: a comparison with Optidyl, a commercial egg yolk extender. Theriogenology 61: 895-907. doi: 10.1016/S0093-691X(03)00259-0 [ Links ]
4. Andrabi S. 2009. Factors affecting the quality of cryopreserved buffalo (Bubalus bubalis) bull spermatozoa. Reprod Domest Anim 44: 552-569. doi: 10.1111/j.1439-0531.2008.01240.x [ Links ]
5. Anzar M, Graham EF. 1995. Effect of filtration on post-thaw quality of bull semen. Theriogenology 43: 439-449. doi: 10.1016/0093-691X(94)00037-U [ Links ]
6. Asadpour R, Jafari R, TayefiNasrabadi H. 2012. The effect of antioxidant supplementation in semen extenders on semen quality and lipid peroxidation of chilled bull spermatozoa. Iran J Vet Res 13: 246-249. doi: 10.22099/IJVR.2012.365 [ Links ]
7. Baie FH, Wahid H, Rosnina Y, Ariff O, Yimer N, Jeber Z, Salman H, et al. 2017. Impact of Eurycoma longifolia extract on DNA integrity, lipid peroxidation, and functional parameters in chilled and cryopreserved bull sperm. Cryobiology 80: 43-50. doi: 10.1016/j.cryobiol.2017.12.006 [ Links ]
8. Bilodeau JF, Blanchette S, Gagnon C, Sirad MA. 2000. Levels of antioxidant defenses are decreased in bovine spermatozoa after a cycle of freezing and thawing. Mol Reprod Dev 55: 282288. doi: 10.1002/SICI)1098-2795-(200003)55:3<282::AIDMRD6>3.0.CO;2-7 [ Links ]
9. Cardoso J, Paula N, Uchoa D, Silva L. 2010. Diferentes concentrações de gema de ovo na qualidade do sêmen canino diluído em ACP®-106 e resfriado a 4 ºC. Comunicata Sci 1: 146-152. [ Links ]
10. Chen GQ, Ren L, Zhang J, Reed BM, Zhang D, Shen XH. 2015. Cryopreservation affects ROS-induced oxidative stress and antioxidant response in Arabidopsis seedlings. Cryobiology 70: 38-47. doi: 10.1016/j.cryobiol.2014.11.004 [ Links ]
11. Domínguez MP, Falcinelli A, Hozbor F, Sánchez E, Cesari A, Alberio RH. 2008. Seasonal variations in the composition of ram seminal plasma and its effect on frozen-thawed ram semen. Theriogenology 69: 564-573. doi: 10.1016/j.theriogenology.2007.11.010 [ Links ]
12. Ghiselli A, Serafini M, Natella F, Scaccini C. 2000. Total antioxidant capacity as a tool to assess redox status: critical view and experimental data. Free Radical Bio Med 29: 1106-1114. doi: 10.1016/S0891-5849(00)00394-4 [ Links ]
13. Hu JH, Zan LS, Zhao XL, Li QW, Jiang ZL, Li YK, Li X. 2010. Effects of trehalose supplementation on semen quality and oxidative stress variables in frozenthawed bovine semen. J Anim Sci 88: 1657-1662. doi: 10.2527/jas.2009-2335 [ Links ]
14. Hu JH, Jiang ZL, Lv RK, Li QW, Zhang SS, Zan LS, Li YK, Li X. 2011. The advantages of low-density lipoproteins in the cryopreservation of bull semen. Cryobiology 62: 83-87. doi: 10.1016/j.cryobiol.2010.12.007 [ Links ]
15. Iqbal S, Andrabi SMH, Riaz A, Durrani AZ, Ahmad N. 2016. Trehalose improves semen antioxidant enzymes activity, post-thaw quality, and fertility in Nili Ravi buffaloes (Bubalus bubalis). Theriogenology 85: 954-959. doi: 10.1016/j.theriogenology.2015.11.004 [ Links ]
16. Isachenko V, Isachenko E, Katkov I, Montag M, Dessole S, Nawroth F, Van Der Ven H. 2004. Cryoprotectant-free cryopreservation of human spermatozoa by vitrification and freezing in vapor: effect on motility, DNA integrity, and fertilization ability. Biol Reprod 71: 11671173. doi: 10.1095/biolreprod.104.028811 [ Links ]
17. Khumran AM, Yimer N, Rosnina Y, Ariff MO, Wahid H, Kaka A, Ebrahimi M, et al. 2015. Butylated hydroxytoluene can reduce oxidative stress and improve quality of frozenthawed bull semen processed in lecithin and egg yolk based extenders. Anim Reprod Sci 163: 128-134. doi: 10.1016/j.anireprosci.2015.10.007 [ Links ]
18. Lee YJ, Wang MY, Lin MC, Lin PT. 2016. Associations between vitamin B12 status and oxidative stress and inflammation in diabetic vegetarians and omnivores. Nutrients 8: 118. doi: 10.3390/nu8030118 [ Links ]
19. Lecewicz M, Hering DM, Kamiñski S, Majewska A, Kordan W. 2015. Selected qualitative and biochemical parameters of cryopreserved semen of Holstein-Friesian (HF) AI bulls. Pol J Vet Sci 18: 237-239. doi: 10.1515/pjvs-20150030 [ Links ]
20. Lone SA, Prasad JK, Ghosh SK, Das GK, Balamurugan B, Verma MR. 2018. Study on correlation of sperm quality parameters with antioxidant and oxidant status of buffalo bull semen during various stages of cryopreservation. Andrologia 50: e12970. doi: 10.1111/and.12970 [ Links ]
21. Montoya JD, Rojano B, Restrepo G. 2017. Efecto de la suplementación del diluyente sobre la calidad del semen de asno a la descongelación. Arch Zootec 66: 333-340. doi: 10.21071/az.v66i-255.2508 [ Links ]
22. Nau F, Anton M, Nys Y. 2003. L’oeuf de poule: une mine de molecules a activites biologiques. Cinquiemes Journ Rech Avic 8: 20-22.
23. Nouri H, Towhidi A, Zhandi M, Sadeghi R. 2013. The effects of centrifuged egg yolk used with INRA plus soybean lecithin extender on semen quality to freeze Caspian horse semen. J Equine Vet Sci 33: 1050-1053. doi: 10.1016/j.jevs.2013.03.184 [ Links ]
24. Ondreicka R, Beno I, Cerná O, Grancicová E, Staruchová M, Volkovová K, Bobek P, et al. 1998. Relation between levels of vitamins C, E, A and beta-carotene and activity of antioxidant enzymes in the blood. Bratisl Med J 99: 250-254. [ Links ]
25. Perumal P. 2014. Effect of superoxide dismutase on semen parameters and antioxidant enzyme activities of liquid stored (5°C) Mithun (Bos frontalis) semen. J Animals ID 821954. doi: 10.1155/2014/821954 [ Links ]
26. Restrepo G, Madrid CA, Prieto L, Duque JE, Usuga A. 2017. Congelación de semen epididimal canino con yema de huevo centrifugada. Rev Inv Vet Peru 28: 876-885. doi: 10.15381/rivep.v28i4.-13886 [ Links ]
27. Restrepo G, Montoya JD, Rojano B. 2016. Capacidad antioxidante y calidad post-descongelación de semen equino criopreservado con quercetina y ergotioneina. Rev Med Vet Zoot 63: 167178. doi: 10.15446/rfmvz.v63n3.62747 [ Links ]
28. Seuss-Baum I. 2007. Nutritional evaluation of egg compounds. In: Huopalahti R, López-Fandiño R, Anton M, Schade R (eds). Bioactive egg compounds. Germany: Springer. p 117-140. [ Links ]
29. Tavilani, H, Goodarzi MT, VaisiRaygani A, Salami S, Hassanzadeh T. 2008. Activity of antioxidant enzymes in seminal plasma and their relationship with lipid peroxidation of spermatozoa. Int Braz J Urol 34: 485-491. doi: 10.1590/S1677-55382008000400011 [ Links ]
30. Weydert CJ, Cullen JJ. 2010. Measurement of superoxide dismutase, catalase, and glutathione peroxidase in cultured cells and tissue. Nat Protoc 5: 51-66. doi: 10.1038/nprot.2009.197 [ Links ]
Recibido: 6 de mayo de 2018
Aceptado para publicación: 17 de octubre de 2018