Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.30 no.1 Lima jan./mar. 2019
http://dx.doi.org/10.15381/rivep.v30i1.14961
ARTÍCULOS PRIMARIOS
Baculovirus penaei como factor de riesgo para infecciones bacterianas en hepatopáncreas de Penaeus vannamei
Baculovirus penaei as a risk factor for bacterial infections in the hepatopancreas of Penaeus vannamei
Alexander Varela-Mejías1,3, José Valverde-Moya2,4
1 Laboratorio SRY, Departamento de Diagnóstico y Sanidad Acuícola, Sonora, México
2 Instituto Nacional de Aprendizaje, Núcleo Náutico Pesquero, Puntarenas. Costa Rica
3 E-mail: alexander.varela@gmail.com
4 E-mail: jvalverdemoya@ina.ac.cr
RESUMEN
La incidencia de infecciones bacterianas en hepatopáncreas de camarones cultivados en el Golfo de Nicoya, Costa Rica, presentó un alto impacto en los cultivos en 20162017, afectando la sobrevivencia de los animales y las producciones de las granjas camaroneras. Además, se presentaron incidencias importantes de Baculovirus penaei, detectado en poslarvas utilizadas en parte de los estanques. Se realizó un análisis Odds Ratio en un estudio observacional de tipo Caso-Control para determinar la posible participación de este virus como factor de riesgo hacia bacteriosis ulteriores. El estudio demuestra la activa participación de Baculovirus penaei como un importante factor de riesgo. Se presentan datos de sobrevivencias por estanques infectados por el virus vs estanques libres.
Palabras clave: Baculovirus; poslarvas; bacteriosis; factor de riesgo; Odds ratio
ABSTRACT
The incidence of bacterial infections in shrimp hepatopancreas cultivated in the Gulf of Nicoya, Costa Rica, presented a high impact on yields in 2016-2017, affecting the survival of the animals and shrimp farm production. In addition, important incidences of Baculovirus penaei, detected in post-larvae used in part of the shrimp ponds, were reported. An Odds Ratio analysis was performed in an observational case-control study to determine the possible participation of this virus as a risk factor for subsequent bacterioses. The study demonstrates the active participation of Baculovirus penaei as an important risk factor. Survival data are presented by ponds infected by the virus vs free ponds.
Key words: Baculovirus; post larvae; bacterioses; risk factor; Odds ratio
INTRODUCCIÓN
Los cultivos de camarón en Latinoamérica han presentado frecuentes brotes de enfermedades, muchas veces asociados a daños en el hepatopáncreas. Estos brotes pueden presentarse con la participación de etiologías individuales o como coinfecciones por varios agentes causales (Cuéllar-Anjel et al., 2012; Nunan et al, 2014; Peña y Varela, 2016; Aranguren et al., 2017; Tang et al., 2017), como puede ocurrir ante la combinación del Baculovirus penaei (BP) y diversas cepas de Vibrio spp (VarelaMejías, 2018a).
BP ha sido reportado en los estadios larvales, poslarvales, juveniles y adultos de camarones peneidos cultivados en países de Norte, Centro y Sur América (MoralesCovarrubias y Chávez, 1999; Cuéllar-Anjel, 2015; OIE, 2016; Varela-Mejías, 2018a). Este virus fue renombrado como «Virus de la poliedrosis nuclear con envoltura única del Penaeus vannamei» (PvSNPV, por sus siglas en inglés) (Cuéllar-Anjel, 2015); no obstante, dada la gran difusión del nombre previo, se le suele seguir denominando como Baculovirus penaei o BP, y se le considera un agente de baja o moderada virulencia (Lightner, 1996; Lightner y Pantoja, 2002).
Prácticamente todas las especies de camarones peneidos en el continente americano han sido reportadas como susceptibles al BP (Lightner, 1996; Bondad-Reantaso et al., 2001; Morales-Covarrubias, 2004). El mecanismo de transmisión utilizado por este agente es horizontal, mediante el contacto con heces, cuerpos de oclusión, agua o detritos contaminados con el virus (Bondad-Reantaso et al., 2001; Morales-Covarrubias, 2004; OIE, 2016). Sus signos clínicos no son específicos, carecen de valor diagnóstico e incluyen reducciones en la tasa de crecimiento y alimentación, así como incrementos de infestaciones secundarias por epibiontes (MoralesCovarrubias y Chávez, 1999). Los animales severamente afectados pueden presentar una coloración pálida en el tracto digestivo (Lightner, 1996; Cuéllar-Anjel, 2015).
Entre los métodos utilizados para el diagnóstico de BP están el análisis en fresco, la histopatología, el uso de sondas moleculares, la microscopía electrónica, los bioensayos y el PCR (Lightner, 1996; MoralesCovarrubias, 2004; Cuéllar-Anjel, 2015; OIE, 2016; Varela-Mejías, 2018a). De estos, la observación microscópica de tejidos en fresco o de cortes histopatológicos en tejidos procesados han sido los más utilizados por su sensibilidad, costo y accesibilidad. El diagnóstico se fundamenta en la detección de los cuerpos de oclusión piramidales dentro de los núcleos de las células epiteliales del hepatopáncreas o libres en el lumen tubular e intestino (Lightner, 1996; Bondad-Reantaso et al., 2001; Morales-Covarrubias, 2004; Cuéllar-Anjel, 2015; OIE, 2016; VarelaMejías, 2018a).
Por su parte, los brotes bacteriales son causados principalmente por especies y cepas de Vibrio spp (Lightner, 1996; MoralesCovarrubias, 2004; Varela y Peña, 2015; Peña y Varela, 2016; Valverde-Moya y VarelaMejías, 2018a). Las bacteriosis en hepatopáncreas se han reportado en numerosas ocasiones y regiones. Al igual que en el BP, los animales afectados presentan signos clínicos inespecíficos como anorexia, nado errático y debilidad (Lightner, 1988; Prieto y Rodríguez, 1993; Lightner, 1996; MoralesCovarrubias, 2004; Morales-Covarrubias y Gómez-Gil, 2014; Gómez-Gil et al, 2015; Peña y Varela, 2016). Histopatológicamente, en los casos de necrosis séptica del hepatopáncreas se observa atrofia tubular y focos de acumulación de hemocitos rodeando tejidos lesionados, siendo común la presencia de encapsulaciones y necrosis tubular focal o multifocal (Lightner, 1996; MoralesCovarrubias, 2004; Varela-Mejías, 2018a).
Un caso especial de bacteriosis es la Necrosis Aguda del Hepatopáncreas (AHPND, por sus siglas en inglés), siendo esta una infección causada por cepas de Vibrio, entre ellas V. parahaemolyticus. Se reportó por primera vez en China en 2009, propagándose en varias regiones de Asia. Genera desprendimientos celulares masivos en los túbulos del hepatopáncreas causando alta mortalidad (NACA, 2012; FAO, 2013;
Lightner et al., 2013; Tran et al., 2013; de la Peña et al., 2015). En el continente americano, AHPND se diagnosticó por primera vez en 2013 en México (Lightner et al., 2013; Nunan et al., 2014), y posteriormente fue identificado en Centroamérica (Han et al., 2015) y más recientemente en América del Sur (Restrepo et al., 2016; Ahn et al., 2017; Saavedra-Olivos et al., 2018).
En los últimos años, Costa Rica ha presentado un incremento en casos de infecciones en sus cultivos, incluyendo a estos patógenos. La incidencia y prevalencia del BP ha sido particularmente alta (VarelaMejías, 2018b), unido a la participación de brotes por diferentes especies de Vibrio, incluyendo V. parahaemolyticus, V. harveyi y Vibrio spp (Varela-Mejías y Elizondo-Ovares, 2018). Son pocas las granjas camaronícolas que realizan monitoreos regulares sobre el estado sanitario de sus cultivos y estos se realizan principalmente mediante análisis en fresco y bacteriología diferencial, y con menor frecuencia, especialmente en casos sospechosos o de difícil diagnóstico, se recurre a la histopatología o PCR (Varela y Peña, 2015; Peña y Varela, 2016). Los casos detectados son comunicados al Servicio Nacional de Salud Animal (SENASA) mediante reportes oficiales.
Con estos antecedentes y con la intención de encontrar posibles correlaciones entre la incidencia del BP y el impacto de las bacteriosis, se presentan datos de sobrevivencia de 137 estanques de camarones cultivados en el Golfo de Nicoya, Costa Rica, afectados por BP y bacteriosis en 2016 y 2017. Se correlacionó el estado sanitario de las poslarvas y el impacto generado en infecciones bacteriales presentes durante el cultivo.
MATERIALES Y MÉTODOS
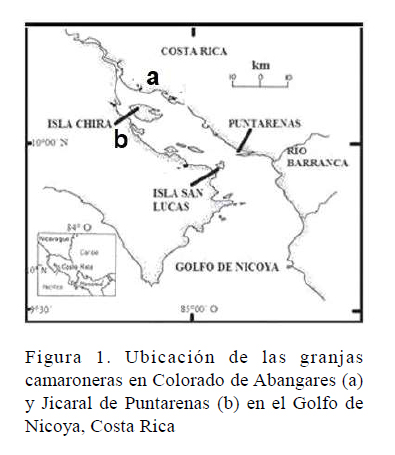
El estudio abarcó desde el inicio del primer ciclo de cultivo de 2016 hasta el cierre del último ciclo de cultivo de 2017. Se analizaron 14 granjas, totalizando 137 estanques, ubicadas en las zonas de Colorado de Abangares y Jicaral de Puntarenas, a ambas márgenes del Golfo de Nicoya, Costa Rica (Figura 1). El estado sanitario de los lotes de poslarvas y poblaciones de estanques de engorda fue determinado en el Laboratorio de Patologías y Parasitología de Crustáceos, Costa Rica. Los animales analizados durante el estudio fueron capturados en forma aleatoria y se transportaron con vida hacia el laboratorio para su análisis.
Las muestras utilizadas para la detección de BP se procesaron por análisis en fresco y análisis histopatológico, según las técnicas descritas por Bell y Lightner (1988) y Lightner (1996). Se realizaron capturas de muestras durante la recepción de las poslarvas. Los análisis se basaron en la detección de los cuerpos de oclusión virales, mediante microscopía, con o sin tinción de contraste, usando verde malaquita. El procesamiento de los tejidos para el análisis histopatológico se realizó en el Laboratorio Nacional de Servicios Veterinarios (LANASEVE), donde los cortes de los tejidos se hicieron con 5 µm de espesor y se tiñeron con hematoxilina y eosina. Las láminas procesadas se enviaron y analizaron en el Laboratorio de Patologías y Parasitología de Crustáceos. La cantidad de poslarvas procesadas por muestra fue de al menos 100 individuos, capturados en forma aleatoria de los lotes recibidos.
Se consideró como muestra positiva a BP a aquellas en las cuales se detectó al menos un animal infectado. Las muestras en las cuales no se detectaron lesiones u oclusiones o durante su seguimiento en la etapa de engorda se consideraron como «No detectado».
Los análisis bacteriológicos se realizaron durante muestreos de seguimiento y monitoreo general en los estanques de engorda. Se realizaron análisis semanales de por lo menos 10 animales por estanque utilizando muestras de hepatopáncreas y cultivándolas en agar selectivo-diferencial TCBS, específico para Vibrio sp, según lo descrito por Prieto y Rodríguez (1993) y Gómez-Gil et al. (2015).
Los datos de sobrevivencia fueron obtenidos a partir de los registros zootécnicos facilitados por los biólogos y productores de las granjas sometidas al estudio. Se estableció la sobrevivencia promedio general de los estanques del estudio a la cosecha como el punto de corte para el análisis de datos y se determinó su desviación estándar.
Adicionalmente, a partir de los datos obtenidos, se generaron dos subgrupos: a) estanques afectados por BP y por bacteriosis y b) estanques no afectados por BP, pero afectados por bacteriosis. Para ambos subgrupos se calculó la cantidad relativa de estanques con sobrevivencia inferior, igual o superior al promedio de sobrevivencia general, así como su respectiva desviación estándar.
Se realizó un análisis transversal observacional de tipo caso:control, mediante una evaluación Odds ratio. La interpretación de este tipo de análisis se basa en el cálculo de la razón existente entre los casos y controles expuestos y los casos y controles no expuestos. Según el valor obtenido, un resultado menor a 1 es considerado como factor de protección y un resultado superior a 1 es considerado como factor de riesgo. Un Odds ratio igual a 1 indica que no existe relación entre el factor en estudio y el resultado obtenido, según la metodología descrita por de Blas et al. (2007).
Para los fines de este análisis, se consideraron como «expuestos» los animales diagnosticados con BP y como «no expuestos» a los animales no diagnosticados con BP. Así mismo, se consideró como «casos» los estanques cuya sobrevivencia fue menor al promedio general, y como «controles» aquellos cuya sobrevivencia fue igual o superior al promedio general. Este procedimiento englobó 137 estanques a cuyos registros de cosecha se tuvo acceso. Para el cálculo del Odds ratio, se estableció un nivel de confianza de 99% y se utilizó el software libre «WinEpi» (http://www.winepi.net/).
RESULTADOS Y DISCUSIÓN
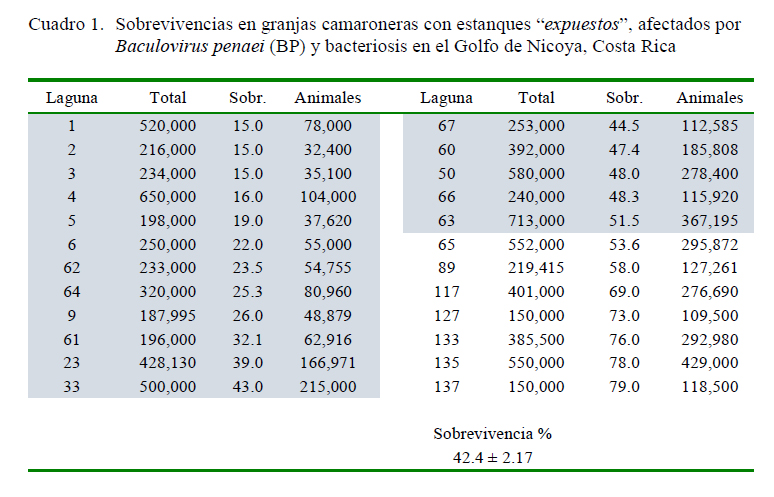
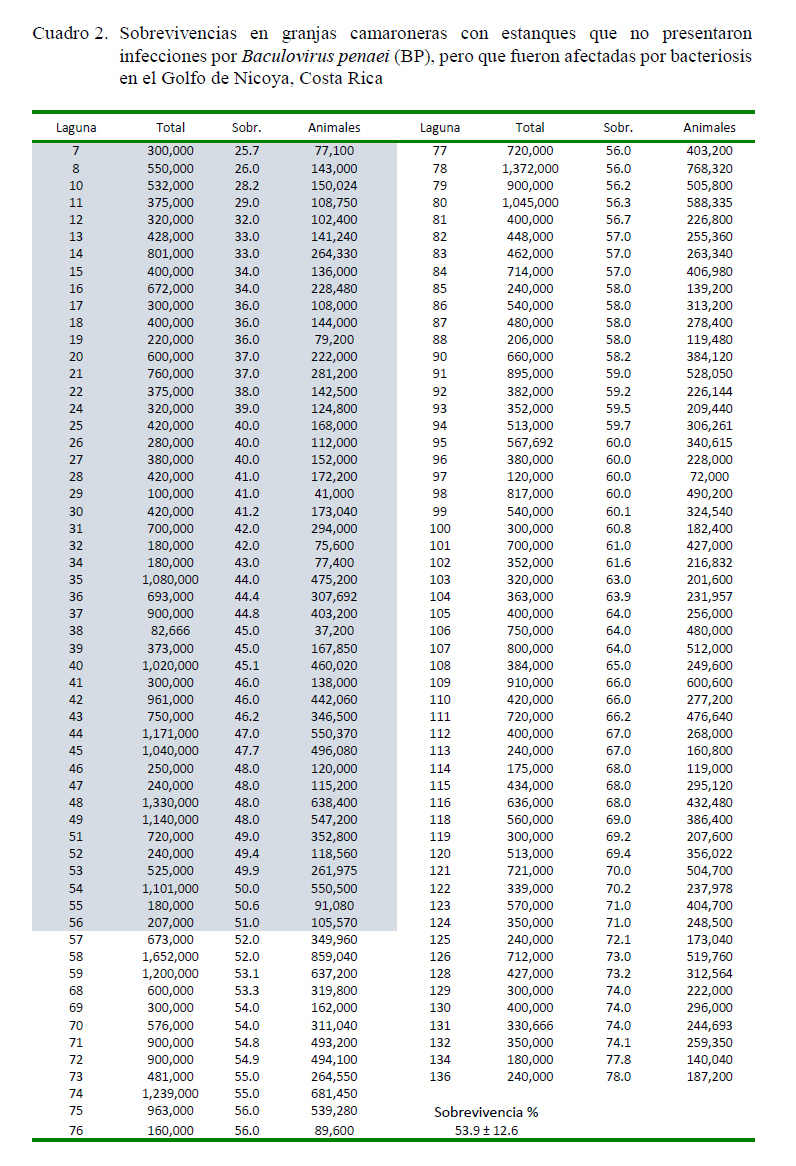
La sobrevivencia general fue de 52%, con una desviación estándar de 15.2%. Los datos de los dos grupos del estudio se presentan en los Cuadros 1 y 2.
La sobrevivencia disminuyó a 42.0% en el subgrupo de 24 estanques expuestos al BP (Cuadro 1), lo que significó una reducción del 10% con respecto a la sobrevivencia general; además de presentar una gran variabilidad (desviación estándar de 21.7%).
En el caso de los 113 estanques del subgrupo no expuestos al BP (Cuadro 2) se presentó una sobrevivencia de 53.9 ± 12.3%, ligeramente superior al promedio general.
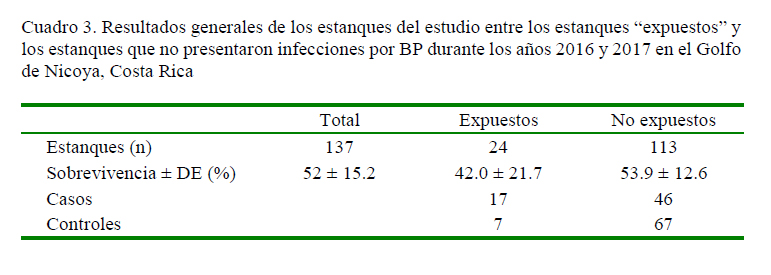
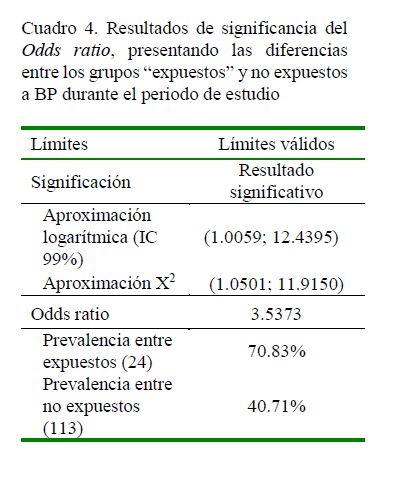
Estos datos se resumen en el Cuadro 3, los cuales fueron utilizados para alimentar la matriz para el cálculo del Odds ratio. Los resultados obtenidos, así como los respectivos valores de significancia, se presentan en el Cuadro 4.
El valor calculado de Odds ratio fue de 3.5373, indicando que la exposición al BP representó un factor de riesgo a los lotes expuestos y una menor posibilidad de sobrevivencias por infecciones secundarias, específicamente para este caso, de bacteriosis en hepatopáncreas. Adicionalmente, mediante el uso de WinEpi, se determinó, con un nivel de confianza de 99%, que los estanques expuestos al BP (n=24) presentan entre 1.01 y 12.44 más probabilidades de concluir con sobrevivencias por debajo del promedio general debido a bacteriosis ulteriores que los estanques no expuestos al virus (n=113), usando los límites de aproximación logarítmica.
La prevalencia de estanques con mortalidad por encima del promedio general, causada por diversas bacterias en los estanques con animales expuestos previamente al BP fue de 70.83% contra 40.71% de prevalencia en estanques no expuestos a este virus, indicando un incremento significativo de mortalidad.
El hecho de que las infecciones previas por BP sean un factor de riesgo para ataques bacteriales posteriores era de esperarse, considerando que este virus reduce la funcionalidad del hepatopáncreas, uno de los principales órganos del camarón (Bell y Lightner, 1988), lo cual afecta la digestión, retardando su crecimiento e incrementando la vulnerabilidad a los ataques por patógenos oportunistas (Aranguren et al., 2017). Los resultados indican que es altamente recomendable utilizar únicamente lotes de poslarvas negativas al BP, con el propósito de reducir el riesgo o impacto de las enfermedades bacterianas que reduzcan o comprometan la sobrevivencia y el rendimiento productivo. Esto es especialmente importante para granjas que cuentan con historial de problemas bacteriales.
Agradecimiento
Los autores agradecen a los productores de camarón del Golfo de Nicoya, Costa Rica, por permitir el acceso a sus datos.
Literatura citada
1. Ahn YS, Piamsomboon P, Tang KFJ, Han JE, Kim JH. 2017. Complete genome sequence of acute hepatopancreatic necrosis diseasecausing Vibrio campbellii LA16-V1, isolated from Penaeus vannamei cultured in a Latin American Country. Genome Announc 5: e01011-17. doi: 10.1128/genomeA.01011-1 [ Links ]
2. Aranguren LF, Han JE, Tang K. 2017. Enterocytozoon hepatopenaei (EHP) is a risk factor for acute hepatopancreatic necrosis disease (AHPND) and septic hepatopancreatic necrosis (SHPN) in the Pacific White shrimp Penaeus vannamei. Aquacuture 471: 37-42. doi: 10.1016/j.aquaculture.2016.12.038 [ Links ]
3. Bell TA, Lightner DV. 1988. A handbook of normal Penaeid shrimp histology. Baton Rouge, LA, USA: World Aquaculture Society. 114 p. [ Links ]
4. aquatic animal diseases. FAO Fisheries Technical Paper No. 402/2. Rome: FAO. [Internet]. Available in: http://www.fao.org/3/ay1679e.pdf
5. Cuellar-Ánjel J. 2015. Baculovirosis tetraedrica. The Center for Food Security and Public Health, Iowa State University. [Internet]. Available in: http://www.cfsph.iastate.edu/Factsheets/es/tetrahedral-baculovirosis-es.pdf [ Links ]
6. Cuéllar-Anjel J, Lightner DV, Pantoja C. 2012. Síndrome de mortalidad temprana o síndrome de necrosis hepatopancreática aguda. The Center for Food Security and Public Health, Iowa State University. [Internet]. Available in: http://www.cfsph.iastate.edu/Factsheets/es/acute-hepatopancreatic-necrosisdisease-es.pdf [ Links ]
7. de Blas I, Ruiz-Zarzuela I, Bayot B, Ferreira C. 2007. Manual de epidemiología veterinaria. Unidad de Patología Infeciosa y Epidemiológica. Zaragoza, España: Facultad de Veterinaria, Universidad de Zaragoza. 180 p. [ Links ]
8. de la Peña LD, Cabillon NA, Catedral DD, Amar EM, Usero RC, Monotilla WD, Calpe AT, et al. 2015. Acute hepatopancreatic necrosis disease (AHPND) outbreaks in Penaeus vannamei and P. monodon cultured in the Philippines. Dis Aquat Organ 116: 251-254. doi: 10.3354/dao02919 [ Links ]
9. [FAO] Food and Agriculture Organization of the United Nations. 2013. Report of the FAO/MARD technical workshop on early mortality syndrome (EMS) or acute hepatopancreatic necrosis syndrome (AHPNS) of cultured shrimp (under TCP/VIE/3304). Hanoi, Viet Nam: FAO. 53 p. [ Links ]
10. Gomez-Gil B, Roque A, Soto- Rodríguez S. 2015. Vibriosis en camarones y su diagnóstico. En: Ruiz-Luna A, Berlanga-Robles C, Betancourt-Lozano M (eds). Avances en acuicultura y manejo ambiental. México: Ed Trillas. p 137-150. [ Links ]
11. Han JE, Tang KF, Lightner DV. 2015. Genotyping of virulence plasmid from Vibrio parahaemolyticus isolates causing acute hepatopancreatic necrosis disease in shrimp. Dis Aquat Organ 115: 245-251. doi: 10.3354/dao02906 [ Links ]
12. Lightner DV. 1988. Vibrio disease of penaeid shrimp. In: Sindermann CJ, Lightner DV (eds). Disease diagnosis and control in North American marine aquaculture. Developments in Aquaculture and Fisheries Science. Amsterdam: Elsevier. p 42-47. [ Links ]
13. Lightner DV. 1996. A handbook of shrimp pathology and diagnostic procedures for diseases of cultured penaeid shrimp. Louisiana, USA: World Aquaculture Society. 304 p. [ Links ]
14. Lightner DV, Redman RM, Pantoja C, Noble BL, Nunan LM, Loc Tran. 2013. Documentation of an emerging disease (early mortality syndrome) in SE Asia & Mexico. 6th Meeting of the InterAmerican Committee on Aquatic Animal Health. World Organization for Animal Health. [Internet]. Available in: http://www.cesaibc.org/sitio/archivos/Donald%20Lightner_131014133831.pdf [ Links ]
15. Lightner DV, Pantoja C. 2002. Bioseguridad en el cultivo de camarones. Organismo di cooperazione e documentazione internazionale. CIDEA. Nicaragua: Univ. Centroamericana. [ Links ]
16. Morales-Covarrubias MS. 2004. Enfermedades del camarón: detección mediante análisis en fresco e histopatología. México: Ed Trillas. 122 p. [ Links ]
17. Morales-Covarrubias MS, Chávez MC. 1999. Manual para la detección de enfermedades de camarones peneidos utilizando análisis en fresco. México: Centro de Investigaciones en Alimentación y Desarrollo. 68 p. [ Links ]
18. Morales-Covarrubias MS, Gomez-Gil B. 2014. Enfermedades bacterianas de camarones. En: Morales VQ, CuéllarAnjel J (eds)2° ed. Guía técnica – Patología e inmunología de camarones Penaeidos. Panamá: Organismo Regional Internacional de Sanidad Agropecuaria (OIRSA). p 167-194. [ Links ]
19. [NACA] Network of Aquacultures Centres in Asia-Pacific. 2012. NACA/DAFF Asia-Pacificemergencyregionalconsultation on the emerging shrimp disease: early mortality syndrome (EMS) / Acute hepatopancreatic necrosis syn-drome (AHPNS). Bangkok, Thailand. [Internet]. Availablein: http://www.fhs-afs.net/pdf/EMSRC_Summary-and-Links.pdf [ Links ]
20. Nunan L, Lightner D, Pantoja C, Gomez-Jimenez S. 2014. Detection of acute hepatopancreatic necrosis disease (AHPND) in Mexico. Dis Aquat Org 111: 81-86. doi: 10.3354/dao02776 [ Links ]
21. [OIE] Organización Mundial de Sanidad Animal. 2016. Manual de diagnóstico en animales acuáticos. Cap 2.2.10. 6th ed.. París, Francia: OIE. [ Links ]
22. Peña-Navarro N, Varela-Mejías A. 2016. Prevalencia de las principales enfermedades infecciosas en Litopenaeus vannamei cultivado en el Golfo de Nicoya, Costa Rica. Rev Cienc Marinas Oceanografía 51: 553-564. doi: 10.4067/S0718-19572016000300007 [ Links ]
23. Prieto A, Rodríguez MC. 1993. Diagnóstico y control de enfermedades bacterianas en camarón de cultivo. México DF: FAO. 66 p. [ Links ]
24. Restrepo L, Bayot B, Betancourt I, Pinzón A. 2016. Draft genome sequence of pathogenic bacteria Vibrio parahaemolyticus strain Ba94C2, associated with acute hepatopancreatic necrosis disease isolate from South America. Genom Data 9: 143-144. doi: 10.1016/j.gdata.2016.08.008 [ Links ]
25. Saavedra-Olivos KY, Peralta-Ortiz T, Ordinola-Zapata A, SandovalRamayoni JE, Vieyra-Peña EG, Zapata-Cruz MA, Hidalgo-Mogollón A, et al. 2018. Detección de una proteína asociada a la enfermedad de la necrosis hepatopancreática aguda (AHPND) en Litopenaeus vannamei bajo cultivo semi-intensivo en Ecuador. Rev Inv Vet Perú 29: 328-338. doi: 10.15381/rivep.v29i1.14194 [ Links ]
26. Tang KFJ, Aranguren LF, Piamsomboon P, Han JE, Maskaykina IY, Schmidt MM. 2017. Detection of the microsporidian Enterocytozoon hepatopenaei (EHP) and Taura syndrome virus in Penaeus vannamei cultured in Venezuela. Aquaculture 480: 17-21. doi: 10.1016/j.aquaculture.2017.07.043 [ Links ]
27. Tran L, Nunan L, Redman RM, Mohney LL, Pantoja CR, Fitzsimmons K, Lightner DV. 2013. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp. Dis Aquat Organ 105: 45-55. doi: 10.3354/dao02621 [ Links ]
28. Valverde-Moya JA, Varela-Mejías A. 2018. Cultivo comercial de camarones Litopenaeus vannamei en Costa Rica durante El Niño 2015: la incidencia de enfermedades. Rev Inv Vet Perú 29: 188-204. doi: 10.15381/rivep.v29i1.14187 [ Links ]
29. Varela A, Peña N. 2015. Hepatopancreatitis necrotizante asociada al Fenómeno del Niño, en cultivos de camarones del Golfo de Nicoya. Repertorio Científico 18(1): 29-34. [ Links ]
30. Varela-Mejías A. 2018a. Patologías del hepatopáncreas en camarones marinos cultivados en América y su diagnóstico diferencial mediante histopatología. Revista AquiaTIC 50: 13-30 [ Links ]
31. Varela-Mejías A. 2018b. Incidencia detectada del Baculovirus penaei en muestras de post larvas de camarón importadas en Costa Rica. Repertorio Científico 21(1). En prensa. [ Links ]
32. Varela-Mejías A, Elizondo-Ovares C. 2018. Mionecrosis bacterial en camarones de cultivo en Costa Rica. Reporte de caso. Panorama Acuícola 23(5): 48-52. [ Links ]
Recibido: 27 de julio de 2018
Aceptado para publicación: 6 de enero de 2019