Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.30 no.1 Lima ene./mar. 2019
http://dx.doi.org/10.15381/rivep.v30i1.14648
ARTÍCULOS PRIMARIOS
Resistencia antimicrobiana de cepas de Escherichia coli aisladas de contenidos de bursa de Fabricio de aves para engorde
Antimicrobial resistance of Escherichia coli strains isolated from the bursa of Fabricius in broilers
Edna Carvajal B.1, Walter Hernández A.2, María Torres C.3, Diana López V.3, Egberto Rueda G.4, María Vásquez R.1,5
1 Universidad de Santander, Facultad de Ciencias de la Salud, Grupo de Investigación CliniUdes, Bucaramanga, Colombia
2 Universidad de la Paz, Escuela de Medicina Veterinaria y Zootecnia, Barrancabermeja, Colombia 3 Grupo de Investigación de Bacteriología y Laboratorio Clínico, Universidad de Boyacá, Tunja, Boyacá, Colombia
3 Universidad de Santander, Facultad de Ciencias Exactas, Naturales y Agropecuarias, Grupo de investigación en Ciencias Agropecuarias GICA, Bucaramanga, Colombia
4 E-mail: m.vasquez@udes.edu.co
RESUMEN
El objetivo de la presente investigación fue determinar el porcentaje de sensibilidad o resistencia de cepas de E. coli aisladas de pollo de engorde asintomático frente a 18 antibióticos comunes utilizados en avicultura y medicina humana; a su vez, cepas productoras de betalactamasas de espectro extendido (BLEES), procedentes de granja o plantas de beneficio de la zona avícola de Santander, Colombia. Se determinó la circulación de cepas resistentes a betalactámicos, cefalosporinas, aminoglucósidos, quinolonas y sulfonamidas, así como antibióticos de amplio uso en ambientes ajenos a las granjas. Se aislaron 46 cepas de E. coli del contenido de bolsas de Fabricio de 100 pollos de engorde entre 2 y 6 semanas de edad (20 procedentes de una granja avícola y 80 de una planta de sacrificio) en Santander, Colombia. Las muestras fueron cultivadas en agar McConkey. Se realizaron pruebas de sensibilidad a las cepas aisladas con 18 antimicrobianos. El 91% de las cepas fueron resistentes a la ampicilina y el 80% a las cefalosporinas; así mismo, al enfrentar las cepas con la asociación de antibióticos con inhibidores de betalactamasas (ampicilina sulbactam y amoxacilina/ácido clavulánico), se encontró 30% de resistencia. Se utilizó la prueba del doble disco para evaluar la presencia de cepas de E. coli productoras de betalactamasas de espectro extendido (BLEES) confirmando su presencia en el 63% de las muestras. Se evidencia la presencia de cepas de E. coli en aves de engorde asintomáticas, con alta resistencia antimicrobiana, incluyendo expresión de BLEES.
Palabras clave: resistencia antimicrobiana; Escherichia coli; pollos de engorde
ABSTRACT
The aim of this study was to determine the percentage of sensitivity or resistance of strains of E. coli isolated from asymptomatic broiler chicken against 18 common antibiotics used in poultry and in human medicine. In addition, strains that produce extended-spectrum beta-lactamases (ESBL) from a farm or slaughterhouses in the poultry area of Santander, Colombia. The circulation of strains resistant to beta-lactams, cephalosporins, aminoglycosides, quinolones and sulfonamides was determined, as well as antibiotics widely used in other non-farm environments. The content of the bursa of Fabricius was cultivated in McConkey agar obtaining 46 strains of E. coli. Susceptibility tests (n=18) were conducted to the isolated strains, and 91% of the strains were resistant to ampicillin and 80% to cephalosporins. The association of antibiotics with beta-lactamase inhibitors (ampicillin sulbactam and amoxicillin / clavulanic acid) showed 30% resistance. The double disc test was used to evaluate the presence of strains of E. coli producing extendedspectrum beta-lactamases (ESBL) confirming its presence in 63% of the samples. Results showed the presence of E. coli strains in asymptomatic chicken broilers with high antimicrobial resistance, including expression of ESBL.
Key words: antimicrobial resistance; Eschericha coli; broilers
INTRODUCCIÓN
En Colombia se produjeron 13 827 millones de huevos y 1.56 millones de toneladas de carne de pollo en 2017, cifras que ubican al país en el tercer lugar en Latinoamérica, después de México y Brasil (FENAVI, 2018). Los avances en genética, sanidad y alimentación de aves han permitido lograr altos estándares de producción (Bueno et al., 2016), pero que a la vez aumenta las exigencias en temas de saneamiento y bioseguridad (Díaz, 2017). Fallas en la cadena de producción, manejo y manipulación de las aves aumentan el riesgo de encontrar microorganismos potencialmente patógenos que se vehiculizan por el alimento, aves, o sus derivados, transformando el producto en reservorio de patógenos o de microorganismos que comprometen la inocuidad de la producción (Martínez-Guardia et al., 2011).
Dentro de los microorganismos de mayor impacto en la industria avícola se encuentra la Escherichia coli (E.coli), miembro de la familia de Enterobacteriaceae, y agente causal de varios brotes epidémicos documentados en Colombia (Soto Varela et al., 2016) y en otros países. Se han reportado varios serotipos en diversos lugares; por ejemplo, en España E. coli enteropatogénico (EPEC) O2:H40, O8:H19, O108:H9 O45:H8, O2:H40, O108:H9 y O123:H32 (Alonso et al., 2014), Argentina E. coli Shigatoxigénico (STEC) O22:H8, O113:H21, O130:H11, O171:H2 y O178:H19 (Alonso et al., 2016), Cuba O26:K60, O111:K58, O55:K69, O86:K61, además de India (Puig Peña et al., 2014), Dinamarca (Ronco et al., 2017) y Egipto (Amin et al., 2017; El-Mongy et al., 2018), entre otros.
Los productores avícolas emplean antibióticos como promotores de crecimiento para potenciar la producción, a veces sin el control debido. Así mismo, en un intento por controlar las pérdidas ocasionadas por la aparición de enfermedades, instauran tratamientos con antimicrobianos, en numerosos casos con dosis menores a las recomendadas (Briz, 2006), de modo que los microorganismos pueden llegar a adaptarse y aumentar la resistencia frente a ciertos antibióticos (Soufi et E. Carvajal et al. al., 2011). Es conocido que la introducción no controlada de antibióticos y la multicausalidad de la resistencia bacteriana se puede potenciar en el medio por el consumo de antibióticos en la práctica avícola (Martínez et al., 2014). Esto se reafirma con estudios que identifican el tránsito de patógenos resistentes en el ambiente de producción (Laube et al., 2014; Mellata et al., 2018), o que buscan el potencial zoonótico de dicho ambiente de producción (Mitchell et al., 2015; Stromberg et al., 2017).
E. coli se encuentra en el tracto gastrointestinal de las aves diseminándose ampliamente en las heces. En situaciones de estrés y bajo condiciones inadecuadas de manejo o bioseguridad se comporta como patógeno oportunista, debido a sus factores de virulencia, tomando en muchas ocasiones un curso asintomático (Perello, 2009). Esto afecta directamente los índices productivos de la industria avícola (Mantilla y Portacio, 2012; Hernández-Fillor et al., 2017).
La resistencia antimicrobiana en la industria avícola está relacionada al uso indiscriminado de antimicrobianos y a la falta de control en los tratamientos. Cepas de E. coli multirresistentes a antibióticos son la base para la diseminación de dicha resistencia a poblaciones completas de aves de corral (Hernández-Fillor et al., 2017). El principal mecanismo es la transferencia horizontal; sin embargo, se han identificado elementos genéticos que participan en la transferencia de genes de resistencia; de los cuales, los más conocidos son los transposones, los plásmidos, y los cassettes genéticos de resistencia. Recientemente se ha descubierto que los integrones juegan un rol fundamental en la evolución de los genomas bacterianos, siendo los responsables de la captura y difusión de los determinantes de resistencia a los antibióticos entre diversos microorganismos Gramnegativos (Berglund, 2015). En la producción avícola la resistencia se pone en evidencia a través de estudios que caracterizan por métodos microbiológicos los patrones o fenotipos de resistencia; por lo tanto, el presente estudio tuvo como objetivo evaluar los perfiles de resistencia de E. coli aisladas de contenidos de bursa de Fabricio de aves para engorde.
MATERIALES Y MÉTODOS
El estudio fue de tipo descriptivo de corte transversal. Se colectaron al azar 100 bolsas de Fabricio de pollos broiler entre 2 y 6 semanas de edad de una granja avícola ubicada en el Municipio de Lebrija, Santander (Colombia), entre febrero y junio de 2014. Las muestras fueron colocadas en caldo Infusión Cerebro Corazón (BHI) y transportadas en el menor tiempo posible al laboratorio de la Universidad de Santander para su procesamiento y evaluación. El 20% de estas muestras se obtuvieron de animales en granja y el resto de la planta de sacrificio de pollos. Las muestras se tomaron mediante corte inferior de la piel bajo el pigóstilo y vertebras coccígeas de las aves, siguiendo procedimientos antisépticos para evitar contaminaciones. Como criterio de inclusión se tomaron muestras de animales vivos, sanos y como criterio de exclusión animales enfermos o bajo tratamiento de antibióticos.
Las bolsas de Fabricio fueron lavadas externamente con una solución salina estéril, y luego fueron abiertas con un bisturí estéril. El contenido fue sembrado en agar MacConkey e incubado a 37 °C durante 24 h. Se seleccionaron las colonias que presentaron fermentación de lactosa. La identificación de cada colonia se hizo mediante el sistema comercial Crystal E/NF de BBL, el cual consta de un panel de sustratos para evidenciar las propiedades bioquímicas de las bacterias Gram negativas. Como control de referencia se tomó la cepa E. coli ATCC 25922.
Para determinar el perfil de susceptibilidad se empleó la técnica de Kirby-Bauer (Cona, 2002); siguiendo las recomendaciones del Clinical and Laboratory Standards Institute (CLSI, 2013). Cada cepa se expuso a 18 antibióticos con sensidiscos Oxoid® para ampicilina (AMP10), ampicilina sulbactam (SAM20), amoxacilina (AML10), amoxacilina / ácido clavulanico (AML20/10), florfenicol (FFC30), gentamicina (GM10), cloranfenicol (C30), trimetoprim/ sulfametoxazol (STX25), kanamicina (K30), norfloxacina (NOR10), ciprofloxacino (CIP5), cefalotina (CF30), cefalexina (CL30), cefuroxime (CM30), cefoxitin (FOX30), cefotaxime (CTX30), ceftazidime (CAZ30) y cefepime (FEP30). Para establecer la respuesta bacteriana al antibiótico se midieron lo halos que indican la zona de inhibición del crecimiento, interpretando de acuerdo con los patrones estándar de diámetro de halo de inhibición para cada antibiótico del CLSI, y teniendo como cepa de referencia la E coli ATCC 25922.
Para confirmar la presencia de betalactamasas de espectro extendido (BLEES) en las cepas sospechosas se realizó la prueba del doble disco. Para esto, en una placa de agar Muller-Hinton se inocula el microorganismo sospechoso con una turbidez estandarizada (McFarland 0.5), se aplican sensidiscos de ácido clavulánico o de amoxicilina/clavulánico y de dos cefalosporinas de tercera generación a una distancia de 20-30 mm de centro a centro. Se utilizaron los discos de amoxicilina/ácido clavulánico, junto a cefotaxime 30 µg (CTX) y ceftazidime 30 µg (CAZ) (Laube et al., 2013). Se incubaron durante 18 horas a 37 °C, donde una prueba positiva para BLEE muestra aumento del halo de inhibición en las zonas donde el disco de ácido clavulánico está cercano a la cefalosporina.
RESULTADOS
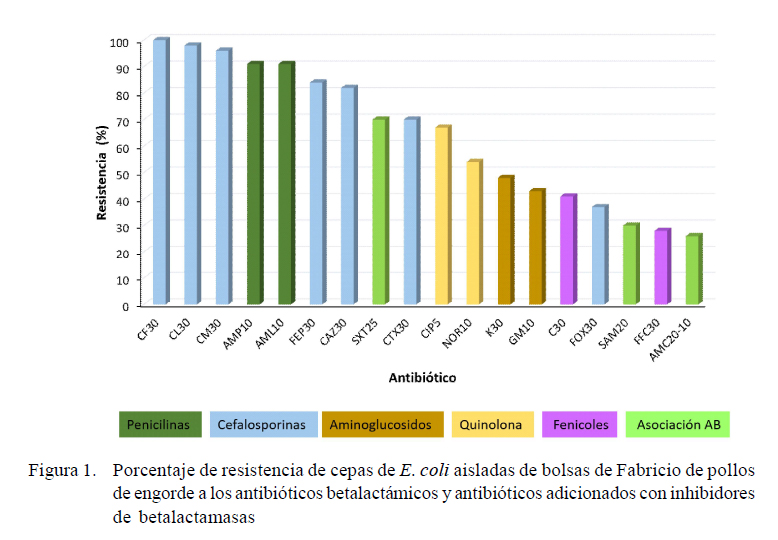
Los perfiles de susceptibilidad de las 46 cepas aisladas se muestran en la Figura 1. El 46% de las 100 muestras fueron positivas para aislamiento de E. coli, mientras que 5% resultaron ser del género Klebsiella. En el caso de las cepas de E. coli se observó resistencia a los antibióticos betalactámicos (91%), cefalosporinas de primera generación (100%), segunda (96%), tercera (82%) y cuarta generación (84%), aminoglucosidos (43%), quinolonas (54%) y sulfonamidas (70%). Así mismo, al evaluar estas cepas con la asociación de estos antibióticos con inhibidores de betalactamasas como ampicilina sulbactam y amoxacilina/ácido clavulánico, disminuyó el porcentaje de resistencia al 26% (Figura 1). La prueba del doble disco confirmó la presencia de BLEES en el 63% de las cepas obtenidas de las bolsas de Fabricio.
DISCUSIÓN
A medida que aumenta la exigencia sobre una producción avícola más eficiente, se buscan nuevos métodos para optimizar el recurso genético, optimizar la absorción de los nutrientes y controlar los agentes patógenos. Pese a que en países como Colombia, Argentina y Perú está restringida la comercialización de antibióticos como el cloranfenicol, olaquindox, nitroimidazoles y nitrofuranos para uso en animales destinados al consumo humano (Quesada et al., 2016), algunos antibióticos se siguen utilizando como promotores de crecimiento, buscando mantener una integridad intestinal libre de bacterias patógenas. Estas situaciones han generado que algunas cepas de E. coli presentes en la microbiota normal del intestino y ciego de las aves generen resistencia a los antibióticos (Díaz-López et al., 2017).
El estudio evidenció una elevada prevalencia de colonización de pollos por cepas de E. coli con fenotipo BLEE, similares a los obtenidos en Brasil en los que identificaron resistencia a más de tres grupos de antibióticos (Bezerra et al., 2016). En trabajos realizados en Cuba se encontró el 93.3% de multirresistencia los antimicrobianos evaluados (Hernández-Fillor et al., 2017). En forma similar, Mainali et al. (2013) encontraron en Canadá 79.2% de resistencia a uno o más de los antibióticos evaluados, donde el 54.3% fueron resistentes a tres o más antimicrobianos y el 10.8% fueron resistentes a cinco o más antimicrobianos.
En el presente estudio se evidenció el 100% de resistencia a las cefalosporinas de primera generación, hecho que pudiera estar relacionado con el uso de betalactámicos, unido a fallas en manejo al que se ven sometidos con frecuencia los animales (densidades altas, cambios en la temperatura ambiental, tratamientos de agua inadecuados, entre otros). Este tipo de situaciones facilita tanto el intercambio de bacterias entre individuos como el intercambio de genes de resistencia entre bacterias, hecho que probablemente puede ser transferido al humano mediante el consumo de carne de pollo (Abreu et al., 2013). Cota-Rubio et al. (2014) analizaron casos de aislamientos en animales de granja dispuestos para consumo humano entre 2010 y 2012, donde fue evidente que el uso indiscriminado de los antibióticos ha repercutido en la presencia de cepas bacterianas a antibióticos, tales como betalactámicos, macrólidos, glucopéptidos, aminoglucósidos, quinolonas, tetraciclinas y sulfamidas, en los que predomina la resistencia al grupo de los betalactámicos.
CONCLUSIONES
-
El 91% de las cepas fueron resistentes a la ampicilina y el 80% a las cefalosporinas
-
La prueba del doble disco confirmó la presencia de BLEES en el 63% de las cepas obtenidas de las bolsas de Fabricio.
Agradecimientos
Los investigadores expresan su agradecimiento a la granja avícola de Lebrija, a la Universidad de Santander (UDES), a la Universidad de Boyacá y a todas las personas que contribuyeron de una u otra forma a la realización de este estudio.
Literatura citada
1. Abreu R, Castro-Hernández B, Madueño A, Espigares-Rodríguez E, Moreno-Roldán E, Moreno P, Sánchez-Tudela JM, et al. 2013. Prevalencia de cepas de Escherichia coli productoras de betalactamasas de espectro extendido (BLEE) aisladas en pollos de granjas avícolas de la isla de Tenerife (España). Higiene y Sanidad Ambiental 13: 1091-1096. [ Links ]
2. Alonso MZ, Krüger A, Sanz ME, Padola NL, Lucchesi PM. 2016. Serotypes, virulence profiles and stx subtypes of Shigatoxigenic Escherichia coli isolated from chicken derived products. Rev Argent Microbiol 48: 325- 328. doi: 10.1016/j.ram.2016.04.009 [ Links ]
3. Alonso MZ, Sanz ME, Padola NL, Lucchesi PM. 2014. Caracterización de cepas de Escherichia coli enteropatogénico (EPEC) aisladas durante el proceso de faena de pollos. Rev Argent Microbiol 46: 122-125. [ Links ]
4. Amin U, Kamil SA, Shah SA, Dar TA, Mir MS, Ali R, Wani BM. 2017. Serotyping and prevalence of avian pathogenic Escherichia coli infection in broilers in Kashmir. Pharma Innovation Int J 6: 336-338. [ Links ]
5. Astaiza JM, Benavides CJ, Lopez MJ, Portilla JP. 2014. Diagnóstico de los principales antibióticos recomendados para pollo de engorde (broiler) por los centros agropecuarios del municipio de Pasto, Nariño, Colombia. Rev Med Vet 27: 99-110. [ Links ]
6. Berglund B. 2015. Environmental dissemination of antibiotic resistance genes and correlation to anthropogenic contamination with antibiotics. Infect Ecol Epidemiol 5: 28564. doi: 10.3402/iee.v5.28564 [ Links ]
7. Bezerra WG, da Silva IN, Vasconcelos R, Machado D, Lopes E, Lima SV, Teixeira RS. 2016. Isolation and antimicrobial resistance of Escherichia coli and Salmonella enterica subsp. enterica (O: 6, 8) in broiler chickens. Acta Sci Vet 44: 1364. [ Links ]
8. Briz RC. 2006. Retirada de los antibióticos promotores de crecimiento en la unión europea: causas y consecuencias. Universidad de Zaragoza. [Internet]. Disponible en: http:// www.wpsa-aeca.es/aeca_imgs_docs/wpsa1142587453a.pdf [ Links ]
9. Bueno D, López N, Rodriguez F, Procura F. 2016. Producción de pollos parrilleros en países sudamericanos y planes sanitarios nacionales para el control de Salmonella en dichos animales. Rev Agron Noroeste Argentino 36: 11-37. [ Links ]
10. [CLSI] Clinical and Laboratory Standards Institute. 2013. Performance standards for antimicrobial susceptibility testing; Twenty-third informational supplement. CLSI document M100-S23. Wayne, PA, USA: CLSI. 199 p. [ Links ]
11. Cona E. 2002. Condiciones para un buen estudio de susceptibilidad mediante test de difusión en agar. Rev Chil Infectol 19: 77-81. doi: 10.4067/S071610182002019200001 [ Links ]
12. Cota-Rubio E, Hurtado-Ayala L, Pérez-Morales E, Alcántara-Jurado L. 2014. Resistencia a antibióticos de cepas bacterianas aisladas de animales destinados al consumo humano. ReIbCi 1: 75-85. [ Links ]
13. Díaz-López EA, Ángel-Isaza J, Ángel B. 2017. Probiotics in poultry farming: a review. Rev Med Vet 35: 175-189. doi: 10.19052/mv.4400 [ Links ]
14. Díaz M. 2017. Determinantes del desarrollo en la avicultura en Colombia: instituciones, organizaciones y tecnología. Banco de la República, Cartagena. [Internet]. Disponible en: http://www.banrep.gov.co/docum/Lectura_finanzas/pdf/dtser_214.pdf [ Links ]
15. El-Mongy MA, Abd-El-Moneam GM, Moawad AA, Mohammed AB. 2018. Serotyping and Escherichia coli isolated virulence genes detection in from broiler chickens. J Biol Sci 18: 46-50. doi: 10.3923/jbs.2018.46.50 [ Links ]
16. [FENAVI] Federación Nacional de Avicultores de Colombia. 2018. [Internet]. Disponible en: http:// fenavi.org/estadisticas/informacionestadistica-publica/ [ Links ]
17. Hernández-Fillor RE, Báez-Arias M, Alfonso-Zamora P, Espinosa-Castaño I. 2017. Susceptibilidad antimicrobiana y formación de biopelícula en aislados de Escherichia coli procedentes de gallinas ponedoras. Rev Salud Animal 39(3). [Internet]. Disponible en: http://scielo.sld.cu/pdf/rsa/v39n3/rsa05317.pdf [ Links ]
18. Laube H, Friese A, Von Salviati C, Guerra B, Käsbohrer A, Kreienbrock L, Roesler U. 2013. Longitudinal monitoring of extended-spectrum-betalactamase/Amp C producing Escherichia coli at German broiler chicken fattening farms. Appl Environ Microb 79: 4815-4820. doi: 10.1128/AEM.00856-13 [ Links ]
19. Laube H, Friese A, Von Salviati C, Guerra B, Rösler U. 2014. Transmission of ESBL/AmpC-producing Escherichia coli from broiler chicken farms to surrounding areas. Vet Microbiol 172: 519-527. doi: 10.1016/j.vetmic.2014.06.008 [ Links ]
20. Mainali C, McFall M, King R, Irwin R. 2013. Evaluation of antimicrobial resistance profiles of Escherichia coli isolates of broiler chickens at slaughter in Alberta, Canada. J Food Protect 76: 20452051. doi: 10.4315/0362-028X.JFP-13-203 [ Links ]
21. Mantilla CL, Portacio ÁB. 2012. Potencial probiótico de cepas nativas para uso como aditivos en la alimentación avícola. Rev Colomb Biotecnol 14: 31-40. [ Links ]
22. Martínez-Guardia M, Medina-Arroyo H, Bonilla-Flórez A. 2011. Estado actual de la producción de pollos de engorde y gallinas ponedoras en el municipio de Quibdó-Chocó. Livestock Res Rural Develop 23(3). [Internet]. Disponible en: http://www.lrrd.org/lrrd23/3/mart23044.htm [ Links ]
23. Mellata M, Johnson J, Curtiss R. 2018. Escherichia coli isolates from commer-cial chicken meat and eggs cause sepsis, meningitis and urinary tract infection in rodent models of human infections. Zoonoses Public Hlth 65: 103113. doi: 10.1111/zph.12376 [ Links ]
24. Mitchell NM, Johnson JR, Johnston B, Curtiss R, Mellata M. 2015. Zoonotic potential of Escherichia coli isolates from retail chicken meat products and eggs. Appl Environ Microb 81: 1177-1187. doi: 10.1128/AEM.03524-14 [ Links ]
25. Perello MMG. 2009. Detección y caracterización de aislados de Escherichia coli de origen clínico y fecal en gallinas ponedoras. Tesis Doctoral. Madrid, España: Univ. Complutense de Madrid. 184 p. [ Links ]
26. Puig PY, Leyva CV, Apórtela LN, Campos GN, Frerer MY, Soto RP. 2014. Serogroups and antimicrobial resistance of Eschericha coli strains isolated in foods from outbreaks of diarrhea. Rev Cubana Alimentación Nutr 24: 161-167. [ Links ]
27. Quesada A, Reginatto GA, Ruiz A, Colantonio LD, Burrone MS. 2016. Resistencia antimicrobiana de Salmonella spp aislada de alimentos de origen animal para consumo humano. Rev Per Med Exp Salud Pública 33: 32-44. doi: 10.17843/rpmesp.2016.331.1899 [ Links ]
28. Ronco T, Stegger M, Olsen RH, Sekse C, Nordstoga AB, Pohjanvirta T, Lilje B, et al. 2017. Spread of avian pathogenic Escherichia coli ST117 O78: H4 in Nordic broiler production. BMC Genomics 18: 13. doi: 10.1186/s12864016-3415-6 [ Links ]
29. Soto Z, Pérez L, Estrada D. 2016. Bacteria causing of foodborne diseases: an overview at Colombia. Rev Salud Uninorte 32: 105-122. 10.14482/ sun.32.1.8598 [ Links ]
30. Soufi L, Sáenz Y, Vinué L, Abbassi MS, Ruiz E, Zarazaga M, Ben Hassen A, et al. 2011. Escherichia coli of poultry food origin as reservoir of sulphonamide resistance genes and integrons. Int J Food Microbiol 144: 497-502. doi: 10.1016/j.ifoodmicro.2010.11.008 [ Links ]
31. Stromberg ZR, Johnson JR, Fairbrother JM, Kilbourne J, Van Goor A, Curtiss R, Mellata M. 2017. Evaluation of Escherichia coli isolates from healthy chickens to determine their potential risk to poultry and human health. Plos One 12: e0180599. doi: 10.1371/journal.pone.0180599 [ Links ]
Recibido: 29 de mayo de 2018
Aceptado para publicación: 15 de noviembre de 2018