Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.30 no.2 Lima abr./jun. 2019
http://dx.doi.org/10.15381/rivep.v30i2.15028
ARTÍCULOS DE REVISIÓN
Alteraciones digestivas y recomendaciones nutricionales en lechones de bajo peso al nacimiento
Digestive alterations and nutritional recommendations in low birth weight piglets
Jimmy Quisirumbay-Gaibor1,2,3, Carlos Vílchez Perales2
1 Facultad de Medicina Veterinaria y Zootecnia, Universidad Central del Ecuador, Ecuador
Facultad de Zootecnia, Universidad Nacional Agraria La Molina, Lima, Perú
3 E-mail: jrquisirumbay@uce.edu.ec
RESUMEN
La intensa selección genética realizada en las cerdas en las últimas décadas ha generado una cerda hiperprolífica con mayor número de lechones al nacimiento y mayor proporción de aquellos con pesos inferiores a 1 kg, denominados lechones de bajo peso al nacimiento (LBPN). Los LBPN padecen de alteraciones morfofisiológicas gastrointestinales, que les genera una menor capacidad digestiva para poder aprovechar de manera eficiente los nutrientes de la dieta, afectando su desempeño productivo y supervivencia. Esto ha desencadenado una serie de trabajos de investigación para encontrar alternativas nutricionales y alimenticias que permitan a este tipo de lechones alcanzar mejores parámetros productivos. El objetivo de este documento fue reunir información sobre las alteraciones digestivas más importantes en LBPN y las opciones nutricionales para mejorar su supervivencia y desempeño productivo.
Palabras clave: alimentación; nutrición; monogástricos; cerdos; aparato digestivo
ABSTRACT
The intense genetic selection carried out in sows in the last decades has generated a hyperprolific sow with greater litter sizes and a greater proportion of piglets with weight lower than 1 kg, called low birth weight piglets (LBWP). The LWBP suffer from gastrointestinal morphophysiological alterations, which generates a lower digestive capacity in order to efficiently take advantage of the nutrients of the diet, affecting their productive performance and survival. This has triggered a series of research to find nutritional and feeding alternatives that allow this type of piglets to achieve better productive parameters. The objective of this document was to gather information about the most important digestive alterations in LBWP and the nutritional options to improve their survival and productive performance.
Key words: feeding; nutrition; monogastric; pig; digestive system
INTRODUCCIÓN
La intensa selección genética realizada en la cerda en las últimas decadas ha desencadenado la aparición de camadas de lechones más numerosas, pero de menor peso al nacimiento (Milligan et al., 2002; Quiniou et al., 2002; Quesnel et al., 2008; Martineau y Badouard, 2009; Campos et al., 2012). Los lechones con bajo peso al nacimiento presentan un menor grado de vitalidad en comparación con sus hermanos de camada de peso normal (Herpin et al., 1996; Tuchscherer et al., 2000). Por otro lado, el peso vivo al nacimiento en los lechones está correlacionado con la tasa de crecimiento al destete (Dwyer et al., 1993; Gondret et al., 2005).
El síndromedecrecimiento intrauterino retardado (IUGR) sería la causa para la ocurrencia de este tipo de lechones (Foxcroft et al., 2006; Wu et al., 2006), debido a la insuficiencia placentaria que genera un deficiente transporte de oxígeno y nutrientes a los fetos (Soothill et al., 1992). En humanos por ejemplo, los recién nacidos con bajo peso al nacimiento son aquellos cuyo peso está en el décimo percentil o es menor al valor de la media menos dos desviaciones estándar (Cooper, 1975), mientras que los lechones de bajo peso al nacimiento (LBPN) son aquellos cuyo peso es inferior a 1 kg o está por debajo del cuartil inferior del peso de la camada (Michiels et al., 2013). Los lechones que padecen IUGR presentan unaserie de alteraciones en la morfofisiología del tracto gastrointestinal que se considera como la causa del menor desempeño productivo (Wang et al., 2005) al afectarse la capacidad digestiva y de absorción de nutrientes (Yang et al., 2012). El objetivo de este documento fue reunir información sobre las alteraciones digestivas más importantes en lechones de bajo peso al nacimiento y las opciones nutricionales para mejorar su supervivencia y desempeño productivo.
ALTERACIONES DIGESTIVAS
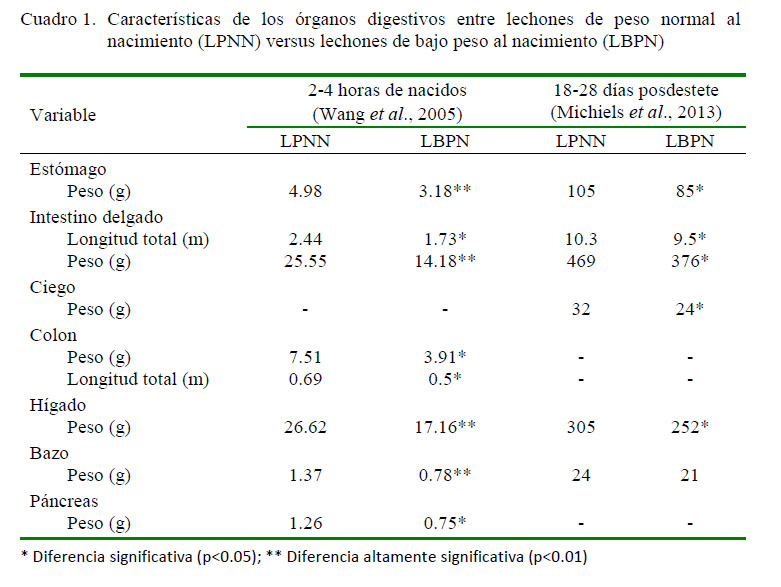
Diversos tipos de alteraciones han sido reportadas en lechones que han padecido de IUGR; entre ellas el menor peso del tracto gastrointestinal y la reducción del tamaño del páncreas, en ambos casos por reducción del número y tamaño de células (Xu et al., 1994). Wang et al. (2005) encontraron diferencias estadísticas en el peso del estómago, intestino delgado, colon, hígado, bazo y páncreas (Cuadro 1) en LBPN en comparación con lechones de peso normal al nacimiento (LPNN) entre las 2 y 4 primeras horas de nacidos.
Michiels et al. (2013) señala la existencia de un retraso posdestete en la maduración de los órganos digestivos evaluando lechones entre el día 18 y 28 posterior al destete, siendo el destete a los 27 días de edad (Cuadro 1). Para este estudio, los autores consideraron como LBPN a aquellos cuyo peso fue inferior a 1 kg al momento del nacimiento o se encontraba por debajo del cuartil inferior del peso de la camada. El retraso en los órganos digestivos está asociado a una menor circulación del factor de crecimiento similar a la insulina tipo-1 (IGF-1), así como a una menor presencia de receptores para este factor y no se encuentra asociado al proceso de transición en sí que ocurre durante el destete.
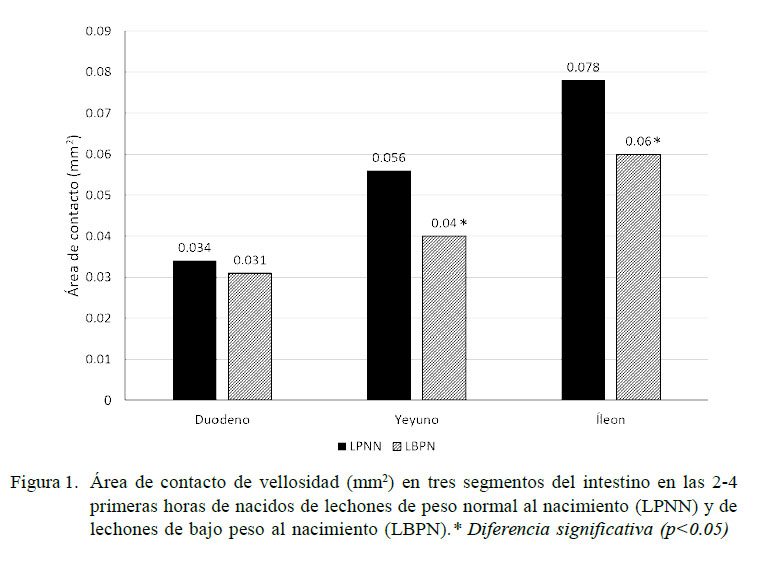
En los LBPN existe menor peso y longitud intestinal, ileal y colónica, menor tamaño de vellosidades intestinales (relacionado a una alteración en la homeostasis: proliferación-apoptosis celular) y mayor conteo de bacterias adheridas a la mucosa ileal y colónica en los primeros cinco días de nacidos (D’Inca et al., 2010). Adicionalmente existe una menor superficie de contacto en las vellosidades a nivel del duodeno, yeyuno e íleon (Figura 1) (Dong et al., 2014) y menor grosor de la submucosa y túnica muscular (Michiels et al., 2013). Se ha reportado, además, alteración de las proteínas de la mucosa del intestino delgado relacionadas con la absorción, digestión y transporte de nutrientes, estructura y motilidad celular, metabolismo de carbohidratos, lípidos, aminoácidos, vitaminas y minerales (Wang et al., 2009a,b; Yang et al., 2012; He et al., 2015). Así mismo, destaca la reducción de la expresión de los niveles del ARNm para los receptores de la insulina (p=0.17) y hormona del crecimiento (p=0.11) en la mucosa intestinal al compararlo frente a los LPNN (Wang et al., 2005), coincidiendo con el estudio de Michiels et al. (2013), quienes reportan una reducción en la densidad de los receptores para IGF-1 en la parte proximal del intestino delgado.
RECOMENDACIONES NUTRICIONALES
Factor de Crecimiento Insulínico Tipo I (IGF-I)
En niños, las tasas bajas de crecimiento están relacionados con bajos niveles circulantes de IGF-I (Thieriot-Prevost et al., 1988).
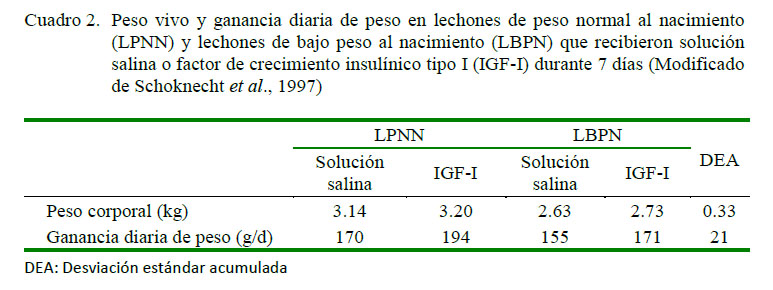
Los LBPN presentan niveles bajos de IGF-I al día 3 de edad frente a los lechones del grupo control (12.9±1.3 vs 20.4±2.5 ng/ml, respectivamente, p=0.01). El uso de IGF-I en dosis de 4 µg/h desde el día 3 al 10 de edad a través de una infusión en estos lechones incrementaba significativamente la concentración de IGF-I circulante, la tasa de crecimiento y el depósito de proteína y grasa frente al grupo control, sin que se haya encontrado alteraciones en los niveles de insulina, glucosa, IGF II u hormonas tiroideas. El peso vivo llegó a ser similar entre los LBPN y LPNN (Schoknecht et al., 1997) (Cuadro 2).
Sustituto lácteo hiperproteico y amoxicilina
Existe un efecto anabólico en animales jóvenes con peso normal al nacimiento cuando consumen fórmulas con alto contenido de proteína. Este resultado se atribuye al efecto estimulante de los aminoácidos que favorecen la síntesis proteica en músculo e hígado (Frank et al., 2005). Esta propiedad se ha utilizado también con la finalidad de alcanzar el crecimiento compensatorio en neonatos con bajo peso al nacimiento (Embleton y Cooke, 2005; Thureen y Heird, 2005). La alimentación de LBPN con alto contenido de proteína acompañado de la suplementación de amoxicilina produce un aumento en la tasa de crecimiento, junto a una menor conversión alimenticia y reducción de la tasa de síntesis proteica en el intestino delgado, músculo y carcasa (Jamin et al., 2011).
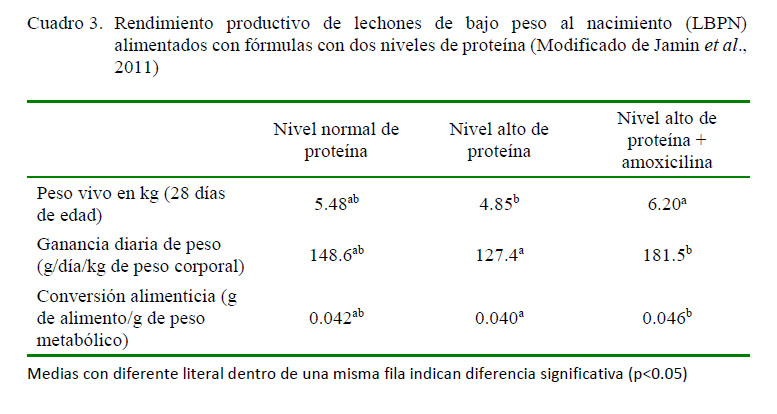
En el Cuadro 3 se puede apreciar que LBPN alimentados con dietas altas en proteína (77 g/l) más amoxicilina (50 mg/kg/día) durante la primera semana de vida aumentan la tasa de crecimiento entre el día 2 y 28 de edad (destete al segundo día de edad) en comparación con lechones que consumieron la fórmula láctea con un nivel normal de proteína (51.4 g/l), (similar a la leche de la cerda). Por otro lado, no se obtuvieron los mismos resultados cuando los lechones consumieron la fórmula que incluía alta proteína pero sin antibiótico, pues se presentó cuadros de diarrea entre el día 7 y 15 de edad (Jamin et al., 2011).
En otro estudio con LBPN (0.90 ±0.02 kg de PV) se encontró que aquellos que consumieron fórmula láctea con mayor concentración de proteína (20 g/kg PV0.75/día) entre el día 2 y 28 de edad (destete día 2 de edad) presentaron una mayor concentración de bacterias ileales al día 7; además, presentaron una mayor permeabilidad en el intestino delgado y grueso frente al grupo control que recibió un nivel normal de proteína (14.1 g/kg PV0.75/día). Así mismo, se encontró una diferencia significativa (p=0.02) en la ganancia diaria de peso a favor del grupo alto en proteína (188±10 g/día/kg de peso al nacimiento) frente al grupo control (158±10 g/día/kg de peso al nacimiento) durante todo el periodo experimental (Chatelais et al., 2011).
Ácido Fólico
La capacidad antioxidante hepática y la función mitocondrial están afectadas en individuos que padecen del síndrome de crecimiento intrauterino retardado, lo que les genera estrés oxidativo (Park et al., 2003). La suplementación en la dieta de ácido fólico en lechones (5 mg/kg de alimento) entre el día 14 y 35 de edad previene el efecto perjudicial del IUGR sobre la función antioxidante. Se ha observado una reducción en la formación de grupos carbonilos en las proteínas (p<0.05) y disminución en la concentración de malondialdehído (MDA) en el hígado; así como un aumento en la concentración de ácido fólico en plasma e incremento de la actividad de glutatión peroxidasa (GPx) en hígado (p<0.05) frente a LBPN que no recibieron la suplementación de ácido fólico (Liu et al., 2012). Además, se encontraron niveles menores del pro-oxidante homocisteína, favoreciendo la actividad antioxidante, tal y como fue reportado por Huang et al. (2004) y Handy et al. (2005). Es importante mencionar que la administración de ácido fólico no mejoró el desempeño productivo en LBPN en el estudio de Liu et al. (2012).
Ácidos Grasos de Cadena Media (AGCM)
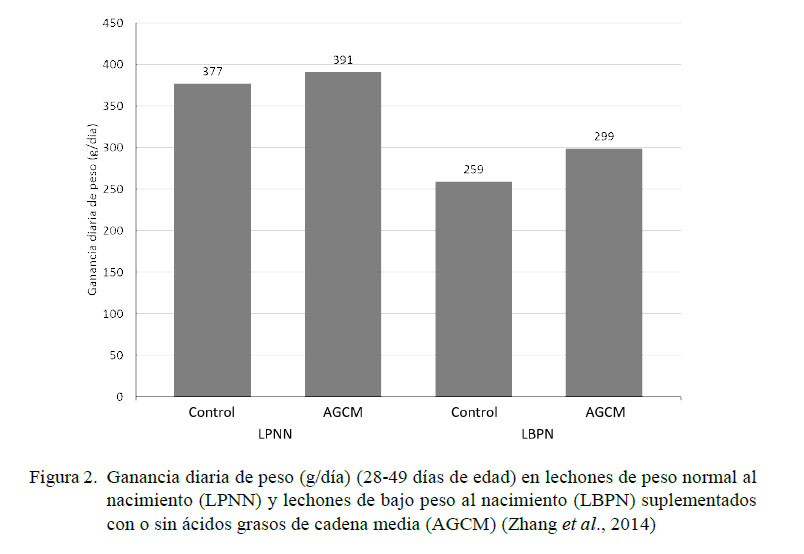
La administración de AGCM a una concentración de 4% en el alimento durante 28 días posteriores al destete (día 21 de edad) atenúa el daño oxidativo en hígado al incrementar de manera significativa (p<0.05) la proporción glutatión reducido : glutatión oxidado. Independientemente del peso al nacimiento, la suplementación de AGCM disminuye las concentraciones de MDA en hígado y los niveles de apoptosis y necrosis en hepatocitos (p<0.05) (Zhang et al., 2014). Así mismo, se obtuvo una mayor ganancia diaria de peso (299 g/día vs 259 g/día) y eficiencia de alimentación (ganancia diaria de peso dividido para el consumo diario de alimento) (0.67 vs 0.62) en LBPN que consumieron AGCM en las primeras cuatro semanas posteriores al destete vs LBPN del grupo control (sin consumo de AGCM) (Figura 2); sin embargo, estos valores fueron inferiores a los alcanzados por los LPNN, tanto del grupo control como los tratados con AGCM (Zhang et al., 2014). Esta información coincide con los resultados encontrados por Dove et al. (1993), quienes reportaron los efectos benéficos de los AGCM en la dieta al conseguir mayor ganancia de peso corporal y mejor conversión alimenticia en las primeras dos semanas posdestete.
Tributirina (TB)
Los individuos que han padecido de IUGR presentan resistencia a la insulina, disfunción lipídica e hígado graso, alterándose, por lo tanto, el metabolismo de lípidos, glúcidos y aminoácidos (Magee et al., 2008; Lim et al., 2011; Liu et al., 2013). La tributirina (o butirina) es un triglicérido con tres moléculas de butirato los cuales pueden actuar como ácidos grasos de cadena corta (Edelman et al., 2003). La suplementación de tributirina al 0.1% a través de una dieta láctea del día 7 al 21 de edad disminuye la resistencia a la insulina (p<0.05) y promueve un metabolismo lipídico normal en LBPN al incrementar la actividad de las enzimas lipasa hepática, lipasa lipoproteica y lipasa total (p<0.05), mejorando de esta manera la eficiencia metabólica en este tipo de lechones. Además, la TB incrementa los niveles de glucógeno hepático en LBPN (He et al., 2015).
De igual manera, la suplementación de TB al 0.1% aumenta el área de contacto de las vellosidades intestinales, mejora la actividad de las enzimas intestinales y la producción de IgG en LBPN entre el día 7 al 21 de edad (destete a los siete días) (Dong et al., 2016). Así mismo, en cerdas gestantes se ha encontrado que la suplementación de TB al 0.3% incrementa la ganancia diaria de peso de los lechones destetados (Lu et al., 2012).
β -Hidroxi-β -Metilbutirato Cálcico (HMB-Ca) y Leucina
Los neonatos con IUGR presentan alteraciones del crecimiento y un desarrollo defectuoso de las fibras musculares (Rehfeldt y Kuhn, 2006; Yates et al., 2012). Existe una reducción en el número de fibras musculares secundarias y totales, lo que desencadena una reducción de la masa muscular y provoca un retraso de la maduración del músculo esquelético (Alvarenga et al., 2013; Pardo et al., 2013).
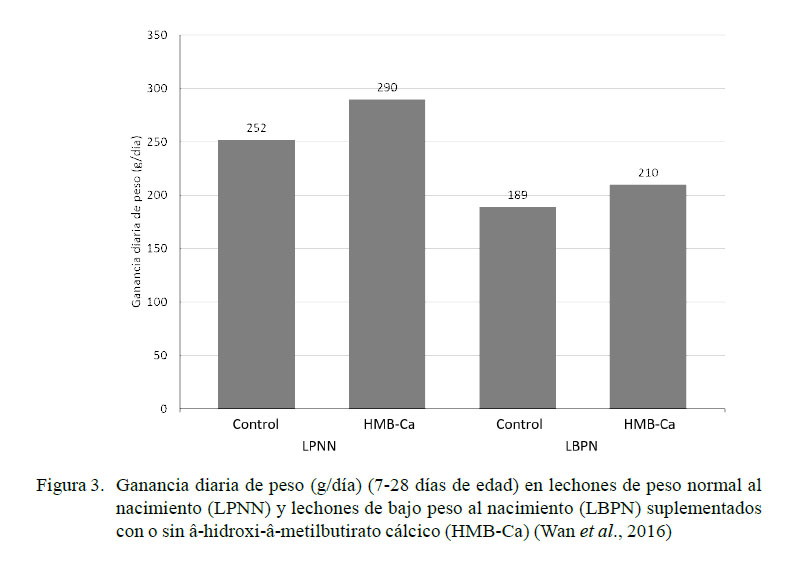
El β-hidroxi-β -metilbutirato es un metabolito derivado de la leucina y estimula la síntesis de proteína en el músculo esquelético a través de la activación de la vía de señalización de la rapamicina (mTOR) (Anthony et al., 2000; Boutry et al., 2013; Wheatley et al., 2013) e incrementa la actividad mitótica de las células satélite del músculo (Moore et al., 2005). La suplementación de HMB-Ca a una dosis de 800 mg/kg de alimento en LBPN entre el día 7 y 28 de edad genera un aumento del peso neto (4.41 kg vs 3.96 kg) y de la ganancia diaria de peso (210 g/d vs 189 g/d) frente al grupo control (Wan et al., 2016) (Figura 3). HMB-Ca favorece la maduración y el crecimiento del músculo esquelético al acelerar el desarrollo de las fibras glucolíticas de contracción rápida, y aumenta los valores del factor de crecimiento similar a la insulina tipo 1 (Wan et al., 2016). Nissen et al. (1994) encontraron que el suplemento de HMB-Ca en cerdas gestantes (desde el día 108 de gestación al 21 de lactancia) en dosis de 2 g/día aumento el porcentaje de grasa en leche (41%) y el peso de los lechones.
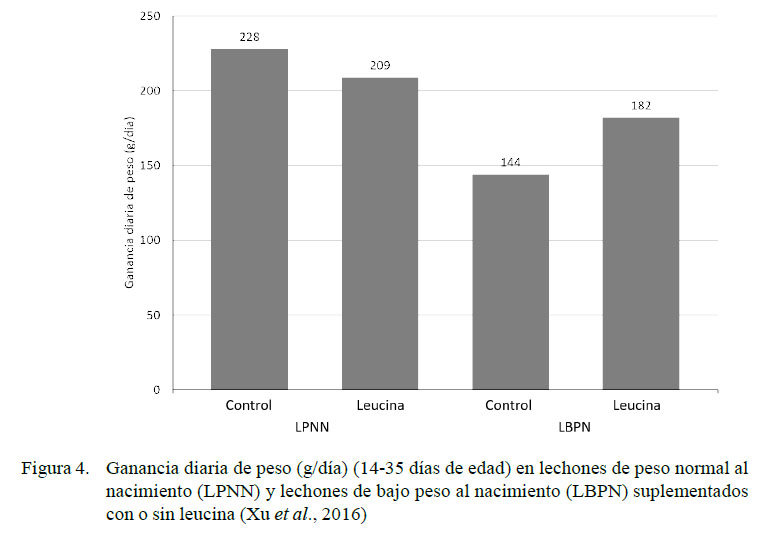
Resultados similares a los descritos con el uso de HMB-Ca se encontraron al utilizar leucina en concentración del 0.35% en la dieta de LBPN vs LPNN entre los días 14 y 35 de edad (Figura 4) (Xu et al., 2016). Los LBPN que recibieron leucina mostraron mayores consumos diarios de alimento (285±33 g/d) que los LBPN control (242±14 g/d). La administración de leucina está asociada a un incremento de la fosforilación en la vía de señalización mTOR y a una reducción de la atrofia muscular (Xu et al., 2016).
CONCLUSIONES
No se ha llegado a demostrar que los lechones de bajo peso al nacimiento puedan alcanzar el comportamiento productivo de lechones de peso normal al nacimiento; sin embargo, se ha demostrado que interviniendo a través de alimentación y nutrición se pueden mejorar los resultados productivos de los LBPN.
Literatura citada
1. Alvarenga AL, Chiarini-Garcia H, Cardeal PC, Moreira LP, Foxcroft GR, Fontes DO, Almeida FR. 2013. Intrauterine growth retardation affects birthweight and postnatal development in pigs, impairing muscle accretion, duodenal mucosa morphology and carcass traits. Reprod Fert Develop 25: 387-395. doi: 10.1071/RD12021 [ Links ]
2. Anthony JC, Anthony TG, Kimball SR, Vary TC, Jefferson LS. 2000. Orally administered leucine stimulates protein synthesis in skeletal muscle of postabsorptive rats in association with increased eIF4F formation. J Nutr 130: 139-145. doi: 10.1093/jn/130.2.139 [ Links ]
3. Boutry C, El-Kadi SW, Suryawan A, Wheatley SM, Orellana RA, Kimball SR, Nguyen HV, et al. 2013. Leucine pulses enhance skeletal muscle protein synthesis during continuous feeding in neonatal pigs. Am J Physiol-Endoc M 305: 620-631. doi: 10.1152/ajpendo.-00135.2013
4. Campos PH, Silva BA, Donzele JL, Oliveira RF, Knol EF. 2012. Effects of sow nutrition during gestation on within-litter birth weight variation: a review. Animal 6: 797-806. doi: 10.1017/S1751731111002242 [ Links ]
5. Chatelais L, Jamin A, Gras-Le Guen C, Lallès JP, Le Huërou-Luron I, Boudry G. 2011. The level of protein in milk formula modifies ileal sensitivity to LPS later in life in a piglet model. Plos One 6: e19594. doi: 10.1371/journal.-pone.0019594 [ Links ]
6. Cooper JE. 1975. The use of the pig as an animal model to study problems associated with low birthweight. Lab Anim 9: 329-336. [ Links ]
7. D’Inca R, Kloareg M, Gras-Le Guen C, Le Huërou-Luron I. 2010. Intrauterine growth restriction modifies the developmental pattern of intestinal structure, transcriptomic profile, and bacterial colonization in neonatal pigs. J Nutr 140: 925-931. doi: 10.3945/jn.109.116822
8. Dong L, Zhong X, Ahmad H, Li W, Wang Y, Zhang L, Wang T. 2014. Intrauterine growth restriction impairs small intestinal mucosal immunity in neonatal piglets. J Histochem Cytochem 62: 510-518. doi: 10.1369/0022155414-532655 [ Links ]
9. Dong L, Zhong X, He J, Zhang L, Bai K, Xu W, Huang X. 2016. Supplementation of tributyrin improves the growth and intestinal digestive and barrier functions in intrauterine growthrestricted piglets. Clin Nutr 35: 399-407. doi: 10.1016/j.clnu.2015.03.002 [ Links ]
10. Dove CR. 1993. The effect of adding copper and various fat sources to the diets of weanling swine on growth performance and serum fatty acid profiles. J Anim Sci 71: 2187-2192. doi: 10.2527/1993.7182187x [ Links ]
11. Dwyer CM, Fletcher JM, Stickland NC. 1993. Muscle cellularity and postnatal growth in the pig. J Anim Sci 71: 3339-3343. doi: 10.2527/1993.711-23339x [ Links ]
12. Edelman MJ, Bauer K, Khanwani S, Tait N, Trepel J, Karp J, Van Echo D. 2003. Clinical and pharmacologic study of tributyrin: an oral butyrate prodrug. Cancer Chemoth Pharm 51: 439-444. doi: 10.1007/s00280-003-0580-5 [ Links ]
13. Embleton ND, Cooke RJ. 2005. Protein requirements in preterm infants: effect of different levels of protein intake on growth and body composition. Pediatr Res 58: 855-860. doi: 10.1203/01.PDR.0000182586.46532.7C [ Links ]
14. Foxcroft GR, Dixon WT, Novak S, Putman CT, Town SC, Vinsky MD. 2006. The biological basis for prenatal programming of postnatal performance in pigs. J Anim Sci 84: 105-112. doi: 10.2527/2006.8413_supplE105x [ Links ]
15. Frank JW, Escobar J, Suryawan A, Kimball SR, Nguyen HV, Jefferson LS, Davis TA. 2005. Protein synthesis and translation initiation factor activation in neonatal pigs fed increasing levels of dietary protein. J Nutr 35: 1374-1381. doi: 10.1093/jn/135.6.1374 [ Links ]
16. Gondret F, Lefaucheur L, Louveau I, Lebret B, Pichodo X, Le Cozler Y. 2005. Influence of piglet birth weight on postnatal growth performance, tissue lipogenic capacity and muscle histological traits at market weight. Livest Prod Sci 93: 137146. doi: 10.1016/j.livprodsci.-2004.09.009 [ Links ]
17. Handy DE, Zhang Y, Loscalzo J. 2005. Homocysteine down-regulates cellular glutathione peroxidase (GPx1) by decreasing translation. J Biol Chem 280: 15518-15525. doi: 10.1074/jbc.M5014-52200 [ Links ]
18. He J, Dong L, Xu W, Bai K, Lu C, Wu Y, Wang T. 2015. Dietary tributyrin supplementation attenuates insulin resistance and abnormal lipid metabolism in suckling piglets with intrauterine growth retardation. Plos One 10: e0136848. doi: 10.1371/journal.pone.-0136848 [ Links ]
19. Herpin P, Le Dividich J, Hulin JC, Fillaut M, De Marco F, Bertin R. 1996. Effects of the level of asphyxia during delivery on viability at birth and early postnatal vitality of newborn pigs. J Anim Sci 74: 2067-2075. doi: 10.2527/1996.7492067x [ Links ]
20. Huang RF, Yaong HC, Chen SC, Lu YF. 2004. In vitro folate supplementation alleviates oxidative stress, mitochondria-associated death signalling and apoptosis induced by 7ketocholesterol. Brit J Nutr 92: 887-894. doi: 10.1079/BJN20041259 [ Links ]
21. Jamin A, Séve B, Thibault JN, Floc’h N. 2011. Accelerated growth rate induced by neonatal high-protein milk formula is not supported by increased tissue protein synthesis in low-birthweight piglets. J Nutr Metabolism 2012: 545341. doi: 10.1155/2012/545341
22. Lim K, Armitage JA, Stefanidis A, Oldfield BJ, Black MJ. 2011. IUGR in the absence of postnatal «catch-up» growth leads to improved whole body insulin sensitivity in rat offspring. Pediatr Res 70: 339-344. doi: 10.1203/PDR.0b013e31822a65a3 [ Links ]
23. Liu C, Lin G, Wang X, Wang T, Wu G, Li D, Wang J. 2013. Intrauterine growth restriction alters the hepatic proteome in fetal pigs. J Nutr Biochem 24: 954-959. doi: 10.1016/j.jnutbio.-2012.06.016 [ Links ]
24. Liu J, Yao Y, Yu B, Mao X, Huang Z, Chen D. 2012. Effect of folic acid supplementation on hepatic antioxidant function and mitochondrial-related gene expression in weanling intrauterine growth retarded piglets. Livest Sci 146: 123-132. doi: 10.1016/j.livsci.2012.02.027 [ Links ]
25. Lu H, Su S, Ajuwon KM. 2012. Butyrate supplementation to gestating sows and piglets induces muscle and adipose tissue oxidative genes and improves growth performance. J Anim Sci 90: 430-432. doi: 10.2527/jas.53817 [ Links ]
26. Magee TR, Han G, Cherian B, Khorram O, Ross MG, Desai M. 2008. Down-regulation of transcription factor peroxisome proliferator-activated receptor in programmed hepatic lipid dysregulation and inflammation in intrauterine growth–restricted offspring. Am J Obstet Gynecol 199: 271.e1-5. doi: 10.1016/j.ajog.2008.05.022
27. Martineau GP, Badouard B. 2009. Managing highly prolific sows. In: Proc London Swine Conference. London. [ Links ]
28. Michiels J, De Vos M, Missotten J, Ovyn A, De Smet S, Van Ginneken C. 2013. Maturation of digestive function is retarded and plasma antioxidant capacity lowered in fully weaned low birth weight piglets. Brit J Nutr 109: 6575. doi: 10.1017/S0007114512000670 [ Links ]
29. Milligan BN, Fraser D, Kramer DL. 2002. Within-litter birth weight variation in the domestic pig and its relation to preweaning survival, weight gain, and variation in weaning weights. Livest Prod Sci 76: 181-191. doi: 10.1016/S0301-6226(02)00012-X [ Links ]
30. Moore DT, Ferket PR, Mozdziak PE. 2005. The effect of early nutrition on satellite cell dynamics in the young turkey. Poultry Sci 84: 748-756. doi: 10.1093/ps/84.5.748 [ Links ]
31. Nissen S, Faidley TD, Zimmerman DR, Izard R, Fisher CT. 1994. Colostral milk fat percentage and pig performance are enhanced by feeding the leucine metabolite β-hydroxy-β-methyl butyrate to sows. J Anim Sci 72: 23312337. doi: 10.2527/1994.7292331x [ Links ]
32. Pardo CE, Bérard J, Kreuzer M, Bee G. 2013. Intrauterine crowding impairs formation and growth of secondary myofibers in pigs.Animal 7: 430-438. doi: 10.1017/S1751731112001802 [ Links ]
33. Park KS, Kim SK, Kim MS, Cho EY, Lee JH, Lee KU, Lee HK. 2003. Fetal and early postnatal protein malnutrition cause long-term changes in rat liver and muscle mitochondria. J Nutr 133: 30853090. doi: 10.1093/jn/133.10.3085 [ Links ]
34. Quesnel H, Brossard L, Valancogne A, Quiniou N. 2008. Influence of some sow characteristics on within-litter variation of piglet birth weight. Animal 2: 1842-1849. doi: 10.1017/S17517311-0800308X [ Links ]
35. Quiniou N, Dagorn J, Gaudré D. 2002. Variation of piglets’ birth weight and consequences on subsequent performance. Livest Prod Sci 78: 63-70. doi: 10.1016/S0301-6226(02)00181-1
36. Rehfeldt C, Kuhn G. 2006. Consequences of birth weight for postnatal growth performance and carcass quality in pigs as related to myogenesis 1. J Anim Sci 84: 113-123. doi: 10.2527/2006.8413_supplE113x [ Links ]
37. Schoknecht PA, Ebner S, Skottner A, Burrin DG, Davis TA, Ellis K, Pond WG. 1997. Exogenous insulin-like growth factor-I increases weight gain in intrauterine growth-retarded neonatal pigs. Pediatr Res 42: 201-207. doi: 10.1203/00006450-199708000-00012 [ Links ]
38. Soothill RW, Ajayi RA, Nicolaides KN. 1992. Fetal biochemistry in growth retardation. Early Hum Dev 29: 91-97. doi: 10.1016/0378-3782(92)90062-L [ Links ]
39. Thieriot-Prevost G, Boccara JF, Francoual C, Badoual J, Job JC. 1988. Serum insulin-like growth factor 1 and serum growth-promoting activity during the first postnatal year in infants with intrauterine growth retardation. Pediatr Res 24: 380-383. doi: 10.1203/00006450-198809000-00020 [ Links ]
40. Thureen P, Heird WC. 2005. Protein and energy requirements of the preterm/ low birthweight (LBW) infant. Pediatr Res 57: 95-98. doi: 10.1203/01.PDR.-0000160434.69916.34 [ Links ]
41. Tuchscherer M, Puppe B, Tuchscherer A, Tiemann U. 2000. Early identification of neonates at risk: traits of newborn piglets with respect to survival. Theriogenology 54: 371-388. doi: 10.1016/S0093-691X(00)00355-1 [ Links ]
42. Wan H, Zhu J, Su G, Liu Y, Hua L, Hu L, Lin Y. 2016. Dietary supplementation with β-hydroxy-β-methylbutyrate calcium during the early postnatal period accelerates skeletal muscle fibre growth and maturity in intrauterine growth-retarded and normalbirth-weight piglets. Brit J Nutr 115: 13601369. doi: 10.1017/S0007114516000465 [ Links ]
43. Wang T, Huo YJ, Shi F, Xu RJ, Hutz RJ. 2005. Effects of intrauterine growth retardation on development of the gastrointestinal tract in neonatal pigs. Neonatology 88: 66-72. doi: 10.1159/000084645 [ Links ]
44. Wang X, Ou D, Yin J, Wu G, Wang J. 2009a. Proteomic analysis reveals altered expression of proteins related to glutathione metabolism and apoptosis in the small intestine of zinc oxidesupplemented piglets. Amino Acids 37: 209-218. doi: 10.1007/s00726-009-0242-y [ Links ]
45. Wang X, Wu W, Lin G, Li D, Wu G, Wang J. 2009b. Temporal proteomic analysis reveals continuous impairment of intestinal development in neonatal piglets with intrauterine growth restriction. J Proteome Res 9: 924-935. doi: 10.1021/pr900747d [ Links ]
46. Wheatley SM, El-Kadi SW, Suryawan A, Boutry C, Orellana RA, Nguyen HV, Davis SR, et al. 2013. Protein synthesis in skeletal muscle of neonatal pigs is enhanced by administration of hydroxy- -methylbutyrate. Am J Physiol-Endoc M 306: 91-99. doi: 10.1152/ajpendo.00500.2013 [ Links ]
47. Wu G, Bazer FW, Wallace JM, Spencer TE. 2006. Board-invited review: intrauterine growth retardation: implications for the animal sciences. J Anim Sci 84: 2316-2337. doi: 10.2527/jas.2006-156 [ Links ]
48. Xu RJ, Mellor DJ, Birtles MJ, Reynolds GW, Simpson HV. 1994. Impact of intrauterine growth retardation on the gastrointestinal tract and the pancreas in newborn pigs. J Pediatric Gastroenterol Nutr 18: 231-240. doi: 10.1097/00005176-199402000-00018 [ Links ]
49. Xu W, Bai K, He J, Su W, Dong L, Zhang L, Wang T. 2016. Leucine improves growth performance of intrauterine growth retardation piglets by modifying gene and protein expression related to protein synthesis. Nutrition 32: 114-121. doi: 10.1016/j.nut.2015.07.003 [ Links ]
50. Yang H, Fu D, Shao H, Kong X, Wang W, Yang X, Ying Y. 2012. Impacts of birth weight on plasma, liver and skeletal muscle neutral amino acid profiles and intestinal amino acid transporters in suckling Huanjiang mini-piglets. Plos One 7: e50921. doi: 10.1371/journal.pone.-0050921 [ Links ]
51. Yates DT, Macko AR, Nearing M, Chen X, Rhoads RP, Limesand SW. 2012. Developmental programming in response to intrauterine growth restriction impairs myoblast function and skeletal muscle metabolism. J Pregnancy 2012: 631038. doi: 10.1155/2012/631038 [ Links ]
52. Zhang H, Chen Y, Li Y, Yang L, Wang J, Wang T. 2014. Medium-chain TAG attenuate hepatic oxidative damage in intra-uterine growth-retarded weanling piglets by improving the metabolic efficiency of the glutathione redox cycle. Brit J Nutr 112: 876-885. doi: 10.1017/S000711451400155X [ Links ]
Recibido: 17 de agosto de 2018
Aceptado para publicación: 28 de marzo de 2019