Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.30 no.2 Lima abr./jun. 2019
http://dx.doi.org/10.15381/rivep.v30i2.16100
ARTÍCULOS PRIMARIOS
Efecto de cinco niveles de goma de tara sobre el comportamiento productivo, mineralización ósea y morfometría intestinal en pollos de carne
Effect of five levels of tara gum on the productive performance, bone mineralization and intestinal morphology in broilers
Otto Zea M.1,2, Daniel Huaringa E.1, Liliana Jiménez H.1, Jorge Pérez C.1, Josselyn Serrano G.1, Ivan Meza Q.1, Nataly Bernuy O.1, Carlos Vílchez P.1.
1 Departamento Académico de Nutrición, Facultad de Zootecnia, Universidad Nacional Agraria La Molina, Lima, Perú
2 E-mail: angelozmz@hotmail.com
RESUMEN
El estudio tuvo por objetivo evaluar el efecto de cinco niveles de goma de tara sobre el comportamiento productivo, mineralización ósea, niveles de glucosa y colesterol y morfometría intestinal en pollos de 1 a 21 días de edad. Se emplearon 200 pollos BB machos de la Línea Cobb500, distribuidos en cinco tratamientos con cuatro repeticiones y 10 animales por repetición: T1, dieta basal sin goma de tara (control); T2, T3, T4 y T5, dieta basal con goma de tara (0.05, 0.10, 0.15 y 0.20%, respectivamente). Todas las dietas contuvieron 3072 kcal ME/kg y 20.5% de proteína cruda. El alimento, en forma de harina, y el agua fueron ofrecidos ad libitum. Los datos fueron analizados bajo un diseño completamente randomizado usando el procedimiento ANOVA y el test de Duncan para comparación de medias. Los resultados mostraron que el peso corporal y ganancia de peso fueron mejores en T3 que en T4 y T5 (p<0.05), tanto en la segunda como en la tercera semana de edad. Asimismo, la goma de tara influyó en la profundidad de cripta y en la relación altura de vellosidad y cripta en el yeyuno comparado al grupo control. No se encontró diferencia estadística en indicadores de mineralización ósea, niveles de colesterol o glucosa. Se concluye que la adición de goma de tara al 0.1% favorece al peso vivo, la ganancia de peso y la morfología intestinal en pollos de carne.
Palabras clave: goma de tara; prebiótico; pollos de carne; morfometría ósea; intestino
ABSTRACT
The aim of this study was to determine the effect of five levels of tara gum on productive performance, bone mineralization, glucose and cholesterol levels, and intestinalmorphometryin broilersfrom1to21 daysofage.Atotalof200 male BBcobsofthe Cobb500 line were used, distributed in five treatments with four repetitions and 10 animals per repetition: T1, basal diet without tara gum (control); T2, T3, T4 and T5, basal diet with tara gum (0.05, 0.10, 0.15 and 0.20% respectively). All diets contained 3072 kcal ME/kg and 20.5% crude protein. The feed meal and water were offered ad libitum. The data were analyzed under a completely randomized design using the ANOVA procedure and the Duncan test for comparison of means. The results showed that body weight and bodyweight gain were better in T3 than in T4 and T5 (p<0.05), both in the second and in the third week of age. Also, tara gum influenced the depth of the crypt and the height of the villus and crypt in the jejunum compared to the control group. No statistical difference was found in indicators of bone mineralization, cholesterol or glucose levels. It is concluded that the addition of 0.1% tara gum favors body weight, body-weight gain and intestinal morphology in broilers.
Key words: tara gum; prebiotic; broilers; bone morphometry; gut
INTRODUCCIÓN
El empleo de antibióticos en la dieta de pollos de carne para mantener la salud intestinal ha sido práctica rutinaria. No obstante, en la actualidad se viene prohibiendo su uso por generar resistencia a los antibióticos en el humano. Como alternativas a los antibióticos, se viene promoviendo el uso de prebióticos en base a fibra dietaria. Tradicionalmente, la fibra dietaria ha sido considerada un diluyente de la dieta y, frecuentemente, un factor antinutricional. Sin embargo, moderadas cantidades de fibra pueden mejorar el desarrollo de órganos, la producción de enzimas y la digestibilidad de nutrientes en pollos (Mateos et al., 2012).
Los alimentos fibrosos pueden ser utilizados como prebióticos debido a que dichos ingredientes alimenticios fermentables no digeribles promueven el crecimiento de microorganismos benéficos en el intestino delgado y promocionan la salud a través de cambios benéficos en la actividad del microbioma intestinal (McCabe et al., 2015).
La fermentabilidad y solubilidad de diferentes tipos de «fibra» se relaciona de modo cercano a su composición química (por ejemplo, la presencia de celulosa, hemicelulosa, gomas, almidón resistente, lignanos y pectinas), pudiendo dividirse la fibra en soluble e insoluble (Eswaran et al., 2013).
Además de los efectos beneficiosos mencionados, en los últimos años ha venido cobrando interés el efecto de la fibra sobre la mineralización de los huesos.Al respecto, algunos trabajos han demostrado que carbohidratos no digestibles pueden mejorar la absorción de calcio y posiblemente de otros minerales. Esto se explica dado que la fermentación de carbohidratos que escapan de la hidrólisis enzimática en el intestino delgado produce ácidos grasos de cadena corta (AGCC), tales como el acetato y el butirato, principalmente en el colon, disminuyendo el pH intestinal. Esto a su vez provoca un incremento en la concentración de calcio soluble e ionizado y, en cambio, un incremento en la difusión pasiva de este mineral (Pérez-Conesa, 2007).
Entre los prebióticos existentes que pueden cumplir un efecto benéfico al mantener la salud e integridad intestinal, así como una mineralización ósea adecuada mediante el incremento las bacterias benéficas de la flora intestinal, se encuentran las gomas constituidas por fibra soluble en base a βgalactomananos. Entre estas, destacan la goma de guar (polisacárido de reserva nutricional de las semillas de Cyamopsis tetragonoloba) y la goma de tara (Weaver et al., 2010).
La goma de tara, también denominada algarrobo peruano, es un tipo de polvo de color blanco o beige obtenido a través de la molienda del endospermo de la semilla del árbol de la Caesalpinea spinosa, el cual es un árbol nativo del Perú. Su fibra soluble tiene como base los β-galactomananos (Wu et al., 2015). Su contenido de taninos y la tasa manosa:galactosa hace necesaria su investigación antes de incorporarla como aditivo en la dieta de pollos de carne. Así por ejemplo, la tasa manosa galactosa de 3:1 es diferente a otras fibras solubles como la goma de guar (2:1) y la goma de algarroba (4-4.5:1) (Wu et al., 2015). Basado en estos conceptos, el propósito del presente estudio fue evaluar el efecto de la goma de tara sobre la salud intestinal y la mineralización ósea en pollos parrilleros.
MATERIALES Y MÉTODOS
El estudio se llevó a cabo en el Laboratorio de Investigación en Nutrición yAlimentación de Aves (LINAA) de la Universidad Nacional Agraria de La Molina (UNALM), Lima. Se emplearon 200 pollos BB de la Línea Cobb 500, machos de un día de edad. Las aves fueron distribuidas al azar en 5 tratamientos de 40 pollos cada uno. Cada tratamiento constó de 4 repeticiones con 10 pollos por repetición. El tiempo de crianza abarcó desde el primer día de edad hasta los 21 días.
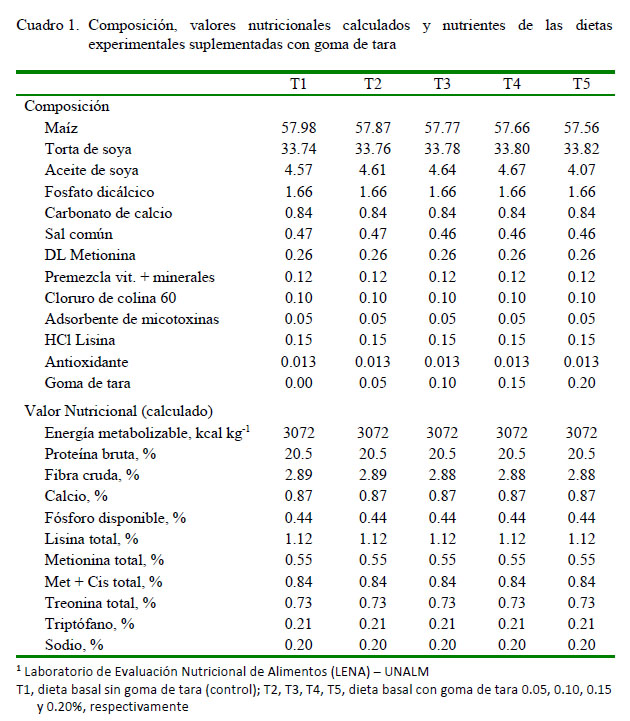
Las aves estuvieron alojadas en dos jaulas metálicas de malla galvanizada (baterías) de cinco pisos, con dos divisiones por piso, y con comederos y bebederos lineales tipo canaleta en la parte externa. Los tratamientos fueron: T1, dieta basal sin goma de tara (control) y T2, T3, T4 y T5, dieta basal con goma de tara 0.05, 0.10, 0.15 y 0.20%, respectivamente. La dieta experimental fue formulada siguiendo las especificaciones nutricionales de la Línea Cobb 500 (Cobb-Vantress, 2012). La composición y valor nutricional calculado de la dieta basal se muestra en el Cuadro 1.
Se registró semanalmente el peso vivo, consumo de alimento y conversión alimenticia, y se registró la mortalidad. El peso vivo y el consumo de alimento se midieron utilizando una balanza digital de plataforma con precisión de 0.01 g. El consumo voluntario de alimento se determinó restando la cantidad de alimento ofrecido de la suma del residuo del alimento y su desperdicio. La conversión alimenticia se determinó dividiendo el consumo del alimento entre la ganancia de peso. Al final del periodo de crianza (21 d) se sacrificaron 20 animales por tratamiento para la determinación del colesterol, glucosa, morfometría ósea de la tibia y evaluación de la citomorfología intestinal.
Las tibias izquierdas fueron retiradas, introducidas en mallas mosquiteras e identificadas. Dicho envoltorio fue sometido a agua hirviendo por 15 min para remover el tejido blando del hueso (Applegate y Lilburn, 2002), procedimiento que no altera el contenido mineral ni la densidad del hueso y permite retirar el 80% de la grasa contenida en los huesos (Almeida y Bruno, 2008). Los tejidos y cartílagos fueron retirados manualmente siguiendo el procedimiento de Baumel et al. (1993). Los huesos fueron limpiados con papel toalla y colocados en un recipiente plástico. Antes de realizar las mediciones, los huesos fueron secados a temperatura ambiente por una semana hasta alcanzar un peso constante.
Se determinó el largo, volumen y peso de las tibias, así como el diámetro de la diáfisis (García y Dale, 2006), donde se determinó el diámetro latero-lateral (DLL) y el diámetro cráneo-caudal (DCC), ambos en el 50% del largo de la diáfisis (Kocabagli, 2001; Applegate y Lilburn, 2002). Los indicadores de mineralización de la tibia fueron: densidad ósea (peso/volumen) (Rath et al., 2000), índice de Seedor (Seedor et al., 1991), índice de Quetelet (Rutten et al., 2002; Martínez, 2012) e índice de robusticidad (Kokabagli, 2001; Martínez, 2012). Para medir el peso de la tibia (mg) se empleó una balanza analítica con una aproximación de 0.1 mg.
Las densidades óseas de la tibia de las aves se determinaron mediante la volumetría del hueso (Sato, 1995; Zhang et al., 1997; Quarentelli et al., 2007), considerándose como densidad ósea a la masa de material orgánico e inorgánico en el hueso por unidad de volumen de este (Rath et al., 2000). Se calculó dividiendo el peso del hueso (mg) entre el volumen (cm3). Para la determinación del volumen de los huesos se emplearon probetas graduadas con capacidad de 10 y 25 cm3 y con una aproximación de 0.2 y 0.5 cm3, respectivamente. El largo (mm), diámetro de diáfisis (mm) e índice de forma (mm) de las tibias fueron medidos empleando un vernier Uyustools profesional con una capacidad para 15 cm y con una aproximación de 0.05 mm. El índice de Seedor se determinó dividiendo el peso del hueso (mg) entre su largo (mm). El Índice de masa corporal o de Quetelet se obtuvo dividiendo el peso del hueso (mg) entre la longitud al cuadrado de este (mm2). El índice de robusticidad se obtuvo dividiendo el largo del hueso (cm) entre el peso (g) elevado a la potencia 1/3.
Las muestras de sangre (10 µl) fueron tomadas a los 21 días, en las cinco aves seleccionadas previas al sacrificio, de la vena del ala en la mañana con las aves en ayuno. Los niveles de colesterol fueron determinados con el medidor de colesterol Mission® con una sensibilidad para colesterol de 100-500 mg/dl. Los niveles de glucosa fueron determinados con el medidor ACCU-CHEK (Roche) con una sensibilidad de 10 a 600 mg/dl.
Para las mediciones citomorfométricas se colectó un segmento del yeyuno (2 cm), a 8 cm antes del divertículo de Meckel. Las muestras fueron guardadas en formol al 10% y remitidas al Laboratorio de Patología de la UNALM. Las muestras fueron procesadas siguiendo los métodos histológicos convencionales (fijación con formol al 10%, deshidratación/aclaramiento, inclusión en parafina, cortes al micrótomo y tinción con hematoxilina y eosina). Las mediciones se hicieron siguiendo una adaptación del protocolo de evaluación utilizado por de Oliveira et al. (2000), que consistió en colocar dos cortes seriados longitudinales en lugar de cuatro y en realizar 30 mediciones citomorfo-métricas como mínimo por lámina histológica.
La altura de vellosidad fue la distancia tomada a partir de la región basal, que coincide con la porción superior de las criptas hasta el ápice de la vellosidad. El grosor de las vellosidades fue medido en el punto medio de cada vellosidad. La medida profundidad de cripta es la distancia tomada desde la región basal de cada vellosidad hasta la parte basal superior de la musculatura lisa del intestino. La relación altura de vellosidad y profundidad de cripta resultó de la división de ambas magnitudes. El área de la vellosidad fue calculada usando el software Leica.
El número de células caliciformes fue la cuantificación total de estas células en cada una de las vellosidades seleccionadas. Por último, el promedio de las mediciones citomorfométricas de veinte láminas histológicas fue el promedio de estas magnitudes para cada tratamiento. El microscopio óptico contaba con un ocular micrométrico. Las mediciones de altura y ancho de las vellosidades intestinales y profundidad de cripta se hicieron a 100x y el contaje de células caliciformes a 400x. El cálculo de las mediciones se realizó utilizando un factor de corrección, multiplicando el factor del objetivo (0.010) por el número de líneas que abarca el tamaño del ocular micrométrico por 1000, dando el valor en micras (µm). Con los resultados se calculó la relación altura de vellosidad y profundidad de cripta y el área de vellosidad.
Se empleó un diseño completamente al azar con cinco tratamientos y cuatro repeticiones por tratamiento. El análisis de varianza se llevó a cabo usando el programa Statistical Analysis System (SAS, 2000) y la comparación de medias se realizó utilizando la prueba de Duncan.
RESULTADOS Y DISCUSIÓN
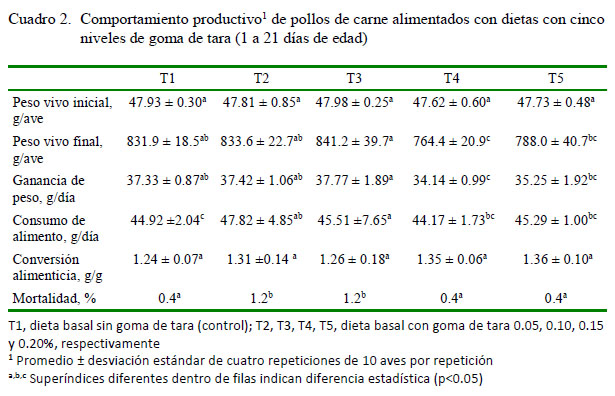
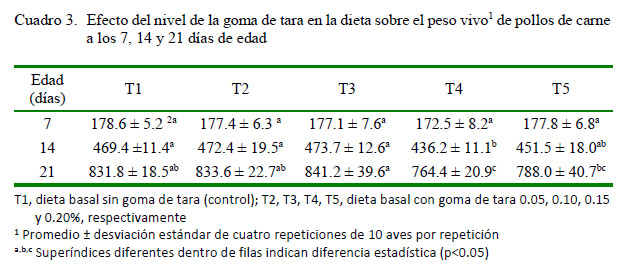
En el Cuadro 2 se muestran los efectos de los niveles de goma de tara sobre el comportamiento productivo de pollos de carne. Los tratamientos dietarios no afectaron significativamente la conversión alimenticia. El peso vivo final, el consumo de alimento acumulado y la ganancia de peso fueron significantemente mejores en las aves del T3 con relación al T4 y T5, pero similares a T2 y T1; sin embargo, la conversión alimenticia fue similar en todos los grupos. Las diferencias y similitudes en peso final se mantuvieron tanto en la segunda como en la tercera semana (Cuadro 3).
Los resultados concuerdan con el estudio de Brufau et al. (2015), quienes utilizando β-galactomananos provenientes de goma de duraio y goma de cassia (0.1%) en pollos desafiados con Salmonella enterica serovar enteritidis no encontraron diferencias significativas en peso vivo, ganancia de peso diario ni conversión alimenticia entre el control y los grupos suplementados en pollos a los 23 días de edad. No obstante, en el presente estudio, las aves suplementadas con 0.15% (T4) y 0.20% (T5) de goma de tara presentaron efectos negativos sobre los parámetros productivos. Por otro lado, Maissonier et al. (2003) encontraron una merma en la ganancia de peso en pollos suplementados con goma de guar (0.5%).
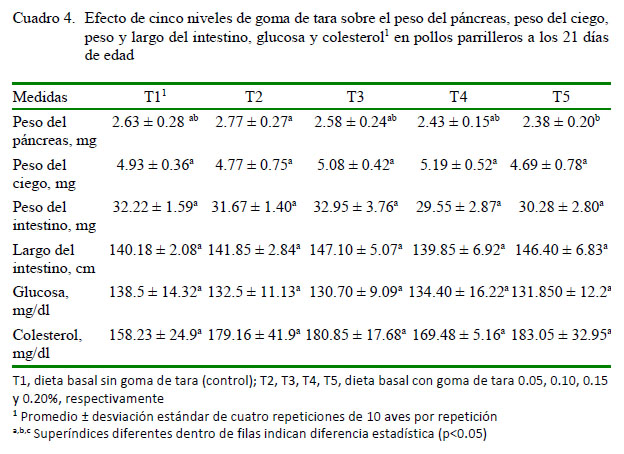
No se encontraron diferencias estadísticas para las variables peso del páncreas, peso del ciego, peso y largo del intestino, glucosa o colesterol (Cuadro 4). Estos datos no concuerdan con Mateos et al. (2012), quienes señalan que las aves responden rápidamente a cambios en el contenido de fibra modificando la longitud del intestino y el peso de órganos, así como también la tasa de pasaje a través de diferentes segmentos del tracto gastrointestinal. Por otro lado, en humanos se conoce que la fibra dietaria tiene un efecto protector en contra de un rango de problemas metabólicos y enfermedades, incluyendo el control de problemas de constipación, obesidad, diabetes de tipo II, cáncer de colon, niveles de glucosa sanguínea y enfermedades cardiovasculares (Caricilli y Saad, 2014).
Los niveles esperados de colesterol total en pollos se encuentran entre 87 y 192 mg/100 ml (promedio: 140 mg/100 ml), mientras que los niveles de colesterol libre (sin esterificar) se encuentran en el rango de 27 y 199 mg/100 ml (promedio: 73.3 mg/100 ml) (Meluzzi et al., 1992). En el presente estudio el promedió para colesterol total fue de 173.735 ± 36.65 mg/dl, sin diferencia estadística entre tratamientos. Estos resultados concuerdan con Abdel-Raheem yAbd-Allah (2011) quienes para la etapa de 1 a 21 días de edad no encontraron diferencias estadísticas para los niveles de colesterol total entre el control (148.3 mg/dl) y dietas conteniendo prebióticos (manano oligosacáridos; 140.6 mg/ dl) y probiótico (Sacharomyces cerevisae; 144.5 mg/dl); no obstante, hubo diferencias para el periodo 22-42 días de edad. Cabe señalar que el pollo, al igual que el humano, puede presentar ateroesclerosis por lo que niveles elevados de colesterol pueden ser considerados dañinos (Ayala et al., 2005).
Los niveles de glucosa tampoco presentaron diferencia estadística entre tratamientos. Estos resultados difieren de los reportados por Al-Kassie et al. (2008) quienes encontraron reducción en los niveles de colesterol y glucosa en pollos en relación al grupo control (196.83 mg/dl y 219.67 mg/dl; colesterol y glucosa respectivamente) para pollos suplementados con un probiótico (Aspergillus niger) o un prebiótico (Taraxacum officinale), encontrando valores de 186.5 ± 3.2 y 199.0 ± 5.98 mg/dl para colesterol y glucosa en el caso de A. niger y 183.5 ± 4.40 y 189.5 ± 3.70 mg/dl para Taraxacum officinale. Los mayores niveles de colesterol y glucosa en el experimento de Al-Kassie et al. (2008) con relación a los valores mostrados como normales por Meluzzi et al., (1992) se explicarían por la diferencia en el contenido de energía de las dietas.
La tibia, particularmente al final de la epífisis, ha sido ampliamente estudiada debido a la sensibilidad celular a numerosas deficiencias en la dieta (Leach y Lilburn, 1992) y a su alta tasa de crecimiento en comparación con otros huesos largos (Onyango et al., 2003); además de ser el hueso más largo y el que tiene la tasa de crecimiento más alta en comparación con el fémur y el metatarso (Uculmana et al., 2018).
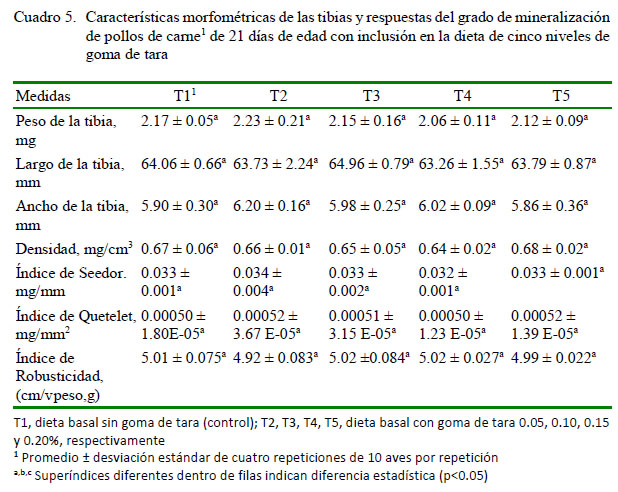
En el Cuadro 5 se muestran los efectos del nivel de goma de tara sobre el peso, ancho y largo de la tibia, Índice de Seedor, Índice de Quetelet e Índice de Robusticidad. En el presente estudio, no se encontró diferencia estadística entre las características morfométricas de los huesos y los indicadores de mineralización ósea en los tratamientos. En otros estudios, como el de Coudray et al. (1997) se encontró que la ingestión de inulina mejora significativamente la absorción aparente y el balance de calcio. Además, la fibra de azúcar de remolacha resultó en un significativo incremento en la ingesta y balance de calcio, sin modificación en su absorción aparente.
Con respecto de las variables morfométricas y los indicadores de mineralización ósea, Uculmana et al. (2018) tampoco encontraron diferencia estadística en tales variables en dietas con diferentes relaciones de calcio y fósforo disponible, lo que se explica debido a que el porcentaje de cenizas es la variable con mayor sensibilidad. En el presente estudio, si bien el peso y ancho de la tibia fue mayor en las aves de T2 y el largo de la tibia en aves de T3, estadísticamente no hubo diferencias entre los grupos experimentales (Cuadro 5). Los valores reportados de largo de la tibia son menores a los reportados por Applegate y Lilburn (2002) de 67.20 mm. De igual forma, estos autores encontraron un ancho de la tibia de 5.47 mm.
La densidad del hueso es un importante indicador para conocer el estado de salud del esqueleto (Almeida Paz et al., 2008) y puede ser medida de forma directa, como en el presente estudio, o empleando métodos que permiten su estimación, como la absorciometría de rayos-X de energía dual (Angel et al., 2006). No se encontró diferencia estadística para el valor de densidad ósea o los Indices de Seedor, Quetelet o Robusticidad (Cuadro 5). Así mismo, en el estudio en modelos humanos y animales de Cámara-Martos yAmaro-López (2002) se encontró que la fibra soluble proveniente de la goma de guar o la pectina no tenían efecto significativo sobre la biodisponibilidad mineral.
En un estudio realizado con probióticos sobre sus efectos en la mineralización ósea, Sadegui et al. (2014) encontraron efectos favorables en los tratamientos que contenían Bacillus subtilis sobre los contenidos de ceniza y calcio en el hueso en pollos desafiados con Salmonella enteritidis. Al respecto, es conocido que los β-galactomananos pueden ligarse a ciertos agentes infecciosos como la Salmonella, debido a que las cadenas de mananos se pueden unir a las fimbrias de tipo I presente en estas bacterias y por tanto evitar su colonización en el tracto gastrointestinal (Oyofo et al., 1989). Los lipopolisacáridos de las bacterias gramnegativas pueden generar inflamación y desmineralización ósea al atravesar la barrera intestinal mediante la estimulación de la secreción de citosinas inflamatorias por parte del sistema inmune como el factor de necrosis tumoral (TNF-α), la interleucina 1 (IL-1) e interleucina 6 (IL6) (Aliya et al., 2015). Por lo tanto, mantener la salud intestinal, a través de la manipulación de la microbiota intestinal es un objetivo adicional al agregar aditivos que contengan fibra. La goma de tara puede presentar efecto en salud ósea en condiciones de desafío; no obstante, en el presente estudio no se ha determinado su efecto sobre la mineralización ósea en pollos de carne.
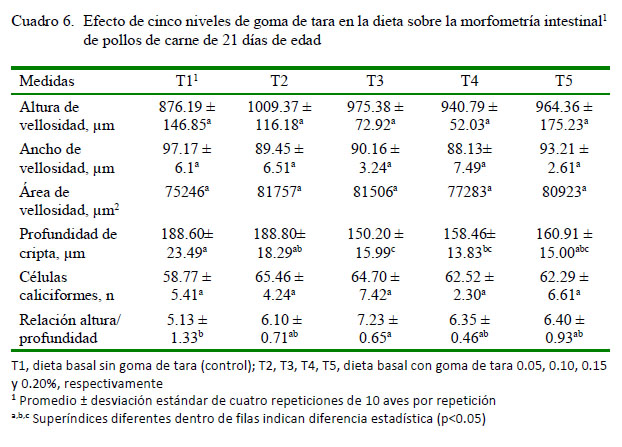
Se encontró diferencia estadística para profundidad de cripta y la relación altura:profundidad de cripta (Cuadro 6; p<0.05). Las aves de T3 presentaron mayor relación altura:profundidad de cripta en relación a T1 y similar a T2, T4 y T5.Asu vez T2, T4, y T5 fueron similares al control T1. Al respecto, promedios bajos, diferentes al encontrado en el presente estudio, fueron hallados por Choct (2009) en pollos desafiados con C. perfringens y estuvieron relacionados con pobre crecimiento y depresión de consumo.
Con relación a la profundidad de cripta, los resultados coinciden con Savage et al. (1997), observándose que T3 tuvo menor profundidad de cripta que T2 y T1 (Cuadro 6; p<0.05). No obstante, difieren con Zea y Vílchez (2014), quienes encontraron diferencias relacionadas a los parámetros productivos en pollos asociadas con altura y área de las vellosidades del yeyuno, más no con la profundidad de cripta. Al respecto, cambios en la morfología intestinal, tales como vellosidades más cortas y criptas más profundas, han sido asociados con la presencia de toxinas. Un acortamiento de las vellosidades disminuye el área de la superficie para la absorción de nutrientes (Ao et al., 2008). En este sentido, Cook y Bird (1973) reportaron vellosidades más cortas y criptas más profundas cuando el recuento de bacterias patógenas se incrementa en el tracto gastrointestinal, la cual resulta en menor absorción y más células secretoras (Schneeman, 1982). Savage et al. (1997) observaron que la inclusión de manano-oligosacáridos (MOS) incrementó el número de células caliciformes en el duodeno y yeyuno, elevó la altura de las vellosidades y redujo la profundidad de la cripta en pollos.Asimismo, Ao et al. (2008) mostraron una conexión entre la morfometría intestinal, resistencia a las enfermedades y performance en pollos broilers desafiados con Clostridium perfringens; mientras que Choct (2009) encontró que el crecimiento pobre, depresión en la conversión del alimento y alta tasa de mortalidad en la enteritis necrótica coincidía con una tasa baja en la relación vellosidad y cripta en pollos broilers desafiados con C. perfringens.
CONCLUSIONES
El peso vivo y la ganancia de peso fueron significativamente mayores en pollos con dietas suplementadas con goma de tara (0.1%) con relación a pollos con dietas con 0.15 y 0.20% de goma de tara, tanto en la segunda como en la tercera semana de edad.
La morfometría intestinal del yeyuno, profundidad de cripta y relación altura: profundidad de cripta, fueron influenciadas significativamente por la goma de tara 0.1%.
Los niveles de goma de tara no tuvieron influencia sobre la morfometría ósea de la tibiani en los niveles de glucosa y colesterol.
LITERATURA CITADA
1. Abdel-Raheem SM, Abd-Allah SMS. 2011. The effect of single or combined dietary supplementation of mannan oligosacharide and probiotics on performance and slaughter characteristics of broilers. Int J Poult Sci 10: 854-862. doi: 10.3923/ijps.2011.854.862 [ Links ]
2. Almeida P, Bruno LDG. 2008. Bone mineral density: review. Rev Bras Cienc Avic 8: 69-73. doi: 10.1590/S1516- 635X200600020000 [ Links ]
3. Almeida ICL, Mendes A, Balog A, Vulcano LC, Ballarin AM, Almeida ICL, Takahashi SE, et al. 2008. Study on the bone mineral density of broiler suffering femoral joint degenerative lesions. Braz J Poultry Sci 10: 103-108. doi: 10.1590/S1516-635X2008000200005 [ Links ]
4. Aliya IS, Norhazilah M, Faruk RM, Amanov M, Mariam IU, Zainab M, Gotam K, et al. 2015. Bone health in metabolic endotoxemia related obesity. Interdiscip J Microinflammation 3(1). doi: 10.4172/ijm.1000129 [ Links ]
5. Al-Kassie GA, Al-Jumaa YM, Jamel YJ. 2008. Effect of probiotic (Aspergillus niger) and prebiotic (Taraxacum officinale) on blood picture and biochemical properties of broiler chicks. Int J Poultry Sci 7: 1182-1184. doi: 10.3923/ijps.2008.1182.1184 [ Links ]
6. Angel R, Saylor WW, Mitchell AD, Powers W, Applegate TJ. 2006. Effect of dietary phosphorus, phytase, and 25- hydroxycholecalciferol on broiler chicken bone mineralization, litter phosphorus, and processing yields. Poultry Sci 85: 1200-1211. doi: 10.1093/ps/85.7.1200 [ Links ]
7. Ao Z, Kocher A, Choct M. 2008. Effects of dietary additives and early feeding on the performance, gut development and immune status of broiler chickens challenged with Clostridium perfringens. Asian Austral J Anim 25: 541-551. doi: 10.5713/ajas.2011.11378 [ Links ]
8. Applegate TJ, Lilburn MS. 2002. Growth of the femur and tibia of a commercial broiler line. Poultry Sci 81: 1289-1294. doi: 10.1093/ps/81.9.1289 [ Links ]
9. Ayala I, García-Pérez B, Dómenech G, Castells MT, Valdés M. 2005. Use of the chicken as an experimental animal model in aterosclerosis. Avian Poult Biol Rev 16: 151-159. [ Links ]
10. Baumel JJ, Witmer LM, King AS, Breazile JE, Evans HE, Vanden Berge JC. 1993. Handbook of avian anatomy: nomina anatomica avium. 2nd ed. Massachusetts, USA: Nuttall Ornithological Club. 779 p. [ Links ]
11. Brufau MT, Martín-Venegas R, Guerrero- Zamora AM, Pérez-Vendrell AM, Vilà B, Brufau J, Ferrer R. 2015. Dietary β-galactomananns have beneficial effects on the intestinal morphology of chickens challenged with Salmonella enterica serovar Enteritidis. J Anim Sci 93: 238-246. doi: 10.2527/jas2014-7219. [ Links ]
12. Caricilli AM, Saad MJA. 2014. Gut microbiota composition and its effects on obesity and insulin resistance. Curr Opin Clin Nutr Metab Care 17: 312-318. doi: 10.1097/MCO.0000000000000067 [ Links ]
13. Camára-Martos F, Amaro-López MA. 2002. Influence of dietary factors on calcium bioavailability. A brief review. Biol Trace Elem Res 89: 43-52. doi: 10.1385/BTER:89:1:43 [ Links ]
14. Choct M. 2009. Managing gut health through nutrition. Brit Poultry Sci 50: 9- 15. doi: 10.1080/00071660802538632 [ Links ]
15. Cobb-Vantres. 2012. Guía de manejo del pollo de engorde. [Internet]. Disponible en: http://cobb-vantress.com/languages/guidefiles/b5043b0f-792a-448e-b4a1-4aff9a30e9eb_es.pdf [ Links ]
16. Cook RH, Bird FH. 1973. Duodenal villus area and epithelial cellular migration in conventional and germ-free chicks. Poultry Sci 52: 2276-2280. doi: 10.3382/ ps.0522276 [ Links ]
17. Coudray C, Bellanger J, Castiglia- Delavaud C, Rémésy C, Vermorel M, Rayssignuier Y. 1997. Effect of soluble or partly soluble dietary fibres supplementation on absorption and balance of calcium, magnesium, iron and zinc in healthy young men. Eur J Clin Nutr 52: 375-380. doi: 10.1038/sj.ejcn.1600417 [ Links ]
18. de Oliveira P, Murakami A, Garcia ER, Macari M, Scapinello C. 2000. Influence of antinutritional factors of leucaena (Leucaena leucocephala and Leucaena cunningan) and pigeous bean (Cajanus cajan) on the intestinal epithelium and performance of broiler chickens. Rev Bras Zootecn 29: 1759- 1769. doi: 10.1590/S1516-359820000- 00600024 [ Links ]
19. Eswaran S, Muir J, Chey WD. 2013. Fiber and functional gastrointestinal disorders. Am J Gastroenterol 108: 718- 727. doi: 10.1038/ajg.2013.63 [ Links ]
20. Garcia AR, Dale NM. 2006. Foot ash as a means of quantifying bone mineralization in chicks. J Appl Poultry Res 15: 103-109. doi: 10.1093/japr/15.1.103 [ Links ]
21. Kocabagli N. 2001. The effect of dietary phytase supplementation at different levels on tibial bone characteristics and strength in broilers. Turk J Vet Anim Sci 25: 797-802. [ Links ]
22. Leach RM, Lilburn MS. 1992. Current knowledge on the etiology of tibial dyschondroplasia in the avian species. Poultry Sci 4: 57-65. [ Links ]
23. Maisonnier S, Gomez J, Brée A, Berri C, Baéza E, Carré B. 2003. Effects of microflora status, dietary bile salts, and histomorphology in broiler chickens. Poultry Sci 82: 805-814. doi: 10.1093/ps/82.5.805 [ Links ]
24. Martínez DA. 2012. Evaluación de un producto a base de aceite esencial de orégano sobre la integridad intestinal, la capacidad de absorción de nutrientes y el comportamiento productivo de pollos de carne. Tesis de Magíster. Lima: Univ. Nacional Agraria La Molina. 268 p. [ Links ]
25. Mateos GG, Jiménez-Moreno E, Serrano MP, Lázaro R. 2012. Poultry response to high levels of dietary fiber sources varying in physical and chemical characteristics. J Appl Poultry Res 1: 156- 174. doi: 10.3382/japr.2011-00477 [ Links ]
26. McCabe L, Britton RA, Parameswaran N. 2015. Prebiotic and probiotic regulation of bone health: role of the intestine and its microbiome. Curr Osteoporos Rep 13: 363-371. doi: 10.1007/s11914-015-0292-x [ Links ]
27. Meluzzi A, Primiceri G, Giordani R, Fabris G. 1992. Determination of blood constituent’s reference values in broilers. Poultry Sci 71: 337-345. doi: 10.3382/ps.0710337
28. Onyango EM, Hester PY, Stroshine R, Adeola O. 2003. Bone densitometry as an indicator of percentage tibia ash in broiler chicks fed varying dietary calcium and phosphorus levels. Poult Sci 82: 1787-1791. doi: 10.1093/ps/82.11.1787 [ Links ]
29. Oyofo BA, Droleskey RE, Norman JO, Mollenhauer HH, Ziprin RL, Corrier DE, DeLoach JR. 1989. Inhibition by mannose of in vitro colonization of chicken small intestine by Salmonella typhimurium. Poult Sci 68: 1351-1356. doi: 10.3382/ps.0681351 [ Links ]
30. Pérez-Conesa D, López G, Gaspar R. 2007. Effects of probiotic, prebiotic and symbiotic follow-up infant formulas on large intestine morphology and bone mineralization in rats. J Sci Food Agr 87: 1059-1068. doi: 10.1002/jsfa.2812 [ Links ]
31. Quarantelli A, Cacchioli A, Romanelli S, Righi F, Alpigiani I, Gabbi C. 2007. Effects of different levels of dietary biotin on the performance and bone structure of broilers. Ital J Anim Sci 6: 5-17. doi: 10.4081/ijas.2007.5 [ Links ]
32. Rath NC, Huff GR, Huff WE, Balog JM. 2000. Factors regulating bone maturity and strength in poultry. Poultry Sci 79: 1024-1032. doi: 10.1093/ps/79.7.1024 [ Links ]
33. Rutten M, Leterrier C, Constantin P, Reiter K, Bessei W. 2002. Bone development and activity in chickens: response to reduced weight-load on legs. Anim Res 51: 327-336. doi: 10.1051/animres:2002027 [ Links ]
34. Savage TF, Zakrzewska EI, Andreasen JRJ. 1997. The effect of feeding mannan oligosaccharide supplemented diets to poults on performance and the morphology of the small intestine. Poultry Sci 76: 139 (Abstr). [ Links ]
35. [SAS] Statistical Analysis System. 1999. SAS user’s guide: statistics. Cary: SAS institute. 965 p.
36. Sato M. 1995. Comparative X-ray densitometry of bones from ovariectomized rats. Bone 17(Suppl 4): 157-162. doi: 10.1016/8756-3282(95)00288-O [ Links ]
37. Schneeman BD. 1982. Pancreatic and digestive function. In: Vahoung GV, Kritchevsky D (eds). Dietary fibre in health and disease. New York: Plenum Press. p 73-83. [ Links ]
38. Sadeghi AA. 2014. Bone mineralization of broiler chicks challenged with Salmonella enteritidis fed diet containing probiotic (Bacillus subtilis). Probiotics Antimicrob Proteins 6: 136-40. doi: 10.1007/s12602-014-9170-6 [ Links ]
39. Seedor JG, Quartuccio HA, Thompson DD. 1991. The bisphosphonate alendronate (MK-217) inhibits bone loss due to ovariectomy in rats. J Bone Miner Res 6: 339-346. doi: 10.1002/jbmr.56500-60405 [ Links ]
40. Uculmana C, Martínez-Patiño D, Zea O, Vílchez C. 2018. Efecto de la relación calcio y fósforo sobre las características óseas, porcentaje de cenizas e integridad esquelética en pollos de carne. Rev Inv Vet Perú 29: 1268-1277. doi: 10.15381/rivep.v29i4.15199 [ Links ]
41. Weaver CM, Martin BR, Story JA, Hutchinson I, Sanders L. 2010. Novel fibers increase bone calcium content and strength beyond efficiency of large intestine fermentation. J Agr Food Chem 58: 8952-8957. doi: 10.1021/jf904086d [ Links ]
42. Wu Y, Ding W, Jia L, He Q. 2015. The rheological properties of tara gum (Caesalpinia spinosa). Food Chem 168: 306-371. doi: 10.1016/j.foodchem. 2014.07.083 [ Links ]
43. Zea O, Vílchez C. 2014. Efecto de la suplementación con fuentes de cobre sobre el comportamiento productivo, morfometría intestinal y nivel de cobre hepático en pollos de carne. Rev Inv Vet Perú 25: 16-28. doi: 10.15381/ rivep.v25i1.8464 [ Links ]
44. Zhang X, Liu G, McDaniel GR, Roland DA. 1997. Responses of broiler lines selected for tibial dyschondroplasia incidence to supplementary 25-hydroxycholecalciferol. J Appl Poultry Res 6: 410-416. doi: 10.1093/japr/6.4.410 [ Links ]
Recibido: 6 de enero de 2019
Aceptado para publicación: 20 de marzo de 2019