Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.30 no.2 Lima abr./jun. 2019
http://dx.doi.org/10.15381/rivep.v30i2.16087
ARTÍCULOS PRIMARIOS
Caracterización de la prevalencia de hallazgos compatibles con hidatidosis y fertilidad de quistes hidatídicos en bovinos de una planta faenadora de la cuidad de Curicó, Chile
Characterization of the prevalence of findings compatible with hydatidosis and fertility of hydatid cysts in cattle of a slaughterhouse in Curicó, Chile
Antonio Cruzat S.1, Alex Silva G.1,2, Pamela Morales M.1,4, Hortensia Carmona H.3
1 Facultad de Recursos Naturales y Medicina Veterinaria, Escuela de Medicina Veterinaria, Universidad Santo Tomás, Talca, Chile
2 SEREMI Salud, Talca, Gobierno de Chile
3 Servicio Agrícola y Ganadero, Talca, Gobierno de Chile
4 E-mail: pmoralesm@santotomas.cl
RESUMEN
En el presente estudio se determinó la prevalencia de hallazgos compatibles con hidatidosis y fertilidad de quistes hidatídicos en bovinos de una planta faenadora en Curicó, Chile. Se analizaron pulmones, hígados, corazones, bazos y riñones de 218 animales faenados en abril de 2017. Se determinó una prevalencia de hallazgos compatibles con hidatidosis de 12.4%, donde el 74.1% de los animales afectados presentó quistes pulmonares, 11.1% quistes hepáticos y 14.8% de ambos tipos. Los animales añosos concentraron la mayor cantidad de hallazgos. En muestras del líquido hidatídico de quistes uniloculares se obtuvo una fertilidad de 6.25%. La prevalencia de hallazgos encontrada fue inferior a los datos descritos en estudios nacionales.
Palabras clave: hidatidosis; bovino; prevalencia; fertilidad
ABSTRACT
The aim of this study was to determine the prevalence of findings compatible with hydatidosis and fertility of hydatid cysts in bovines of a slaughterhouse in Curicó, Chile. Lungs, livers, hearts, spleens and kidneys of 218 animals slaughtered in April 2017 were analyzed. The prevalence of findings compatible with hydatidosis was 12.4%, where 74.1% of affected animals presented lung cysts, 11.1% liver cysts and 14.8% of both types. Older animals concentrated the greatest number of findings. In samples of hydatid fluid from unilocular cysts a fertility of 6.25% was obtained. The prevalence of findings found was lower than the data described in national studies.
Key words: hydatidosis; bovine; prevalence; fertility
INTRODUCCIÓN
La hidatidosis es una zoonosis cosmopolita causada por la fase larvaria del cestodo Echinococcus spp, siendo E. granulosus el principal agente etiológico descrito en Chile y responsable de la presentación quística de la enfermedad en el hospedero intermediario (Martínez, 2011; ISP, 2015). El ciclo biológico del parásito comienza en el hospedero definitivo (perro doméstico u otros cánidos silvestres), quien alberga el parásito adulto en el intestino delgado, liberando huevos infectantes en las heces. La transmisión hacia el hospedero intermediario (rumiantes, equinos y humanos) se produce por vía oral-fecal. El huevo ingerido eclosiona en el intestino delgado liberando una oncósfera que penetra la pared intestinal, viaja por el torrente sanguíneo, se enquista en un órgano y comienza a crecer, generando protoescólices y quistes hijos. El periodo de incubación puede abarcar desde 12 meses hasta varios años, y un solo quiste hidatídico puede originar más de mil parásitos adultos (Acosta-Jamett et al., 2014; MINSAL, 2015).
Similar a otros miembros de la familia Taeniidae, el quiste hidatídico, es una vesícula llena de líquido incoloro transparente (Dubarry et al., 2011; Silva, 2014). Dentro de la vesícula se encuentran los protoescólices, correspondientes al órgano de fijación del parásito. Un protoescólex da origen al escólex, órgano homólogo del parásito adulto (Vera et al., 2003; Silva, 2014). Los quistes fértiles poseen uno o más protoescólices en su interior (Muñoz y Sievers, 2005), en tanto que un quiste hidatídico unilocular corresponde a una vesícula con una sola cavidad que contiene el líquido hidatídico, a menudo fértil (Conchedda et al., 2016), pero que también pueden desarrollar estados degenerativos del metacéstodo (quistes caseificados, calcificados, multiseptados o hiperlaminados), los cuales suelen ser infértiles.
La fertilidad de los quistes hidatídicos en el bovino es cercana al 10%, a diferencia del porcino y ovino, que presentan 20 y 90%, respectivamente. Es así que se considera que el bovino no contribuye en mayor medida a la continuidad del ciclo del parásito, debido a la baja fertilidad de los quistes y al sacrificio de estos animales en recintos autorizados (Muñoz y Sievers, 2005; Shahnazi et al., 2012; Terefe et al., 2012). Los principales órganos afectados en el hospedero intermediario son el hígado, pulmones y riñones (Acosta-Jamett et al., 2016). Los animales adultos suelen tener una mayor frecuencia de infección con E. granulosus respecto a los jóvenes (Demissie y Kemal, 2014; Mekuriaw et al., 2016; Dawit et al., 2017; OIE, 2017), sin predilección por el sexo, aunque algunos estudios describen una mayor prevalencia en hembras (Okolugbo et al., 2014; Dawit et al., 2017).
La hidatidosis se concentra en áreas rurales con producción de autoconsumo, donde es una práctica habitual alimentar a los caninos con vísceras del ganado (MINSAL, 2015; Cucher et al., 2016; Souto et al., 2016). Las regiones con mayor tasa de hallazgos de hidatidosis corresponden a la Región de Aysén, Los Lagos y Los Ríos, todas en el sur de Chile con una elevada proporción de ganado y población rural (SAG, 2017).
Según datos del Servicio Agrícola y Ganadero de Chile (SAG) con base a la información recopilada del 79% de los establecimientos de faena nacional durante el año 2016, la principal especie afectada por hidatidosis es el bovino (141 376 animales afectados) y corresponden al 85% de los decomisos registrados (SAG, 2017). Las pérdidas por decomiso de hígado y carne en vara en bovinos en 2011 ascendieron a US$ 1.3 y 7.8 millones, respectivamente (Venegas et al., 2014).Asimismo, la hidatidosis es un problema de salud pública, especialmente para la población de riesgo (Sánchez y Souto, 2011; Souto et al., 2016), habiéndose determinado una tasa de incidencia nacional de hidatidosis entre 1.41 y 2.47 casos por 100 000 habitantes en el periodo 2000-2014, en tanto que la tasa de mortalidad se estimó entre 0.09 y 0.23 por cada 100 000 habitantes en el periodo 2000-2012 (ISP, 2015; OIE, 2017). El presente estudio caracterizó la prevalencia de hallazgos compatibles con hidatidosis y determinó la fertilidad de los quistes hidatídicos encontrados en bovinos beneficiados en una planta faenadora en Curicó, Chile.
MATERIALES Y MÉTODOS
Tamaño de la Muestra
El tamaño muestral se determinó de acuerdo con la fórmula de población finita para variables categóricas (Aguilar-Barojas, 2005), a partir de una población estimada (N) de 1900 animales faenados en un mes, un valor p=0.2, un 95% de confianza y una precisión (e2) de 0.05, la cual resultó en 218 individuos. Se inspeccionó únicamente a los bovinos que contaban con información asociada a su lugar de procedencia (comuna y región). El muestreo de los animales se realizó mediante un muestreo por conveniencia no probabilístico.
Inspección post mortem
La determinación de hallazgos compatibles con hidatidosis se realizó mediante inspección macroscópica visual, palpación e incisión de las vísceras (hígado, pulmones, corazón, bazo y riñones), con base a la Norma 62 sobre Inspección Médico Veterinaria en Reses de Abasto (MINSAL, 2002). Los criterios para clasificar las lesiones de un órgano como «hallazgos compatibles con hidatidosis» fueron la visualización macroscópica de una lesión quística, con una doble membrana interna (capa laminar y capa germinativa) y líquido sin turbiedad en su interior (líquido hidatídico) (Vera et al., 2003; Dubarry et al., 2011, Silva 2014). Se registró la comuna y región de procedencia, órganos decomisados, edad y sexo de los bovinos beneficiados.
Fertilidad de los Quistes Hidatídicos
Se tomaron muestras del líquido hidatídico de los quistes, exceptuando los quistes en estado degenerativo (caseosos, calcificados, multiseptados e hiperlaminados) o de tamaño muy reducido. El líquido se almacenó en una jeringa desechable de 10 ml con formalina tamponada al 10% a temperatura ambiente durante aproximadamente dos meses.
Para el análisis microscópico se hizo un extendido de líquido hidatídico sobre un portaobjetos y se observó en un microscopio óptico (Japan Optical AC 220V) para determinar la fertilidad del quiste. La presencia de uno o más protoescólices en el quiste fue considerado como fértil (Muñoz y Sievers, 2005; Rajabloo et al., 2012; Silva, 2014).
Prevalencia de Hidatidosis
Se analizó la prevalencia de hallazgos compatibles con hidatidosis en función de la procedencia de los animales, órganos inspeccionados, edad y sexo. Para determinar la procedencia de los animales se ingresó el dispositivo de identificación individual oficial (DIIO) de cada animal al sistema de información pecuaria (SIPEC), para determinar el predio desde donde el animal fue trasladado a la planta faenadora.
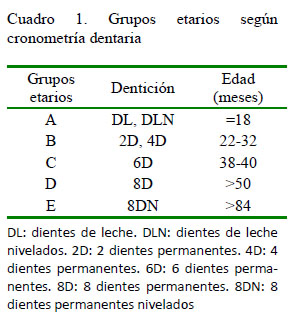
Se realizó la inspección individual de los pulmones, corazón, bazo, hígado y riñones. Los órganos pares (pulmones y riñones) fueron considerados como un solo órgano; así, cuando solo uno o ambos estaban alterados se consideró que existían hallazgos compatibles con hidatidosis en pulmones o riñones del animal. La edad fue determinada por cronometría dentaria por el tipificador de la planta faenadora, según la Norma Chilena Oficial 1306 (SAG, 2012), y los animales fueron categorizados en cinco grupos etarios (Cuadro 1). El sexo fue considerado como hembra y macho.
Análisis Estadístico
Se utilizó la prueba del Chi cuadrado (p<0.05) con los datos de prevalencia de hallazgos compatibles con hidatidosis para determinar la existencia de asociación estadística con la edad y sexo de los animales. Se utilizó la prueba de Fisher (p<0.05) para determinar diferencias significativas entre grupos etarios. En todos los casos se usó el software Infostat®.
RESULTADOS Y DISCUSIÓN
Prevalencia de Hidatidosis
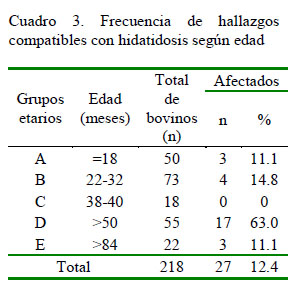
Se encontró una prevalencia de hallazgos compatibles con hidatidosis en los 218 bovinos evaluados de 12.4% (n=27); prevalencia similar al 13.8% obtenida por Sepúlveda (2016, datos no publicados) en un trabajo retrospectivo realizado en la misma planta faenadora en el periodo 2011-2015. Otros estudios realizados en Chile presentan prevalencias más elevadas, por ejemplo, Acosta-Jamett et al. (2009) obtuvieron 23.9% en la Región de Coquimbo, Rosas (2010) encontró una prevalencia de 22% en Osorno, y Muñoz y Sievers (2005) determinaron una prevalencia de 16% en la Planta Faenadora Lo Valledor (Región Metropolitana).
A nivel internacional se observan prevalencias de hidatidosis bovina mucho menores. En Latinoamérica, Dal Bianco et al. (2011) reportaron una prevalencia de 1.7% en establecimientos faenadores de La Pampa y San Luis, Argentina y Dubarry et al. (2011) de 2.3% en una planta faenadora, también de Argentina, en tanto que Valderrama y Huaranca (2014) y Moya (2017) encontraron prevalencias de 6.5 y 1-2.5% en Huanacarama, Perú y Cotopaxi, Ecuador, respectivamente. En Medio Oriente, Latif et al. (2010) encontraron una prevalencia de 5.2% en bovinos faenados en Punjab (Pakistán) y Riesle et al. (2014) de 6.5 y 3.6% en Irán y Arabia Saudita, respectivamente.
Si bien la prevalencia encontrada en la planta faenadora de Curicó no parece haber aumentado respecto a años anteriores y se encuentra por debajo de las prevalencias relatadas en estudios nacionales, la cantidad de bovinos afectados sigue siendo de interés y preocupación, debido a las pérdidas económicas asociadas y al carácter zoonótico de la enfermedad, razón por la cual en Chile corresponde a una enfermedad de Notificación Obligatoria (SAG, 2018).
Procedencia de los Animales
En conformidad a las estadísticas oficiales del ServicioAgrícola y Ganadero (SAG, 2017), el mayor número de animales afectados fueron de la Región del Maule, Los Lagos y Bío Bío, ubicadas en el centro sur del país y poseedoras de las condiciones ambientales que permiten la sobrevivencia del parásito, tales como bajas temperaturas, alta humedad relativa y alta concentración de población rural y de ganado (Sánchez y Souto, 2011; Cucher et al., 2016; Souto et al., 2016). En el presente estudio, la mayor cantidad de animales faenados correspondió a la Región del Maule, que es donde se ubica la planta faenadora, pero también hubo animales de regiones cercanas del sur de Chile (Bio Bio y Los Lagos).
Órganos Afectados
La mayoría de los 27 animales afectados presentó quistes en pulmones y en menor medida en el hígado o en ambos órganos (Cuadro 2), lo cual concuerda con la documentación existente a nivel nacional en bovinos (Acosta-Jamett et al., 2009; Mekuriaw et al., 2016). Muñoz y Sievers (2005) encontraron una frecuencia de 74% en pulmones, 25.6% en hígado y 0.4% en bazo entre los animales afectados. En contraste, Rosas (2010) determinó una frecuencia de 53% en riñones, 40% en hígado y 7% en pulmones. Asimismo, el órgano más afectado en otros países de América Latina, Medio Oriente y África del Norte ha sido el pulmón (Getaw et al., 2010; Dubarry et al., 2011; Terefe et al., 2012; Shahnazi et al., 2012; Khadidja et al., 2014).
Frecuencia por Edad
La mayor cantidad de bovinos afectados correspondió al grupo mayores a 50 meses (Cuadro 3), en concordancia con Muñoz y Sievers (2005) en Chile y en otros países (Abunna et al., 2012; Demissie y Kemal, 2014; Mekuriaw et al., 2016; Dawit et al., 2017). La mayor prevalencia en animales mayores podría explicarse por el prolongado periodo de incubación de la enfermedad (Getaw et al., 2010; ISP, 2015). En el presente estudio, llama la atención que el grupo de animales mayores a 84 meses no arrojó la mayor prevalencia de hallazgos. Es posible que se haya subestimado la presencia de quistes debido a otras lesiones concomitantes de tipo absceso o granulomatosas; así mismo, en animales de avanzada edad se presentan mayor cantidad de quistes en estado degenerativo, lo cual dificulta la detección de un quiste hidatídico.
Frecuencia por Sexo
No se observó asociación estadística entre la prevalencia de hallazgos compatibles con hidatidosis y el sexo de los animales (machos: 12.5%; hembras: 12.3%) Si bien la literatura no describe una predisposición por sexo para esta enfermedad, algunos estudios en África del Norte y Medio Oriente han encontrado una mayor prevalencia en hembras (Terefe et al., 2012; Okolugbo et al., 2014; Dawit et al., 2017), posiblemente debido a una distribución desigual del sexo dentro de la muestra y a factores fisiopatológicos que generan un efecto inmunosupresor, tales como la preñez, el parto y la lactancia.
Fertilidad de los Quistes Hidatídicos
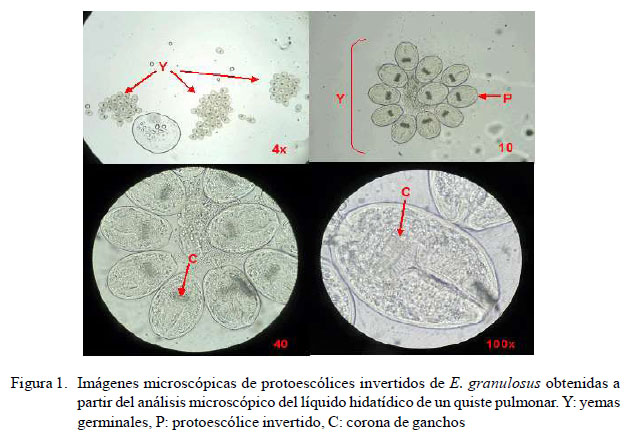
Se analizaron 16 quistes uniloculares con ausencia de signos de degeneración, donde en solo uno de ellos se evidenciaron protoescólices en el líquido hidatídico (fertilidad: 6.25%) (Figura 1), coincidiendo con resultados de otros estudios (Muñoz y Sievers, 2005; Dubarry et al., 2011; Shahnazi et al., 2012; Terefe et al., 2012), con algunas excepciones (Latif et al., 2010; Khadidja et al., 2014). El único quiste fértil encontrado correspondió a un quiste pulmonar de un novillo de 32 meses de edad que presentó tres yemas germinales, cada una con 11, 21 y 30 protoescólices invertidos (Figura 1), similar a lo descrito por Vera et al. (2003). Además, los protoescólices presentaron una forma ovalada y una doble corona de ganchos (Vera et al., 2003; Silva, 2014).
La baja fertilidad de los quistes encontrada respalda el planteamiento de Muñoz y Sievers (2005), quienes sostienen que la infestación del ganado bovino con E. granulosus en Chile no guarda relación con la continuidad del ciclo biológico del parásito, debido a la escasa fertilidad de los quistes hidatídicos en bovinos.
CONCLUSIONES
-
La prevalencia de hallazgos compatibles con hidatidosis en bovinos en una planta faenadora de Curicó, Chile (abril, 2017) fue de 12.4%, cifra inferior a datos descritos en estudios nacionales.
-
Las lesiones compatibles con hidatidosis fueron predominantemente en pulmón.
-
Se encontró una asociación significativa entre casos de hidatidosis y edad de los animales.
-
La fertilidad de los quistes fue baja.
LITERATURA CITADA
1. Abunna F, Fentaye S, Megersa B, Regassa A. 2012. Prevalence of bovine hydatidosis in Kombolcha ELFORA abattoir, North Eastern Ethiopia. Open J Anim Sci 2: 281-286. doi: 10.4236/ ojas.2012.24038 [ Links ]
2. Acosta-Jamett G, Cleaveland S, Cunningham AA, Bronsvoort BM, Craig PS. 2009. Echinococcus granulosus infection in humans and livestock in the Coquimbo region, northcentral Chile. Vet Parasitol 169: 102-110. doi: 10.1016/j.vetpar.2009.12.009 [ Links ]
3. Acosta-Jamett G, Weitzel T, Boufana B, Adones C, Bahamonde A, Abarca K, Craig PS, et al. 2014. Prevalence and risk factors for echinococcal infection in a rural area of northern Chile: a household-based cross-sectional study. Plos Neglect Trop D 8: e3090. doi: 10.1371/journal.pntd.0003090 [ Links ]
4. Acosta-Jamett G, Vargas R, Ernst S. 2016. Caracterización epidemiológica de hidatidosis humana y animal en la Región de Los Ríos, 1999-2009. Rev Chil Infectol 33: 419-427. doi: 10.4067/S0716-10182016000400006 [ Links ]
5. Aguilar-Barojas S. 2005. Fórmulas para el cálculo de la muestra en investigaciones de salud. Salud en Tabasco 11(1-2). [Internet]. Disponible en: http://www.redalyc.org/articulo.oa?-id=48711206 [ Links ]
6. Conchedda M, Seu V, Capra S, Caredda A, Pino S, Pier P, Lochi G, et al. 2016. Study of morphological aspects of cystic echinococcosis (CE) in sheep in Sardinia. Acta Trop 159: 200-210. doi: 10.1016/j.actatropica.2016.04.003 [ Links ]
7. Cucher MA, Macchiaroli N, Baldi G, Camicia F, Prada L, Maldonado, Avila HG, et al. 2016. Cystic echinococcosis in South America: systematic review of species and genotypes of Echinococcus granulosus sensu lato in humans and natural domestic hosts. Trop Med Int Health 21: 166-175. doi: 10.1111/tmi.12647 [ Links ]
8. Dal Bianco J, Sago A, Miranda A. 2011. Hidatidosis bovina en la provincia de La Pampa y San Luis, Argentina. Hallazgo en faena. Anuario INTASENASA 2011. [Internet]. Disponible en: https://www.academia.edu/2938-7320/Hidatidosis_bovina_en_-la_provincia_de_-La_Pampa_y_San-_Luis_-Argentina._Hallazgo_en_faena [ Links ]
9. Dawit A, Tewodros A, Tefera K. 2017. The prevalence of bovine hydatidosis among slaughtered cattle at Debre Berhan Municipal Abattoir, North Shewa Zone, Ethiopia. J Vet Sci Med 5: 1-4. [ Links ]
10. Demissie G, Kemal J. 2014. Bovine hydatidosis and its economic importance at Kara-Alo Abattoir PLC, Addis Ababa, Ethiopia. J Veterinar Sci Technolo 5: 1000206. doi: 10.4172/2157-7579.1000206 [ Links ]
11. Dubarry JR, Errea AL, Maria AE, Muñoz C, Kenny OG, Véspoli-Pucheu MV, Lamberti R, et al. 2011. Hidatidosis bovina: contrastación de los diagnósticos macroscópico y microscópico. Cienc Vet 13: 39-45. doi: 10.19137/cienvet2013-1513 [ Links ]
12. Getaw A, Beyene D, Ayana D, Megersa B, Abunna F. 2010. Hydatidosis: prevalence and its economic importance in ruminants slaughtered at Adama municipal abattoir, Central Oromia, Ethiopia. Acta Trop 113: 221-225. doi: 10.1016/j.actatropica.2009.-10.019 [ Links ]
13. [ISP] Instituto de Salud Pública. 2015. Vigilancia de hidatidosis. Chile 2010-2014. Chile: ISP. Boletín Informativo 5. 14 p. [ Links ]
14. Khadidja H, Achour Y, Vasile C. 2014. Study of the fertility and morphos-tructural of Echinococcus granulosus in Algeria. Bull Univ Agric Sci 71: 92-96. [ Links ]
15. Latif AA, Tanveer A, Maqbool A, Siddiqi N, Kyaw-Tanner M, Traub RJ. 2010. Morphological and molecular characteri-zation of Echinococcus granulosus in livestock and humans in Punjab, Pakistan. Vet Parasitol 170: 44- 49. doi: 10.1016/j.vetpar.2010.02.003 [ Links ]
16. Martínez P. 2011. Hidatidosis humana: antecedentes generales y situación epidemiológica en Chile, 2001-2009. Rev Chil Infectol 28: 585-591. doi: 10.4067/S0716-10182011000700013 [ Links ]
17. Mekuriaw E, Walelign B, Awukew A. 2016. Prevalence of gross pathological lesion in lung and liver of cattle slaughtered at Gondar Elfora Abattoir, North West, Ethiopia. Int J Appl Res 2: 475-480. [ Links ]
18. [MINSAL] Ministerio de Salud. 2002. Norma general técnica sobre inspección médico veterinaria de las reses de abasto y de sus carnes y criterios para la calificación de aptitud para el consumo humano. Chile: MINSAL. Norma Técnica. 64 p. [Internet]. Disponible en: http://www.sag.gob.cl/sites/default/files/NORMA_62_REFUNDIDO_APTITUD_CONSUMO_HUMANO.pdf [ Links ]
19. [MINSAL] Ministerio de Salud. 2015. Manual para el diagnóstico, tratamiento, prevención y control de la hidatidosis en Chile. [Internet]. Disponible en: https://diprece.minsal.cl/wrdprss_minsal/wpcontent/uploads/2016/02/Manual-Hidatidosis.pdf [ Links ]
20. Moya L. 2017. Diagnóstico de la hidatidosis en bovinos de la provincia de Cotopaxi. Tesis de Médico Veterinario Zootecnista. Latacunga, Ecuador: Univ. Técnica de Cotopaxi. 42 p. [ Links ]
21. Muñoz JP, Sievers G. 2005. Estudio de la fertilidad y viabilidad de quistes hidatídicos bovinos en Chile. Parasitol Latinoam 60: 69-73. doi: 10.4067/S0717- 77122005000100012 [ Links ]
22. [OIE] Organización Mundial de Sanidad Animal. 2017. Manual de la OIE sobre animales terrestres Cap 2.1.6. Equinococosis/Hidatidosis. Manual Terrestre de la OIE 2017. 16 p. [ Links ]
23. Okolugbo B, Luka S, Ndams I. 2014. Enzyme-linked immunosorbent assay (ELISA) in the serodiagnosis of hydatidosis in camels (Camelus dromedarius) and cattle in Sokoto, Northern Nigeria. Internet J Infect Dis 13: 1-6. doi: 10.5580/IJID.22427 [ Links ]
24. Rajabloo M, Hosseini S, Jalousian F. 2012. Morphological and molecular characterization of Echinococcus granulosus from goat isolates in Iran. Acta Trop 123: 67-71. doi: 10.1016/j.actatropica.2012.03.006 [ Links ]
25. Riesle S, García MP, Hidalgo C, Galanti N, Saenz L, Paredes R. 2014. Bovine IgG subclasses and fertility of Echinococcus granulosus hydatid cysts. Vet Parasitol 205: 125-133. doi: 10.1016/j.vetpar.2014.06.003 [ Links ]
26. Rosas HP. 2010. Prevalencia de lesiones macroscópicas de hidatidosis durante el periodo 2002-2006 en mataderos de la provincia de Osorno, Chile. REDVET 11(12). [Internet]. Disponible en: http:// www.veterinaria.org/revistas/redvet/n121210/121001.pdf [ Links ]
27. [SAG] Servicio Agrícola y Ganadero. 2012. Carnes tipificadas ley 19.162 «Información para el consumidor». Chile: SAG. Ley del Estado de Chile. 6 p. [Internet]. Disponible en: http://www.sag.cl/sites/default/files/pdf_tipificacion_de_carne_2.pdf [ Links ]
28. [SAG] Servicio Agrícola y Ganadero. 2017. Informe beneficio y hallazgos patológicos en mataderos nacionales 2016. [Internet]. Disponible en: http://www.sag.cl/sites/default/files/informe_decomisos_mataderos_2016.pdf [ Links ]
29. [SAG] Servicio Agrícola y Ganadero. 2018. Lista de enfermedades de denuncia obligatoria (EDO) al SAG. [Internet]. Disponible en: http://www.sag.gob.cl/sites/default/files/enfermedades_denuncia_obligatoria_sag_11-2-2019.pdf [ Links ]
30. Sánchez P, Souto M. 2011. Dinámica de la trasmisión de la hidatidosis por Echinococcus granulosus. Actualidad y características de su estudio. En: Basualdo J, Cacchione R, Durlach R (eds). Libro temas de zoonosis V. Buenos Aires, Argentina: Asociación Argentina de Zoonosis. p 455-462. [ Links ]
31. Shahnazi M, Jafari A, Javadi M, Saraei M. 2012. Fertility of hydatid cysts and viability of protoscoleces in slaughtered Animals in Qazvin, Iran. J Agr Sci 5: 141-146. doi: 10.5539/ jas.v5n1p141 [ Links ]
32. Silva M. 2014. Caracterización estructural y funcional del antígeno B de Echinococcus granulosus. Tesis de Doctorado. Argentina: Univ. Nacional de la Plata. 232 p. [ Links ]
33. Souto MG, Sanchez P, Basualdo J. 2016. Evaluation of the presence of Echinococcus granulosus sensu lato in the environment and in hosts in a region endemic for hydatidosis in the province of Chubut (Argentina). VPRSR 6: 42- 46. doi: 10.1016/j.vprsr.2016.09.005 [ Links ]
34. Terefe D, Kebede K, Beyene D, Wondimu A. 2012. Prevalence and financial loss estimation of hydatidosis of cattle slaughtered at Addis Ababa abattoirs enterprise. J Vet Med Anim Health 4: 42- 47. doi: 10.5897/JVMAH-12.011 [ Links ]
35. Valderrama A, Huaranca E. 2014. Conocimientos y prácticas como factores de riesgo de hidatidosis en animales de Huancarama, Perú. Rev Colegio Méd Vet Lara 1(7). [Internet]. Disponible en: https://revistacmvl.jimdo.com/suscripci%C3%B3n/volumen-7/hidatidosis/ [ Links ]
36. Venegas J, Espinoza S, Sánchez G. 2014. Estimación del impacto económico de la equinococosis quística en Chile y análisis de las posibles causas que han dificultado su erradicación. Rev Med Chile 142: 1023-1033. doi: 10.4067/ S0034-98872014000800010 [ Links ]
37. Vera G, Venturelli F, Ramírez J, Venturelli A. 2003. Hidatidosis humana. Cuadernos de Cirugía (Valdivia) 17: 88-94. [ Links ]
Recibido: 30 de agosto de 2018
Aceptado para publicación: 6 de marzo de 2019