Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.30 no.3 Lima jul./set 2019
http://dx.doi.org/10.15381/rivep.v30i3.16613
ARTÍCULOS PRIMARIOS
Índices gonadosomático y hepatosomático en relación con la maduración y muda del camarón Cryphiops caementarius del río Pativilca (Perú)
Gonadosomatic and hepatosomatic indices in relation to the maturation and moult of the shrimp Cryphiops caementarius of the Pativilca River (Peru)
Marco Medina M.1, Yoli Espinoza G.1, Walter Reyes A.1,2
1 Laboratorio de Acuicultura Ornamental, Departamento de Biología, Microbiología y Biotecnología, Universidad Nacional del Santa, Chimbote, Ancash, Perú
2 E-mail: wreyes_avalos@hotmail.com
RESUMEN
El objetivo del estudio fue determinar los índices gonadosomático (IGS) y hepatosomático (IHS) en relación con la maduración gonadal y los estados de muda del camarón Cryphiops caementarius del río Pativilca (Perú). Se emplearon 143 camarones machos (4.07-11.70 cm de longitud total) y 97 hembras (1.75-8.02 cm de longitud total). Los camarones se pesaron, midieron y se determinó el estado de muda. Los hepatopáncreas y gónadas se extrajeron por disección, se pesaron y se determinaron los estados del ovario. Durante la maduración del ovario, el IGS incrementó de 0.97 a 5.01% y el IHS disminuyó de 5.37 a 4.44%. En hembras maduras y no ovígeras en postmuda A, el mayor IGS fue de 8.28% y el menor IHS de 1.72%. En hembras con ovarios inmaduros y no ovígeras, el IGS incrementó de 1.40 a 3.38% y en hembras inmaduras y ovígeras de 0.38 a 1.79%, en tanto que lo contrario sucedió en hembras maduras no ovígeras. En los machos el IGS varió de 1.74 a 0.78% y el IHS de 5.08 a 5.92% durante el ciclo de muda. En hembras el IGS incrementó conforme maduró el ovario y fue máximo en postmuda A y mínimo en postmuda B2; en cambio, el IHS varió de manera inversa con el IGS. En camarones machos los bajos IGS y los altos IHS sugieren que estos no invierten energía para reproducción.
Palabras clave: camarón; reproducción; reservas de nutrientes; sistema reproductor; transferencia de nutrientes
ABSTRACT
The aim of this study was to determine the gonadosomatic (IGS) and hepatosomatic (IHS) indices in relation to the gonadal maturation and moult stages of the Cryphiops caementarius shrimp from the Pativilca River (Peru). A total of 143 male shrimp (4.07-11.70 cm of total length) and 97 females (1.75-8.02 cm of total length) were used. The shrimp were weighed, measured and the molting state was determined. The hepatopancreas and gonads were removed by dissection, weighed and the ovarian stages determined. During the maturation of the ovary, the IGS increased from 0.97 to 5.01% and the IHS decreased from 5.37 to 4.44%. In mature and non-ovulating females in post-moulting A, the highest IGS was 8.28% and the lowest IHS was 1.72%. In females with immature and non-ovulating ovaries, the IGS increased from 1.40 to 3.38% and in immature and ovigerous females from 0.38 to 1.79%, while the opposite happened in mature non-ovigerous females. In males the IGS varied from 1.74 to 0.78% and the IHS from 5.08 to 5.92% during the moulting cycle. In females the IGS increased as the ovary matured and was maximum in post- moulting A and minimum in post-moulting B2; however, the IHS varied inversely with the IGS. In male shrimp, low IGS and high IHS suggest that they do not invest energy for reproduction.
Key words: shrimp; reproduction; nutrient reserves; reproductive system; nutrient transfer
INTRODUCCIÓN
El camarón de río Cryphiops caementarius Molina 1782 se distribuye des- de el río Taymi-Mochumi en Perú (Moscoso, 2012) hasta el río Aconcagua en Chile (Meruane et al., 2006), pero tiene importancia económica y comercial en los ríos Cañete, Ocoña, Majes-Camaná y Tambo en Perú, cuya extracción reciente reporta 1113 t (Wasiw y Yépez, 2015; Produce, 2017). Además, tiene importancia gastronómica y turística (Carrillo et al., 2012).
Cryphiops caementarius es hetero- sexual, polígamo, desova durante todo el año con un máximo entre noviembre a marzo en los ríos del Perú (Viacava et al., 1978). En cautiverio se induce la maduración ovárica con alimento natural (Bazán et al., 2009) y se ha propuesto una escala de madurez gonadal (Lip, 1976; Viacava et al., 1978; Moreno et al., 2012); además, se conoce que la relación entre el ciclo ovárico con el ciclo de muda y la ecdisis reproductiva o no reproductiva se relaciona con la maduración del ovario (Reyes, 2014).
En crustáceos existe alta optimización de la energía para crecimiento y reproducción (López y Rodríguez, 1999), donde el hepatopáncreas es el órgano fisiológicamente dinámico con intensa actividad secretora (Marcolin et al., 2008) que almacena nutrientes para reproducción (Cavalli et al., 2001; Sokolowicz et al ., 2006), muda (Yamaguchi, 2001; Marcolin et al., 2008) y otras actividades fisiológicas.
El índice gonadosomático (IGS) y el índice hepatosomático (IHS) son indicadores de movilización de reservas energéticas del hepatopáncreas hacia las gónadas, con los cuales se estima la actividad reproductiva (Rodríguez-González et al., 2006; Revathi et al., 2012) y que se relaciona con la muda de crustáceos (Okomura y Aida, 2000; Magalhães et al., 2012). En hembras de Cherax quadricarinatus y Callinectes danae hay una relación inversa entre el IGS y el IHS que evidencia el uso de reservas del hepatopáncreas para maduración gonadal (Rodríguez-González et al., 2006; Zara et al., 2012). No se conocen estos índices en C. caementarius que permitan entender la movilización de nutrientes durante la reproducción y la muda. Por consiguiente, el objetivo del estudio fue determinar los índices gonadosomático y hepatosomático en relación con la madurez gonadal y los estados de muda en el camarón C. caementarius del río Pativilca.
MATERIALES Y MÉTODOS
Los camarones se colectaron de las capturas comerciales que se realiza en el río Pativilca, cerca del Centro Poblado Huayto (10º39’50'’S, 77º40’09'’W, Lima, Perú). Los camarones fueron acondicionados en recipientes isotérmicos de 10 L con hielo triturado y se transportó vía terrestre durante 4 h. En el laboratorio, los individuos de la especie C. caementarius se reconocieron según Méndez (1981) y el sexo se determinó por observación de los gonóporos de las coxas del tercer par de periópodos en hembras y del quinto par en machos (Reyes et al., 2018). La muestra fue de 143 camarones machos (4.07 – 11.70 cm de longitud total) y de 97 hembras (1.75 – 8.02 cm de longitud total) en diferentes estados de maduración ovárica y en la condición de ovígera y no ovígera.
Los camarones fueron pesados en balanza digital (ADAM AQT600, ± 0.1 g) sin el segundo par de periópodos, porque en las capturas comerciales algunos camarones llega- ron sin estos apéndices, principalmente los machos. La longitud total (LT = Escotadura pos-orbital hasta el extremo posterior del telson) se midió con vernier (± 0.01 mm) con los camarones posicionados ventralmente.
Los estados y subestados de posmuda (A1, A2, B1 y B2), de intermuda (C) y de premuda (Do, D1', D1'’, D1''', D2 y D3) se reconocieron por observación microscópica del borde interno del exopodito del urópodo de cada camarón (Reyes y Luján, 2003). Los estados de maduración del ovario fueron evaluados según Reyes (2014) y por razones prácticas se consideraron los estados de ovario I-II (inmaduros), ovario III (maduración in- termedia) y ovario IV (maduro).
Las gónadas y los hepatopáncreas se obtuvieron por disección y fueron pesados en forma inmediata en balanza analítica ADAM AEA-160DG (± 0.01 mg). El IGS y el IHS se determinaron según Ferré et al. (2012): IGS (%) = (PG/PSP)*100 e IHS = (PH/ PSP)*100, donde PG es el peso húmedo de la gónada , PH el peso húmedo del hepatopáncreas y PSP el peso húmedo del camarón sin el segundo par de periópodos.
La relación entre el IGS y el IHS fue analizado por regresión lineal. Las diferencias entre IGS y el IHS según estados de muda y estados del ovario fue determinado con la prueba «t» de Student, por análisis de varianza simple y con la prueba de Tukey. En todos los casos el nivel de significancia fue del 5%. Todos los análisis se realizaron con el programa SPSS v. 23.0 para Windows.
RESULTADOS
IGS e IHS según Sexo
En camarones hembras hubo moderada, pero significativa (p=0.001) correlación inversa (r = -0.3497) entre el IGS (3.62%) y el IHS (4.66%). En camarones machos también fue moderada y significativa (p=0.000) la correlación inversa (r = -0.3906) entre el IGS (1.39%) y el IHS (5.29%).
IGS e IHS en la Maduración del Ovario
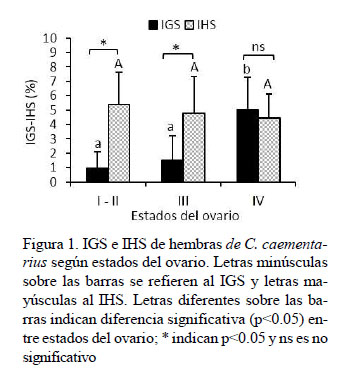
El IGS incrementó de 0.97% en hembras con ovarios inmaduros hasta 5.01% en hembras con ovarios maduros (p=0.000). El IHS disminuyó de 5.37% en hembras con ovarios inmaduros hasta 4.44% en hembras con ovarios maduros. En ambos casos se incluyeron a hembras ovígeras y no ovígeras. Los IGS e IHS de las hembras solo fueron diferentes (p<0.05) en los estados del ovario I-II y III (Figura 1).
IGS e IHS de Hembras en Ciclo de Muda
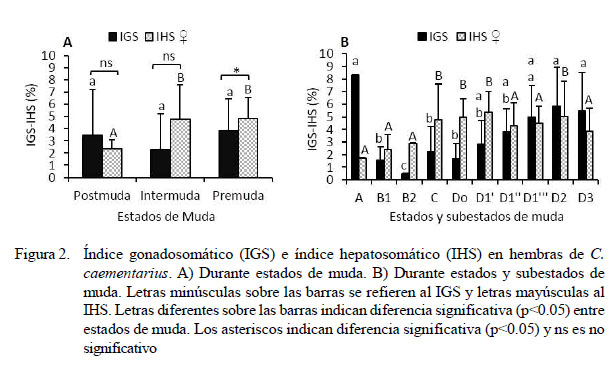
Los IGS en hembras fueron similares en premuda (3.85%), postmuda (3.44%) e intermuda (2.27%); en cam- bio, el IHS en intermuda (4.77%) y premuda (4.83%) difirieron (p=0.05) de postmuda (2.34%) (Figura 2A). Ademá s, el IGS fue alto (8.28% ) en postmuda A, pero disminuyó (1.57%) en postmuda B1 y aún más (0.47%) en postmuda B2; pero aumentó desde intermuda hasta 5.84% en premuda D2 y 5.46% en D3. En cambio, el IHS incrementó desde 1.72% en postmuda A hasta 5.35% en premuda D1', para disminuir a 5.01% en premuda D2 has- ta 3.87% en D3 (Figura 2B).
IGS e IHS de Hembras con Ovarios Inmaduros en el Ciclo de Muda
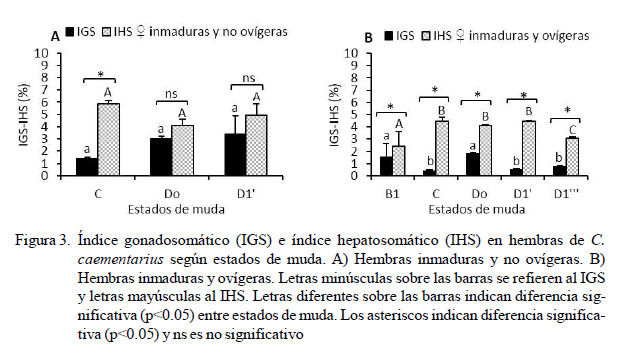
En hembras con ovarios inmaduros y no ovígeras, los IGS incrementaron (p=0.190) desde 1.40% en intermuda C hasta 3.38% en D1'; y los IHS se mantuvieron alrededor de 5% des- de C hasta D1'. Los IGS e IHS de las hembras inmaduras y no ovígeras fueron diferentes (p<0.05) solo en estado de intermuda C (Figura 3A). En hembras con o varios inmaduros y ovígeras, el IGS en estado B1 de 1.56% fue similar que en Do de 1.79%; en cambio en los estados C, D1' y D1''' el IGS se mantuvo alrededor de 0.5%. El IHS fue de 2.39% en postmuda B1, en cambio en intermuda C y en premuda Do y D1' se mantuvieron alrededor de 4.50% y en D1''' disminuyó (p<0.05) a 3.09%. Los IGS e IHS de las hembras con ovarios inmaduros y ovígeras fueron diferentes (p<0.05) en cada estado de muda y los IHS fueron siempre mayores (Figura 3B).
IGS e IHS de Hembras con Ovarios Maduros en el Ciclo de Muda
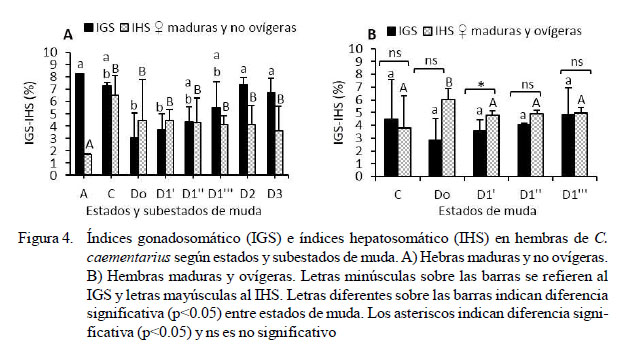
Las hembras en posmuda A y con ovarios maduros y no ovígeras obtuvieron altos IGS (8.28%) que disminuyeron (p=0.00) hasta 3.08% en Do y luego se incrementaron hasta 7.39% en D2. El IHS fue de 1.72% en postmuda A que incrementó (p<0.05) a 6.53% en intermuda C, para mantenerse alrededor de 4.20% desde Do hasta D3 (Figura 4A). En hembras con ovarios maduros y ovígeras, el IGS fue de ~4% desde intermuda C hasta D1'''. En cambio, el IHS de 6.03% en Do fue mayor (p<0.05) que en los demás estados de muda, que variaron alrededor de 4.5%. Los IGS e IHS de las hembras con ovarios maduros y ovígeras fueron diferentes (p<0.027) en D1', mas no en los demás estados de muda (Figura 4B).
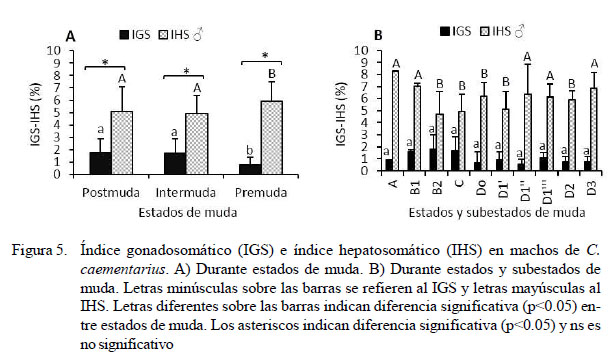
IGS e IHS de Machos en el Ciclo de Muda
En camarones machos, el IGS fue bajo (p=0.057) en postmuda (1.74%) e intermuda (1.71%) y aún más bajo (p<0.05) en premuda (0.78%). En cambio, el IHS fue mayor (p=0.024) en premuda (5.92%), pero en intermuda (4.93%) y postmuda (5.08%) fue similar (p= 0.913). Los IGS e IHS de los camarones machos fueron diferentes (p<0.05) en cada estado de muda y subestado (Figura 5A). Durante el ciclo de muda, el IGS de los camarones se mantuvo alrededor de 1%; en cambio, el IHS fue de 8.27% en postmuda A, que disminuyó (p<0.05) a 4.72% en B2 y se mantuvo alrededor de 6 % durante la premuda. Ambos índices variaron inversamente a través del ciclo de muda (Figura 5B).
DISCUSIÓN
En hembras de C. caementarius se observó una relación inversa, pero significa- tiva entre el IGS y el IHS, lo que sugiere transferencia de nutrientes del hepatopáncreas para la maduración del ovario; similar a lo ocurrido en hembras de Litopenaeus vannamei (Palacios et al., 2000), Macrobrachium rosenbergii (Cavalli et al., 2001; Revathi et al., 2012), M. amazonicum (Ribeiro, 2006), C. quadricarinatus (Rodríguez-Gonzales et al., 2006), Aegla platensis (Oliveira et al., 2011) y M. olfersii (Magalhães et al., 2012), entre otros.
Durante la maduración del ovario de C. caementarius hubo incremento abrupto del IGS desde el estado III hasta el IV, similar a lo sucedido en M. amazonicum (Ribeiro, 2006), M. olfersii (Magalhães et al., 2012) y M. rosenbergii (Revathi et al., 2012), debido al crecimiento de ovocitos. Además, el incremento paulatino del IGS desde intermuda hasta premuda tardía (D2 y D3) es evidencia de la culminación de la maduración del ovario y, en este caso, la hembra queda lista para la muda reproductiva, como ha sido informado previamente en C. caementarius (Reyes, 2014). En Nephrops norvegicus y en M. rosenbergii, el incremento del IGS desde intermuda se debe a la síntesis y acumulación activa de vitelogenina en los ovocitos, cuyos niveles permanecen altos en premuda, lo que causa un desarrollo más rápido de los ovarios (Okumura y Aida, 2000; Rosa y Nunes, 2002).
En cambio, el IHS de las hembras de C . caementarius incrementó desde postmuda tardía (B1) hasta premuda reciente (D1'), lo cual está de acuerdo con lo informado para la misma especie, donde el incremento del IHS desde postmuda tardía (B1) sugiere que los nutrientes se acumularían desde este subestado de muda, el cual coincide con el reinicio de la ingestión de alimento después de la ecdisis (Reyes, 2014). Luego, el IHS fue constante hasta el final de premuda (D3); es decir, conforme maduraba el ovario, lo que indica transferencia de nutrientes del hepatopáncreas hacia el ovario para compensar el gasto de energía durante la maduración de ovocitos hasta alcanzar el estado de ovario maduro; similar a lo sucedido en Parastacus varicosus (Castiglioni et al., 2006), M. rosenbergii (Ribeiro, 2006) y A. platensis (Sokolowicz et al., 2006; Oliveira et al., 2011). Además, es probable que la ingesta de alimento contribuyó con mantener altos IHS en el periodo de maduración y durante premuda, toda vez que las hembras de C. caementarius ingieren alimento en premuda, excepto durante premuda tardía (D2 y D3) y postmuda temprana (A1 y A2) (Reyes, 2014).
En hembras de C. caementarius, los mayores IHS ocurrieron entre C y D1' del ciclo de muda, tanto en hembras con ovarios inmaduros como en aquellas con ovarios maduros sean, en ambos casos, ovígeras y no ovígeras, lo que indica que en estos esta- dos de muda se produciría la máxima acumulación de nutrientes en el hepatopáncreas. Estos resultados están de acuerdo con lo in- formado por Reyes (2014) para hembras de la misma especie, en donde las mayores reservas energéticas se dan entre los estados de muda C y D1 con las cuales soportan la muda, el desove y el mantenimiento de la masa embrionaria. Los mayores niveles de vitelogenina en hembras de M. rosenbergii ocurre entre los estados de muda C y D1 (Okumura y Aida, 2000).
En hembras de C. caementarius con ovarios maduros y no ovígeras, el más alto IGS (8.28%) y, a la vez, el más bajo IHS (1.72%) se obtuvo en postmuda A. Estos resultados indican que el máximo estado de madurez ovárica se alcanzó después de la muda prenupcial, y que la transferencia de nutrientes del hepatopáncreas hacia el ovario alcanzó su máximo nivel en estado de postmuda A, toda vez que la especie con ovarios maduros y en postmuda A se encuentra lista para apareamiento y desove (Reyes, 2014). Además, se conoce que no hay ingestión de alimento durante premuda tardía (D2 y D3), la ecdisis y en postmuda A (Reyes et al., 2002). En hembras C. quadricarinatus, el más alto IGS (8% a 9%) se alcanza en estado de posvitelogénesis, lo que indica el gran esfuerzo en la maduración, para luego culminar con el desove (Rodríguez-González et al., 2006). En M. rosenbergii, similares valores del IGS indican completa maduración del ovario (Revathi et al., 2012).
La disminución del IGS de C. caementarius desde 1.57% en posmuda B1 hasta 0.47% en posmuda B2 indicaría reabsorción del ovario remanente, probablemente para compensar los requerimientos de energía después del desove. Reabsorción de ovocitos no desovados en el ovario es evidenciado en N. norvegicus (Rosa y Nunes, 2002) y Astacus astacus (Luciæ et al., 2006), siendo esta reabsorción probablemente una estrategia fisiológica de las hembras de crustáceos para compensar la energía empleada en los procesos de reproducción y muda, aparte de la que obtienen por ingestión de alimento, pues se conoce que las hembras de C. caementarius se agotan después del desove y tardan una semana en reponerse del estrés fisiológico que involucra el proceso de premuda hasta alcanzar la ecdisis preapareamiento (Reyes, 2014).
Las hembras de C. caementarius con ovarios maduros y ovígeras mantuvieron el IGS alrededor de 4% y el IHS alrededor de 6% durante intermuda y premuda temprana, similar con aquellas con ovarios maduros y no ovígeras en los mismos estados de muda. Estos resultados indican que las hembras maduras y ovígeras tendrían una segunda muda reproductiva, como ha sido informado en esta especie (Reyes, 2014) y en M. olfersii (Mossolin y Bueno, 2002) y M. amazonicum (Sampaio et al., 2007).
En los machos de C. caementarius los IGS fueron bajos (1.74 a 0.78%) y los IHS altos (5.08 a 5.92%) durante el ciclo de muda. Lo contrario sucedió en las hembras, cuyo IGS fue alto (3.44 a 3.85%) y los IHS ligera- mente bajos (2.34 a 4.83%). Estos resultados indican que la especie tiene diferente estrategia reproductiva que depende del sexo, donde los camarones hembras invierten más energía para la reproducción, mientras que los machos invierten más energía para el crecimiento, similar a lo informado para machos de Chasmagnathus granulata (López y Rodríguez, 1999), A. astacus (Luciæ et al., 2006), M. olfersii (Magalhães et al., 2012) y en diversos cangrejos (Senkman, 2014).
Además, Magalhães et al. (2012) sugirieron que la relación inversa entre el peso del sistema reproductor y el hepatopáncreas en machos de M. olfersii está relacionado con el proceso de muda que requiere mucha energía. El análisis del IGS e IHS con los estados de muda en machos de C . caementarius refleja esta relación, ya que el IGS se mantuvo bajo y el IHS alto durante el ciclo de muda. Similares resultados se obtuvieron en machos de M. rosenbergii donde los mayores IHS indican alta tasa de asimilación de alimento y mayor crecimiento (Sureshkumar y Kurup, 1999; Okomura y Hara, 2004). La acumulación de reservas de nutrientes en machos de M. amazonicum, producto de la dieta con alta proteína, se emplea para el metabolismo, el crecimiento del cuerpo y para el sistema reproductor (Papa et al., 2004; Gerotto et al., 2015).
En machos de C. caementarius, el ligero incremento del IGS y la disminución del IHS desde postmuda tardía hasta intermuda (p<0.05), sugieren la necesidad de madurar rápidamente y asegurar la producción de gametos para apareamiento. Similar comportamiento sucede en M. rosenbergii, donde los cambios de la actividad espermatogénica se intensifican en intermuda y los animales tienen los testículos llenos con espermatozoides (Okomura y Hara, 2004). Esto explica también los bajos IGS obtenidos durante la premuda que indicarían acentuado apareamiento de los machos de C. caementarius, como sucede en L. vannamei, donde las ampollas terminales se encuentran llenas de espermatozoides en intermuda y postmuda tardía, pero vacías en premuda (Parnes et al., 2006). Sin embargo, los mayores IHS mantenidos durante el ciclo de muda de los camarones machos, explicarían la necesidad de nutrientes para soportar otras actividades fisiológicas diferentes a la maduración gonadal. En crustáceos machos, la mayor contribución de energía es utilizada en la muda (Vega-Villasante et al., 2000), en el crecimiento de quelípodos, en la interacción y en el crecimiento somático, como es sugerido en Uca lactea (Yamaguchi , 2001), M. rosenbergii (Karplus, 2005), M. olfersii (Magalhães et al. 2012), Rhynchocinetes brucei (Thiel et al., 2010), A. platensis (Oliveira et al., 2011) y en C. caementarius (Rojas et al., 2012).
Los resultados de la presente investigación sugieren que la relación del IGS con el IHS y, además, con el ciclo de muda y el estado de maduración gonadal de C . caementarius son indicadores de la condición reproductiva de la especie. Sin embargo, es conveniente determinar la variación de nutrientes del hepatopáncreas durante el ciclo de muda, durante el proceso de maduración gonadal y durante la incubación de la masa embrionaria en épocas reproductivas y no reproductivas de la especie.
CONCLUSIONES
En hembras de C. caementarius, el IGS incrementó conforme maduró el ovario (p<0.05) y fue máximo (8.28%) en post muda A y mínimo (0.47% ) en postmuda B2, pero incrementó durante intermuda y premuda.
El IHS en hembras de C. caementarius varió de manera inversa con el IGS (p<0.05), donde mayores valores del IGS y del IHS se observaron en hembras maduras ovígeras y no ovígeras.
En machos de C. caementarius, los IGS bajos (1.74 a 0.78%) y los IHS altos (5.08 a 5.92%) sugieren que estos no invierten nutrientes en la reproducción.
LITERATURA CITADA
1 . Bazán M, Gámez S, Reyes WE. 2009. Rendimiento reproductivo de hembras de Cryphiops caementarius (Crustacea: Palaemonidae) mantenidas con alimento natural. Rev Peru Biol 16: 191-193. doi: 10.15381/rpb.v16i2.205 [ Links ]
2. Carrillo G, Pacora F, Risco R, Zerpa L. 2012. Plan estratégico para el cama- rón de río. Tesis de Magíster. Lima: Pontificia Universidad Católica del Perú. 177 p. [ Links ]
3. Castiglioni D, Oliveira G, Bond- Buckup L. 2006. Dinâmica do desenvolvimento das gônadas de Parastacus varicosus (Crustacea, Decapoda, Parastacidae). Iheringia Ser Zool 96: 413-417. doi: 10.1590/S0073- 47212006000400004 [ Links ]
4. Cavall i RO, Tamt in M, Lavens P, Sorgeloos P. 2001. Variations in lipid classes and fatty acid content in tissues of wild Macrobrachium rosenbergii (de Man) females during maturation. Aquaculture 193: 311-324. doi: 10.1016/ S0044-8486(00)00497-X [ Links ]
5. Ferré LE, Medesani DA, García CF, Grodzielski M. 2012. Vitellogenin levels in hemolymph, ovary and hepatopancreas of t he f reshwater crayfi sh Cherax quadricarinatus (Decapoda: Parastacidae) during the reproductive cycle. Rev Biol Trop 60: 253-261. doi: 10.15517/ rbt.v60i1.2759 [ Links ]
6. Gerotto A, Mantoan PV, Gaeta HH, Augusto A. 2015. The effect of three commercial feeds used in aquaculture hatcheries on physiology of the prawn Macrobrachium amazonicum (Decapoda, Palaemonidae). Bol Inst Pesca 41: 1013-1024. [ Links ]
7. Karplus I. 2005. Social control of growth in Macrobrachium rosenbergii (De Man): a review and prospects for future research. Aquac Res 36: 238- 254. doi: 10.1111/j.1365-2109.2005.- 01239.x [ Links ]
8. Lip GB. 1976. Primera madurez sexual del camarón de río Cryphiops caementarius Molina, 1782 (Natantia, Palaemonidae) en el río Moche. Tesis de Bachiller. Trujillo: Univ. Nacional de Trujillo, Perú. 85 p. [ Links ]
9. López LS, Rodríguez EM. 1999. Annual reproduction and growth of adult crabs Chasmagnathus granulata (Crustacea, Brachyura, Grapsidae). Cah Biol Mar 40: 155-164. [ Links ]
10. Luciæ A, Erben E, Lackoviæ G. 2006. Morphological changes in Astacus astacus gonads during the reproductive cycle. B Fr Peche Piscic 380-381: 1183- 1196. doi: 10.1051/kmae:2006020 [ Links ]
11. Magalhães T, Mossolin E, Mantelatto F. 2012. Gonadosonatic and hepatosomatic indexes of t he freshwat er Macrobrachium olfersii (Decapoda, Palaemonidae) from São Sebastião Island, Southastern Brazil. PanAm J Aquatic Sci 7: 1-9. [ Links ]
12. Marcolin C, Carqueija C, Tozetto S, Oliveira D, Côrrea A. 2008. Alterações morfológicas do hepatopâncreas de Ucides cordatus (Linnaeus, 1763) (Crustacea, Decapoda, Ocypodidae) em relação aos estádios de intermuda e prémuda inicial. Zoociências 10: 97-104. [ Links ]
13. Méndez M. 1981. Clave de identificación y distribución de los langostinos y camarones (Crustacea: Decapoda) del mar y ríos de la costa del Perú. Bol Inst Mar Perú 5: 1-170. [ Links ]
14. Meruane J, Rivera M, Morales C, Galleguillos C, Hosokawa H. 2006. Producción de juveniles en condiciones de labor atorio del camarón de río Cryphiops caementarius (Decapoda: Palaemonidae) en Coquimbo, Chile. Gayana 70: 228-236. doi: 10.4067/S0717- 65382006000200010 [ Links ]
15. Moreno JE, Méndez CA, Meruane JA, Morales MC. 2012. Descripción histológica y caracterización de los es- tados de madurez gonadal de hembras de Cryphiops caementarius (Molina, 1782) (Decapoda: Palaemonidae). Lat Am J Aquat Res 40: 668-678. doi: 103856/vol40-issue3-fulltext-15 [ Links ]
16. Moscoso V. 2012. Catálogo de crustáceos decápodos y estomatópodos del Perú. Bol Inst Mar Perú 27: 1-209. [ Links ]
17. Mossolin EC, Bueno SLS. 2002. Reproductive biology of Macrobrachium olfersii (Decapoda, Palaemonidae) in São Sebastião, Brazil. J Crustacean Biol 22: 367-376. doi: 10.1163/20021975-99990244. [ Links ]
18. Okumura T, Aida K. 2000. Hemolymph vitellogenin levels and ovarian development during the reproductive and non-reproductive molt cycles in the giant freshwater prawn Macrobrachium rosenbergii. Fisheries Sci 66: 678-685. doi: 10.1046/j.1444-2906.2000.00108.x [ Links ]
19. Okumura T, Hara M. 2004. Androgenic gland cell structure and spermatogenesis during the molt cycle and correlation to morphotypic differentiation in the giant freshwater prawn, Macrobrachium rosenbergii. Zool Sci 21: 621- 628. doi: 10.2108/zsj.21.621 [ Links ]
20. Oliveira GT, Hack C, Almerão M, Bond-Buckup G, Dutra BK. 2011. Tissue composition and haemolymphatic metabolites during gonadal development in Aegla platensis (Crustacea, Deca- poda) maintained in experimental culture. Rev Bras Biociências 9: 64-71. [ Links ]
21. Palacios E, Ibarra A, Racotta S. 2000. Tissue biochemical composition in relation to multiple spawning in wild and pond reared Penaeus vannamei broodstock. Aquaculture 185: 353-371. doi: 10.1016/ S0044-8486(99)00362-2. [ Links ]
22. Papa LP, Vicentini IBF, Ribeiro K, Vi centini A, Pezzato LE. 2 00 4. Diferenciação morfotípica de machos do camarão de agua doce Macrobrachium amazonicum a partir da análise do hepatopâncreas e do sistema reprodutor. Acta Scient Anim Sci 26: 463-467. doi: 10.4025/actascianimsci.v26i4.1720 [ Links ]
23. Parnes S, Raviv S, Shechter A, Sagi A. 2006. Males also have their time of the month! Cyclic disposal of old spermatophores, timed by the molt cycle, in a marine shrimp. J Exp Biol 209: 4974- 4983. doi: 10.1242/jeb.02586 [ Links ]
24. [Produce] Ministerio de la Producción. 2017. Anuario estadístico pesquero y acuícola 2016. La actividad productiva del sector en números. Perú. [Internet]. Disponible en: http://ogeiee.produce.gob.pe/index.php/shortcode/oee-documentos-publicaciones/publicaciones-anuales/item/775-anuario-estadistico-pesquero-y-acuicola-2016 [ Links ]
25. Reyes WE, Pilco M, Olórtegui K. 2002. Efecto de la ablación unilateral del pedúnculo ocular en la maduración ovárica y en el ciclo de muda de Cryphiops caementarius (Molina, 1782) (Decapoda: Palaemonidae) en laboratorio. En: I Congreso Iberoamericano Virtual de Acuicultura. España. [ Links ]
26. Reyes W, Lujan H. 2003. Estados y subestados del ciclo de muda del camarón de río (Cryphiops caementarius Molina, 1782) (Crustacea: Decapoda: Palaemonidae). En: II Congreso Iberoamericano Virtual de Acuicultura. Zara- goza, España. [ Links ]
27. Reyes WE. 2014. Interrelación del ciclo de muda, el ciclo ovárico y el desarrollo embrionario en hembras de Cryphiops caementarius Molina 1782 (Crustacea, Palaemonidae). Intropica 9: 33-42. [ Links ]
28. Reyes W, Ferres K, Sernaqué J. 2018. Dimorfismo sexual del camarón Cryphiops caementarius (Crustacea, Palaemonidae). En: Mem XVIII Congre- so Nacional de Estudiantes de Biología. Ancash, Perú [ Links ].
29. Revathi P, Iyapparaj P, Munuswamu N, Krishnan M. 2012. Vitellogenesis during the ovarian development in freshwater female prawn Macrobrachium rosenbergii (De Man). Int J Aquatic Sci 3: 13-27. [ Links ]
30. Ribeiro K. 2006. Aspectos estruturais do hepatopáncreas, desenvolvimento ovocitário e caracterização hormonal de fêmeas de Macrobrachium amazonicum durante as fases de maturação gonadal. Tese Doutorado. Jaboticabal: Universidade Estadual Paulista. Brasil. 109 p. [ Links ]
31. Rodríguez-González H, Hernández- Llamas A, Villarreal H, Saucedo P, García-Ulloa M, Rodríguez-Jaramillo C. 2006. Gonadal development and biochemical composition of female crayfish Cherax quadricarinatus (Decapoda: Parastacidae) in relation to gonadosomatic index at first maturation. Aquaculture 254: 637-645. doi: 10.1016/ j.aquaculture.2005.10.020 [ Links ]
32. Rojas R, Morales MC, Rivadeneira MM, Thiel M. 2012. Male morphotypes in the Andean river shrimp Cryphiops caementarius (Decapoda: Caridea): morphology, coloration and injuries. J Zool 288: 21-32. doi: 10.1111/j.1469- 7998.2012.00922.x [ Links ]
33. Rosa R, Nunes ML. 2002. Changes in organ indices and lipid dynamics during the reproductive cycle of Aristeus antennatus, Parapenaeus longirostris, and Nephrops norvegicus (Decapoda) from the portuguese south coast. Crustaceana 75: 1095-1105. [ Links ]
34. Sampaio CMS, Silva RR, Santos JA, Sales SP. 2007. Reproductive cycle of Macrobrachium amazonicum females (Crustacea, Palaemonidae). Braz J Biol 67: 55 1-559. doi : 10.1590/S1519-69842007000300022 [ Links ]
35. Senkman LE. 2014. Biología reproductive de cangrejos tricodactílidos del río Paraná medio. Tesis Doctoral. Argentina: Univ. Nacional de la Plata, Argentina. 177 p. [ Links ]
36. Sokolowicz C, Bond-Buckup G, Buckup L. 2006. Dynamics of gonadal development of Aegla platensis Schmitt (Decapoda, Anomura, Aeglidae). Rev Bras Zool 23: 1153-1158. doi: 10.1590/ S0101-81752006000400023 [ Links ]
37. Sureshkumar S, Kurup BM. 1999. Variations in hepatosomatic index and biochemical profiles among the male mor p hot ypes o f M ac ro br ac hi um rosenbergii. Aquaculture 176: 285-293. doi: 10.1016/S0044-8486(99)00061-7 [ Links ]
38. Thiel M, Chak STC, Dumont CP. 2010. Male morphotypes and mating behavior of the dancing shrimp Rhynchocinetes brucei (Decapoda: Caridea). J Crus- tacean Biol 30: 580-588. doi: 10.1651/09- 3272.1 [ Links ]
39. Vega-Villasante F, Nolasco H, Civera R, González R, Oliva M. 2000. Alter- nativa para la alimentación del camarón en cultivo: el manejo de la muda. En: V Simposio Internacional de Nutrición Acuícola. Mérida, Yucatán, México. [ Links ]
40. Viacava M, Aitken A, Llanos J. 1978. Estudio del camarón en el Perú 1975-1976. Bol Instituto Mar del Perú 3: 161-233. [ Links ]
41. Wasiw J, Yépez V. 2015. Evaluación poblacional del camarón Cryphiops caementarius en ríos de la costa sur del Perú. Rev Inv Vet Perú 26: 166-181. doi: 10.15381/rivep.v26i2.11103 [ Links ]
42. Yamaguchi T. 2001. Seasonal change of the hepatopancreas index in the ma- les of the fiddler crab, Uca lactea. Crustaceana 74: 627-634. doi: 10.1163/ 156854001750377902 [ Links ]
43. Zara F, Toyama M, Caetano F, López- Greco L. 2012. Spermatogenesis, spermatophore, and seminal fluid production in the adult blue crab Callinectes danae (Portunidae). J Crustacean Biol 32: 249-262. doi: 10.1163/193724011X615479 [ Links ]
Recibido: 20 de diciembre de 2018
Aceptado para publicación: 10 de julio de 2019