Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Veterinarias del Perú
versión impresa ISSN 1609-9117
Rev. investig. vet. Perú vol.30 no.3 Lima jul./set 2019
http://dx.doi.org/10.15381/rivep.v30i3.16606
ARTÍCULOS PRIMARIOS
Prevalencia de Giardia spp en roedores (Rattus spp) de un zoológico de Lima Metropolitana
Prevalence of Giardia spp in rodents (Rattus spp) of a zoo in Metropolitan Lima
Cynthia Casana P.1, Amanda Chávez V.1,2, Deisy Abad-Amerí1, Rosa Pinedo V.1
1 Laboratorio de Microbiología y Parasitología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú
2 E-mail: achavezv@unmsm.edu.pe
RESUMEN
El objetivo del estudio fue determinar la prevalencia de Giardia spp en roedores (Rattus rattus y Rattus norvegicus) capturados en un zoológico de Lima Metropolitana, así como la posible asociación entre la presencia del parásito con las variables especie, sexo y edad de las ratas. Se capturaron 127 roedores (Rattus spp) entre febrero de 2013 y agosto de 2016 mediante el uso de trampas de captura viva «Tomahawk». La manipulación de los roedores y la recolección de las muestras cumplieron con los estándares de bioseguridad y normas de procesamiento de acuerdo con los protocolos del Centro de Enfermedades Infecciosas y Prevención de Atlanta (CDC). Muestras del intestino delgado y tracto digestivo posterior (ciego, colon y recto) fueron colectadas y conservadas con formol al 10%. Se utilizó la técnica de Ritchie modificado, considerándose como muestra positiva la presencia de alguna forma parasitaria de Giardia spp (trofozoito o quiste). La prevalencia de Giardia spp en los roedores fue 5.5 ± 0.04% (7/127), siendo de 2.1% en R. rattus (1/48) y 7.6% en R. norvergicus (6/79). No se encontró asociación significativa entre la frecuencia de Giardia spp y las variables especie, sexo y edad. Se reporta una baja prevalencia de Giardia spp en roedores capturados en el zoológico; sin embargo, podría existir un riesgo potencial de infección parasitaria para los concurrentes, principalmente niños y ancianos, así como animales y trabajadores de la institución.
Palabras clave: Giardia spp; roedores; zoológico; zoonosis
ABSTRACT
The aim of this study was to determine the prevalence of Giardia spp in rodents (Rattus rattus and Rattus norvegicus) captured in a zoo in Metropolitan Lima, as well as the possible association between the presence of the parasite with the species, sex and age of the rats. A total of 127 rodents (Rattus spp) were captured between February 2013 and August 2016 by using live capture traps «Tomahawk». The handling of the rodents and the collection of the samples complied with biosafety standards and processing standards in accordance with the protocols of the Center for Infectious Diseases and Prevention of Atlanta (CDC). Samples of the small intestine and posterior digestive tract (caecum, colon and rectum) were collected and preserved with 10% formaldehyde. The modified Ritchie technique was used, considering as a positive sample the presence of some parasitic form of Giardia spp (trophozoite or cyst). The prevalence of Giardia spp in rodents was 5.5 ± 0.04% (7/127), being 2.1% in R. rattus (1/48) and 7.6% in R. norvergicus (6/79). No significant association was found between the frequency of Giardia spp and the species, sex and age. A low prevalence of Giardia spp is reported in rodents captured at the zoo; however, there could be a potential risk of parasitic infection for those attending, mainly children and the elderly, as well as animals and workers of the institution.
Key words: Giardia spp; rodents; zoo; zoonose
INTRODUCCIÓN
El protozoario flagelado Giardia spp se aloja de forma oportunista en el tracto intestinal de una amplia gama de hospedadores, tales como los animales domésticos, silvestres y el hombre. Este parásito ocasiona la giardiasis, enfermedad considerada como una zoonosis por la Organización Mundial de la Salud (Adam, 2001).
La transmisión se realiza por la vía oralfecal, mediante contacto directo, ingestión de agua o alimentos contaminados con heces humanas o de animales infectados con el parásito (DuPont, 2013). La aparición de signos clínicos como diarrea, dolor abdominal y pérdida de peso dependerá de la edad, estado inmune, cantidad de quistes transmitidos y el genotipo del parásito (Molina et al., 2008). Así mismo, la tasa de infección se encuentra directamente proporcional a los malos hábitos y condiciones de higiene, siendo su presencia mucho mayor en los países menos desarrollados (Baker, 2007). Se ha podido identificar, según el hospedador, seis especies de Giardia: G. duodenalis en mamíferos, G. agilis en anfibios, G. muris en roedores, G. ardeae y G. psittaci en aves y G. microti en ratas almizcleras y ratones (Feng y Xiao, 2011).
Con el avance de la biología molecular se ha identificado que G. duodenalis tiene potencial zoonótico (Wielinga y Thompson, 2007), habiendo sido subdividido en ocho genotipos (A-H) de acuerdo con la especie, el hospedador y su morfología, siendo los genotipos A y B responsables del 99.2% de giardiasis en humanos (Thompson y Monis, 2004; Sprong et al., 2012). Por otro lado, el genotipo G es propio de roedores (Thompson y Monis, 2004); sin embargo, estudios realizados por Feng y Xiao (2011) y Fernández-Álvarez et al. (2013) encontraron que ratas del género Rattus pueden ser portadores de G. duodenalis genotipo B.
Diversos estudios reportan que, dentro de la familia de roedores, el género Rattus es la especie con más alta tasa de prevalencia de giardiasis (Ayulo y Dammert, 1947; Franjola et al., 1995; Hancke et al., 2011; Zhao et al., 2015). Estos roedores tienen amplia distribución y gran capacidad de adaptación a diversos medioambientes, por lo que su presencia aumenta el riesgo de infección para el hombre (Paramasvaran et al., 2009; Rodríguez et al., 2010).
Son pocos los estudios en el Perú que han evaluado el parasitismo de Giardia spp en roedores, así como su rol como potencial reservorio de este parásito en lugares de esparcimiento público; por ejemplo, en zoológicos, que son áreas de gran afluencia de población vulnerable, como niños y ancianos. La escasez de estos estudios es debido a su baja importancia en términos económicos, la elevada demanda de logística y la dificultad que se tiene para realizar su captura (Perec et al., 2015). Por estas razones, el objetivo del estudio fue determinar la prevalencia de Giardia spp en roedores (Rattus rattus y Rattus norvegicus) capturados en una área de fauna silvestre en cautiverio de Lima Metropolitana, así como correlacionar la presencia del parásito con las variables especie, sexo y edad.
MATERIALES Y MÉTODOS
Lugar de Estudio y Animales
El estudio se realizó en el zoológico Patronato del Parque de las Leyendas, ubicado en el distrito de San Miguel, provincia de Lima, Perú, entre febrero de 2013 y agosto de 2016. Se capturaron 127 roedores (Rattus rattus y Rattus norvegicus) usando trampas de captura viva «Tomahawk» con ayuda de cebos no tóxicos (choclo, pepa de zapallo, carne molida, esencia de vainilla, fruta y tomate). Las trampas fueron colocadas en las diversas áreas del zoológico (costa, sierra, selva y hospital veterinario).
Luego de la captura, se determinó el sexo y se identificó el género y especie mediante el registro de parámetros morfométricos de peso y longitudes de cola, patas, orejas y corporal total (Bonino, 1999; Jarbas et al., 2002). Se consideraron dos grupos etarios: juvenil-subadulto y adulto, donde R. rattus fueron considerados como adultos cuando mostraron pesos mayores de 130 g, mientras que para R. norvegicus cuando presentaban pesos mayores de 200 g (Kataranovski et al., 1994). Así mismo, se emplearon indicadores característicos de madurez sexual, tales como presencia de testículo escrotal en machos y útero grávido o desarrollado en hembras (Franssen et al., 2016).
Muestras y Evaluación Coproparasitológica
La manipulación de los animales y la colección de muestras se realizó en áreas aisladas, especialmente dispuestas por el zoológico y la Facultad de Medicina Veterinaria (FMV) de la Universidad Nacional Mayor de San Marcos (UNMSM), en cumplimiento con los estándares de bioseguridad y normas de procesamiento conforme a los protocolos del Centro de Enfermedades Infecciosas y Prevención de Atlanta (Mills et al., 1998). Todos los procedimientos del presente estudio contemplaron los lineamientos de las buenas prácticas clínicas y de ética en investigación biomédica, en cumplimiento con las normas reglamentadas por el Comité de Ética para el Uso de Animales de Experimentación de la FMV-UNMSM (Expediente 2014-002).
Para la toma de las muestras, los roedores fueron anestesiados mediante inhalación de cloroformo y posterior inyección de ketamina (7.5 mg/kg). Luego fueron sacrificados con sobredosis de pentobarbital sódico (Mills et al., 1998). Durante la necropsia se recolectaron muestras de contenido de la última porción del tracto digestivo, que fueron conservadas en tubos falcón de 15 ml conteniendo formol al 10%. Las muestras fueron procesadas en el Laboratorio de Parasitología de la FMV-UNMSM, mediante la técnica de Ritchie modificado. Esta es una técnica de concentración por sedimentación que permite la identificación de huevos de helmintos gastrointestinales y protozoos. En esta técnica se utilizó gasolina en lugar de éter para liberar las formas parasitarias de las grasas. La técnica posee una sensibilidad que entre 60.8 y 85.7% y una especificidad del 100% (Restrepo et al., 2013; Giraldo y Guatibonza, 2017). Este método permite concentrar las formas parasitarias sin causar alteraciones en su morfología, además de ser económica y rápida.
Análisis Estadístico
La prevalencia de Giardia spp se expresó en forma porcentual con sus respectivos intervalos de confianza al 95% (Daniel, 2002). La posible asociación entre las variables especie, sexo y edad de las ratas con el parasitismo se analizó mediante la prueba de Chi cuadrado utilizando el paquete estadístico Stata v. 12.0.
RESULTADOS Y DISCUSIÓN
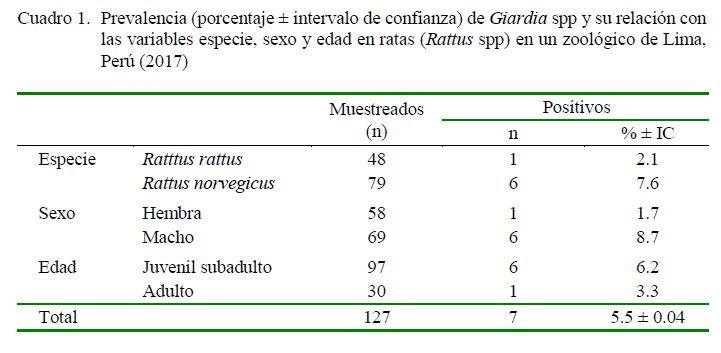
La prevalencia de Giardia spp en roedores del género Rattus procedentes de un área de fauna silvestre en cautiverio de Lima Metropolitana fue de 5.5 ± 0.04% (IC 95%). Así mismo, la prevalencia de Giardia spp para R. rattus fue de 2.1% y para R. norvegicus de 7.6% (Cuadro 1). No se encontró asociación significativa entre la frecuencia de Giardia spp y las variables en estudio (especie, sexo y edad).
De los numerosos estudios coproparasitológicos realizados en roedores, los estudios en protozoos son los menos reportados. En el país solo se cuenta con el estudio de Ayulo y Dammert (1947) en R. norvegicus, quienes reportaron 46.5% de prevalencia total de protozoarios intestinales y 6.2% de prevalencia de Giardia spp. Así mismo, las investigaciones de Hancke et al. (2011) en R. norvegicus en los suburbios de Buenos Aires, Argentina y de Zhao et al. (2015) en granjas y sus zonas aledañas en China, determinaron prevalencias para Giardia spp de 7.5 y 7.1%, respectivamente; resultados similares con los obtenidos en este estudio.
Prevalencias más altas de Giardia spp en roedores han sido reportadas en otros ecosistemas; así, Franjola et al. (1995) determinaron la presencia de G. muris (36.8%) en Mus musculus y R. rattus en Valdivia, Chile; Marino y Brown (1992) hallaron G. intestinalis en R. rattus (61%) y M. musculus (25.3%) en Nueva Zelanda; así mismo, Al-Bashan y Sabra (2012) trabajando con R. rattus y R. norvegicus en Taif, Arabia Saudita y Al-Hindi y Abu-Haddaf (2013) con R. rattus en la Franja de Gaza, Palestina, reportaron prevalencia similares (14.2-14.6%) de G. intestinalis; Backhans et al. (2013) hallaron 6% en M. musculus y 28% en R. norvegicus en roedores de granjas porcinas, avícolas y áreas no agrícolas de Suecia, y Fernández-Álvarez et al. (2013) reportaron la presencia de ooquistes en el 25.4% de roedores (R. rattus, R. norvegicus y M. musculus domesticus) de áreas suburbanas y rurales de las Islas Canarias, España.
La gran variabilidad de prevalencias reportadas demuestra la existencia de factores diversos implicados para la presentación, infección y transmisión de Giardia spp en roedores. En ese sentido, se conoce que las comunidades parasitarias se ven afectadas por el medio ambiente y la historia filogenética del hospedador, así como de su especificidad; además de parámetros biológicos como el tamaño de la población, el hábitat, la dieta, la dispersión, la edad, el sexo y el sistema inmunológico del hospedador (Poulin y Morand, 2004); aspectos que en algunos casos no fueron significativos en el presente estudio.
Las altas prevalencias reportadas, en comparación al presente estudio, pudieron deberse a los ambientes donde fueron realizados que ofrecían mejores condiciones para el desarrollo de roedores sinantrópicos (Rattus spp y Mus musculus), tales como ambientes suburbanos y rurales (Fernández-Álvarez et al., 2013), con medidas sanitarias mínimas, escasez de agua y potabilidad mínima o nula (Neghme y Silva, 1971); así como en granjas (Backhans et al., 2013), donde hay mayor contacto con animales y desechos orgánicos e inorgánicos (Neghme y Silva, 1971)
Si bien, en el presente estudio, no se encontró asociación entre la frecuencia de Giardia spp y las variables especie, sexo y edad; R. norvegicus fue la especie más representada en las capturas (79/127). Esto se debe a que esta especie se caracteriza por ser más abundante, dadas sus estrategias de sobrevivencia que han permitido su adaptación a diferentes ecosistemas, principalmente en entornos urbanos. Así mismo, su presencia se correlaciona directamente con la eliminación inadecuada de residuos antropogénicos (Traweger et al., 2006).
La influencia del sexo sobre el parasitismo en roedores no está del todo determinado. Se dispone de evidencia que indica cierta predisposición sexual a la presentación de enfermedades parasitarias asociado a diferencias inmunológicas, vinculado a esteroides sexuales, donde los machos son más susceptibles a las infecciones (Klein, 2004). Del mismo modo, se indica que los animales jóvenes suelen ser más susceptibles a infecciones parasitarias al poseer un sistema inmunológico poco desarrollado (Klein, 2004).
Diversos estudios han demostrado que los roedores están implicados en la trasmisión de Giardia spp, habiéndose aislado las especies G. microti, G. muris y G. duodenalis de roedores naturalmente infectados (ratas, ratones, topos, castores y gerbos) (Bemrick y Erlandsen, 1988; Lebbad et al., 2010; Backhans et al., 2013), siendo G. muris específica de roedores (ratones, ratas, hámster y roedores silvestres) (Baker, 2007) y G. duodenalis la única que puede infectar al hombre, pero que además posee la capacidad de infectar animales domésticos y silvestres (Wielinga y Thompson, 2007).
No obstante la baja prevalencia de Giardia spp (5.5%) reportada en este estudio en roedores capturados de un zoológico de Lima, su presencia tiene gran importancia sanitaria, si se considera que la giardiasis es una de las enfermedades parasitarias más comunes en el medio en animales domésticos (14-35%) y en humanos (60%) (Lujan, 2006); pudiendo existir un riesgo potencial de infección parasitaria para los concurrentes al zoológico, principalmente niños, ancianos y personas inmunosuprimidas (McMillian et al., 2007; Wesse et al., 2007; Erdozain et al., 2013). Es importante indicar que en un estudio en profesionales que laboran en zoológicos y zoocriaderos de Lima, Perú, se encontró que el 14.4% de los encuestados contrajo en algún momento enfermedades zoonóticas, siendo un 66.6% ocasionadas por parasitosis (giardiasis, acarosis y toxoplasmosis) (Lecaros et al., 2010).
En estado silvestre, los animales poseen cierta resistencia natural que les permite controlar las enfermedades parasitarias, existiendo un estado de equilibrio entre el parásito y el anfitrión, que rara vez conducen a un cuadro severo a menos que ocurran eventos de estrés (Stancheva, 2013). Sin embargo, estos animales en cautiverio pueden llegar a sucumbir a las infecciones parasitarias debido al estrés ambiental, el cambio en las condiciones de vida y las limitaciones de espacio (Mir et al., 2016). Estudios sobre la presentación de Giardia spp en animales silvestres criados en zoológicos reportan diversas prevalencias. Así, a nivel de América del Sur, Varela y Rojas (2013) hallaron un 37.8% en el Zoológico de Matecaña, Colombia, Fajardo et al. (2014) reportaron 12.7% en el Zoológico de Cali, Colombia, y Figueiroa et al. (2001) hallaron un 6.9% en el Parque Dois Irmãos, Brasil. Por otro lado, en Europa, se encontró una prevalencia de 29% en el zoológico de Zagreb, Croacia (Beck et al., 2011), de 8.9% en el zoológico deAmberes, Bélgica (Geurden et al., 2009) y en Asia, en un zoológico de Japón, se encontró en un nivel de 1% (Matsubayashi et al., 2005). Con relación al Perú, Aranda et al. (2013) reportaron la presencia de Giardia spp en 11.1% de los félidos de cuatro zoológicos, y Acosta et al. (2015) encontró este parásito en Panthera tigris en el zoológico Patronato del Parque de las Leyendas.
CONCLUSIONES
-
La prevalencia de Giardia spp en roedores (Rattus rattus y Rattus norvegicus) capturados en un zoológico de Lima fue 5.5 ± 0.04% (7/127).
-
No se encontró asociación significativa entre la presencia de Giardia spp y las variables especie, sexo y edad de los roedores.
Literatura citada
1. Acosta ZM, Tantaleán VM, Serrano ME. 2015. Identificación de parásitos gastrointestinales por coproscopía en carnívoros silvestres del zoológico Parque de las Leyendas, Lima, Perú. Rev Inv Vet Perú 26: 282-290. doi: 10.15381/rivep.v26i2.11000 [ Links ]
2. Adam RD. 2001. Biology of Giardia lamblia. Clin Microbiol Rev 14: 447-475. doi: 10.1128/CMR.14.3.447-475.2001 [ Links ]
3. Al-Bashan MM, Sabra SM. 2012. Prevalence of some enteric parasites in rats at Taif governorate with special reference to associated pathogenic bacteria. Afr J Microbiol Res 6: 3431-3439. doi: 10.5897/AJMR11.1356 [ Links ]
4 . Al-Hindi AI, Abu-Haddaf E. 2013. Gastrointestinal parasites and ectoparasites biodiversity of Rattus rattus trapped from Khan Younis and Jabalia in Gaza strip, Palestine. J Egyptian Soc Parasitol
5. Aranda C, Serrano-Martínez E, Tantaleán M, Quispe M, Casas G. 2013. Identificación y frecuencia de parásitos gastrointestinales en félidos silvestres en cautiverio en el Perú. Rev Inv Vet Perú 24: 360-368. doi: 10.15381/rivep.v24i3.2585 [ Links ]
6. Ayulo V, Dammert O. 1947. Survey del parasitismo intestinal de las ratas grises (Mus norvegicus) en la ciudad de Lima. Rev Peru Med Exp Salud Pública 6: 1-4. [ Links ]
7. Baker D. 2007. Flynn’s parasites of laboratory animals. 2nd ed. Iowa: Blackwell Publishing. 830 p.
8. Backhans A, Jacobson M, Hansson I, Lebbad M, Lambert ST, Gamemelgard E, Saager M, et al. 2013. Occurrence of pathogens in wild rodents caught on Swedish pig and chicken farms. Epidemiol Infect 141: 1885-1891. doi: 10.1017/S0950268812002609 [ Links ]
9. Beck R, Sprong H, Bata I, Lucinger S, Pozio E, Caccio SM. 2011. Prevalence and molecular typing of Giardia spp in captive mammals at the zoo of Zagreb, Croatia. Vet Parasitol 175: 40-46. doi: 10.1016/j.vetpar.2010.09.026. [ Links ]
10. Bemrick J, Erlandsen L. 1988. Giardiasis is it really a zoonosis? Parasitol Today 4: 69-71. doi: 10.1016/ 0169-4758(88)90198-6 [ Links ]
11. Bonino N. 1999. Manual para el control de roedores en el ámbito domiciliario. Argentina: Instituto Nacional de Tecnología Agropecuaria INTA. 13 p. [Internet]. Disponible en: https://inta.gob.ar/sites/default/files/script-tmpcontrol_de_roedores.pdf [ Links ]
12. Daniel W. 2002. Bioestadística. Base para el análisis de las ciencias de la salud. 4° ed. México: Limusa Wiley. 755 p. [ Links ]
13. DuPont HL. 2013. Giardia: both a harmless commensal and a devastating pathogen. J Clin Invest 123: 2352-2354. doi: 10.1172/JCI69932 [ Links ]
14. Erdozain G, KuKanich K, Chapman B. 2013. Observation of public health risk behaviours, risk communication and hand hygiene at Kansas and Missouri petting zoos 2010-2011. Zoonoses Public Hlth 60: 304-310. doi:10.1111/j.18632378.2012.01531.x [ Links ]
15. Fajardo SJ, Lasso NA, Mera EC, Peña SJ, Zapata VJ, Rojas CC. 2014. Enteroparásitos con potencial zoonótico en animales en cautiverio del Zoológico de Cali, Colombia. Neotrop Helminthol 8: 279-290. [ Links ]
16. Feng Y, Xiao L. 2011. Zoonotic potential and molecular epidemiology of Giardia species and giardiasis. Clin Microbiol Rev 24: 110-140. doi: 10.1128/CMR.0003310 [ Links ]
17. Fernández-Álvarez A, Martin A, Abreu N, Feliu C, Hugot JP, Valladares B, Foronda P. 2013. Identification of a novel assemblage G subgenotype and a zoonotic assemblage B in rodent isolates of Giardia duodenalis in the Canary Islands, Spain. Parasitology 141: 206-215. doi: 10.1017/S003118201300139X [ Links ]
18. Figueiroa M, Bianque J, Dowell M, Alves R, Evencio A. 2001. Perfil coproparasitológico de mamíferos silvestres en cautiverio en el estado de Pernambuco, Brasil. Parasitol Día 25: 121-125. doi: 10.4067/S0716-07202001000300009 [ Links ]
19. Franjola R, Soto G, Montefusco A. 1995. Prevalence of protozoa infections in synantropic rodents in Valdivia City. Bol Chil Parasitol 50: 66-72. [ Links ]
20. Franssen F, Swart A, Van Knapen F, Van der Giessen J. 2016. Helminth parasites in black rats (Rattus rattus) and brown rats (Rattus norvegicus) from different environments in the Netherlands. Infect Ecol Epidemiol 6: 31413. doi: 10.3402/iee.v6.31413 [ Links ]
21. Geurden T, Goossens E, Levecke B, Vercammen F, Vercruysse J, Claerebout E. 2009. Occurrence and molecular characterization of Cryptosporidium and Giardia in captive wild ruminants in Belgium. J Zoo Wildlife Med 40: 126-130. doi: 10.1638/20080152.1 [ Links ]
22. Giraldo J, Guatibonza A. 2017. Comparación de sensibilidad y especificidad de dos técnicas de diagnóstico directo: Kato-Katz-Saf y Ritchie–Frick (formolgasolina) en examen coproparasitológico para la identificación de estadios infectivos de geohelmintos en población infantil en edad preescolar y escolar. Rev Fac Med 25: 22-41. doi: https://doi.org/10.18359/rmed.3088 [ Links ]
23. Hancke D, Navone G, Suarez O. 2011. Endoparasite community of Rattus norvegicus captured in a shantytown of Buenos Aires City, Argentina. Helminthologia 48: 167-173. doi: 10.2478/ s1168701100253 [ Links ]
24. Jarbas B, Urbiratan P, Sadi C. 2002. Manual de control de roedores. Brazilia: Fundação Nacional de Saúde. Ministério da Saúde. 66 p. [ Links ]
25. Kataranovski D, Kataranovski M, Savæ IR, Soldatoviæ B, Matiae R. 1994. Morphometric and biochemical parameters as the age indicators in the Norway rat (Rattus norvegicus Berk, 1769).Acta Vet 44: 371-378. doi:10.1051/parasite/2011182189 [ Links ]
26. Klein SL. 2004. Hormonal and immunological mechanisms mediating sex differences in parasite infection. Parasite Immunol 26: 247-264. doi: 10.1111/j.01419838.2004.00710.x [ Links ]
27. Lebbad M, Mattsson JG, Christensson B, Ljungström B, Backhans A, Andersson JO, Svärd SG. 2010. From mouse to moose: multilocus genotyping of Giardia isolates from various animal species. Vet Parasitol 168: 231-239. doi: 10.1016/j.vetpar.2009.11.003 [ Links ]
28. Lecaros CA, Falcón PN, Elías PR. 2010. Accidentes ocupacionales y zoonosis en profesionales que laboran en zoológicos y zoocriaderos de Lima, Perú. Salud Tecnol Vet 2: 27-42. [ Links ]
29. Luján HD. 2006. Giardia y giardiasis. Medicina 66: 70-74. [ Links ]
30. Marino MR, Brown TJ. 1992. Giardia intestinalis in North Island possums, house mice and ship rats. New Zeal Vet J 40: 24-27. doi: 10.1080/00480169.1992.35693 [ Links ]
31. Matsubayashi M, Takami K, Kimata I, Nakanishi T, Tani H, Sasai K, Baba E. 2005. Survey of Cryptosporidium spp and Giardia spp infections in various animals at a zoo in Japan. J Zoo Wildlife Med 36: 331-335. doi: 10.1638/04032.1 [ Links ]
32. McMillian M, Dunn JR, Keen JE, Brady KL, Jones TF. 2007. Risk behaviors for disease transmission among petting zoo attendees. J Am Vet Med Assoc 23: 1036-1038. doi: 10.2460/javma.231.7.1036 [ Links ]
33. Mills J, Childs J, Ksiazek T, Peters CJ, Velleca WM. 1998. Métodos para trampeo y muestreo de pequeños mamíferos para estudio virológico. Organización Panamericana de la Salud, Washington, USA. 64 p. [Internet]. Disponible en: http://www1.paho.org/Spanish/HCP/HCT/hct98_104.htm [ Links ]
34. Mir AQ, Dua K, Singla LD, Sharma S, Singh MP. 2016. Prevalence of parasitic infection in captive wild animals in Bir Moti Bagh mini zoo (Deer Park), Patiala, Punjab. Vet World 9: 540-543. doi: 10.14202/vetworld.2016.540543 [ Links ]
35. Molina N, Basualdo J, Minvielle M. 2008. Genotipo zoonótico de Giardia lamblia en Atalaya, provincia de Buenos Aires. Argentina. En: III Congreso Latinoamericano de Zoonosis. Buenos Aires, Argentina. [ Links ]
36. Neghme A, Silva R. 1971. Ecology of parasitism in man. Bol Ofic Sanit Panam 70: 313-329. [ Links ]
37. Paramasvaran S, Sani RA, Hassan L, Hanjeet K, Krishnasamy M, John J, Santhana R. 2009. Endoparasite fauna of rodents caught in five wet markets in Kuala Lumpur and its potential zoonotic implications. Trop Biomed 26: 67-72. [ Links ]
38. Panayotova-Pencheva MS. 2013. Parasites in captive animals: a review of studies in some european zoos. Der Zoologische Garten 82: 60-71. doi: 10.1016/j.zoolgart.2013.04.005 [ Links ]
39. Perec-Matysiak A, BuñkowskaGawlik K, Zaleœny G, Hildebrand J 2015. Small rodents as reservoirs of Cryptosporidium spp and Giardia spp in south western Poland. Ann Agr Env Med doi: 10.5604/12321966.1141359
40. Poulin R, Morand S. 2004. Parasite biodiversity. Washington DC, USA: Smithsonian Institution Scholarly Press. 216 p. [ Links ]
41. Restrepo I, Mazo L, Salazar M, Montoya M, Botero J. 2013. Evaluación de tres técnicas coproparasi-toscópicas para el diagnóstico de geohelmintos intestinales. Iatreia 26(1): 15-24. [ Links ]
42. Rodríguez NF, Tejedor-Junco MT, Hernández-Trujillo Y, González M, Gutiérrez C. 2010. The role of wild rodents in the transmission of Trypanosoma evansi infection in an endemic area of the Canary Islands (Spain). Vet Parasitol 174: 323-327. doi: 10.1016/j.vetpar.2010.09.001 [ Links ]
43. Sprong H, Caccio SM, Van der Giessen JW. 2012. Identification of zoonotic genotypes of Giardia duodenalis. Plos Neglect Trop D 3: e558. doi: 10.1371/journal.pntd.0000558 [ Links ]
44. Stancheva M. 2013. Parasites in captive animals: a review of studies in some European zoos. Zool Gart 82: 60-71. doi: 10.1016/j.zoolgart.2013.04.005 [ Links ]
45. Thompson RC, Monis PT. 2004. Variation in Giardia: implications for taxonomy and epidemiology. Ad Parasit 58: 69-137. doi: 10.1016/S0065308X(04)58008 [ Links ]
46. Traweger D, Travnitzky R, Moser C, Walzer C, Bernatzky G. 2006. Habitat preferences and distribution of the brown rat (Rattus norvegicus Berk.) in the city of Salzburg (Austria): implications for an urban rat management. J Pest Sci 79: 113125. doi:10.1007/s103400060123z [ Links ]
47. Varela NO, Rojas Z. 2013. Estudio retrospectivo de la presencia de Giardia spp en animales de la colección del Zoológico Matecaña de Pereira, Colombia. En: XII Conferencia Interna en Medicina y Aprovechamiento de Fauna Silvestre, Exótica y No Convencional. Colombia. [ Links ]
48. Wesse SJ, McCarthy L, Mossop M, Martin H, Lefebvre S. 2007. Observation of practices at petting zoos and the potential impact on zoonotic disease transmission. Clin Infect Dis 45: 10-15. doi: 10.1086/518572 [ Links ]
49. Wielinga CM, Thompson RC. 2007. Comparative evaluation of Giardia duodenalis sequence data. Parasitology 134: 1795-1821. doi: 10.1017/S0031182007003071 [ Links ]
50. Zhao Z, Wang R, Zhao W, Qi M, Zhao J, Zhang L, Li J, Liu A. 2015. Genotyping and subtyping of Giardia and Cryptosporidium isolates from commensal rodents in China. Parasitology 142: 800-806. doi: 10.1017/S0031182014001929 [ Links ]
Recibido: 29 de noviembre de 2018
Aceptado para publicación: 26 de junio de 2019