Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.30 no.3 Lima jul./set 2019
http://dx.doi.org/10.15381/rivep.v30i3.15207
ARTÍCULOS PRIMARIOS
Eficacia de florfenicol para el tratamiento de infecciones por Pasteurela multocida y Mannheimia haemolitica en alpacas (Vicugna pacos)
Efficacy of florfenicol for the treatment of infections by Pasteurella multocida and Mannheimia haemolitica in alpacas (Vicugna pacos)
Marcos Ferrante1,2, Sheila R. Wosiacki1
1 Departamento de Medicina Veterinária, Universidade Estadual de Maringá–UEM, Umuarama, Brasil
2 E-mail: marcosferrante@gmail.com
RESUMEN
El objetivo del trabajo fue evaluar el efecto del tratamiento con florfenicol en dosis de 20 mg/kg por vía i.m. en el tratamiento de infecciones causadas por Pasteurela multocida y Mannheimia haemolitica en alpacas. Se determinó la tasa de eficacia según la concentración inhibitoria mínima (CIM) de la bacteria infectante. Para esto, fue realizada una simulación de Monte Carlo de los parámetros farmacocinéticos para 10 000 eventos y el análisis farmacocinético/farmacodinámico (PK/PD). Las tasas de eficacia estimadas para P. multocida fueron del 99, 20 y 1% según las CIM de las cepas 0.5, 1 y 2, respectivamente, mientras que las tasas de eficacia estimadas para M. haemolitica fueron de 100, 95 y 3% según las CIM de las cepas 0.5, 1 y 2, respectivamente. La probabilidad de obtener la cura bacteriológica después del tratamiento disminuyó de manera altamente significativa para infecciones causadas por bacterias con CIM superiores a 0.5 µg/ml para P. multocida (p<0.01) y 1 µg/ml para M. haemolitica (p<0.01). Los resultados evidencian la necesidad de incorporar en el protocolo terapéutico el aislamiento bacteriológico, la determinación de la CIM y la optimización de la dosis terapéutica según la susceptibilidad de las cepas de P. multocida y M. haemolitica a fin de evitar fallas terapéuticas y, consecuentemente, potenciar el desarrollo de resistencia bacteriana.
Palabras clave: integración farmacocinética/farmacodinámica; Lama glama; camélidos sudamericanos.
ABSTRACT
The aim of the study was to evaluate the effect of florfenicol treatment at a dose of 20 mg/kg via i.m. in the treatment of infections caused by Pasteurela multocida and Mannheimia haemolitica in alpacas. The efficacy rate was determined according to the minimum inhibitory concentration (MIC) of the infecting bacterium. For this, a Monte Carlo simulation of pharmacokinetic parameters for 10 000 events and pharmacokinetic/ pharmacodynamic analysis (PK/PD) was performed. The estimated efficacy rates for P. multocida were 99, 20 and 1% and according to the MICs of strains 0.5, 1 and 2, respectively, while the estimated efficacy rates for M. haemolitica were 100, 95 and 3% and according to the CIM of strains 0.5, 1 and 2, respectively. The probability of obtaining the bacteriological cure after treatment decreased in a highly significant way for infections caused by bacteria with MICs higher than 0.5 µg/ml for P. multocida (p<0.01) and 1 µg/ml for M. haemolitica (p<0.01). The results showed the need to incorporate bacteriological isolation, the determination of the MIC and the optimization of the therapeutic dose according to the susceptibility of P. multocida and M. haemolitica strains in the therapeutic protocol to avoid therapeutic failures and consequently promote the development of bacterial resistance.
Key words: pharmacokinetic/pharmacodynamic modelling; Lama glama; South American camelids
INTRODUCCIÓN
La población de alpacas en Perú es de 3 685 500 según el último censo nacional agropecuario de Perú realizado en 2012, superando en 50.2% la población registrada en el censo agropecuario de 1994 (CENAGRO, 2012). Las alpacas se encuentran mayormente en posesión de pequeños productores y campesinos. Estos animales proveen principalmente carne y fibra y, además, son considerados parte fundamental de la identidad cul tural de sus puebl os (Qui spe et al., 2009; Ledesma et al., 2017). Según el informe de la OIE sobre enfermedades de los camélidos, las infecciones respiratorias producidas principalmente por Pasteurella spp han sido clasificadas dentro del grupo III, por ser consideradas como enfermedades leves (OIE, 2008).
Según estudios realizados por FassiFehri (1987), P. multocida es la bacteria oportunista más frecuentemente asociada en las enfermedades respiratorias en las especies de la familia Camelidae. Por otro lado, estudios más recientes reportan altos niveles de seroconversión en camélidos sudamericanos (CSA) para P. multocida y M. haemolitica en seis provincias de Argentina, lo cual indica que estas bacterias podrían estar causando infecciones subclínicas en estas especies (Diaz, 2017; Ledesma et al., 2017). Así mismo, en Perú han sido reportados casos de muertes de alpacas por neumonía aguda, habiéndose confirmado la presencia de los virus Parainfluenza 3 (PI3), respiratorio sincitial bovino (RSB) y adenovirus bovino tipo 3 (BAdV-3) en coexistencia con las bacterias P. multocida y M. haemolytica (Rosadio, 2011; Guzmán et al., 2013). Posteriormente, Rímac et al. (2017) revelaron la detección de P. multocida tipo A, LPS genotipo L6 y tox A+ y tbp A+ en alpacas jóvenes muertas con neumonía en Perú.
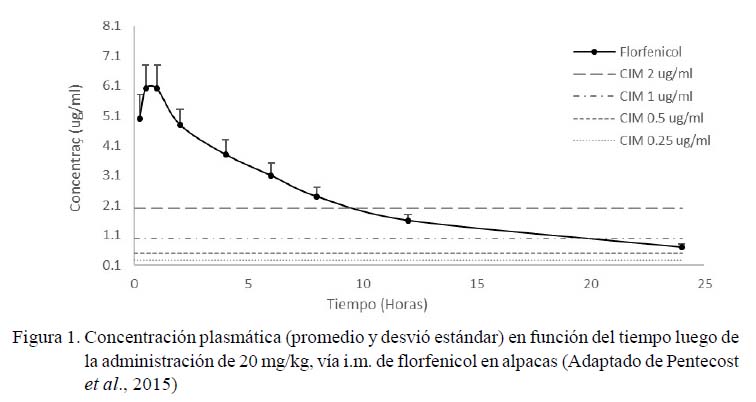
Florfenicol, antimicrobiano sintético de amplio espectro desarrollado especialmente para uso veterinario, es una de las principales alternativas terapéuticas de las infecciones bacterianas respiratorias en bovinos y suinos (Sidhu et al., 2014; Dorey et al., 2017). Se deriva del tianfenicol, que contiene un átomo de flúor en el carbono tres en lugar del grupo hidroxilo (Dorey et al., 2017). Pentecost et al. (2015) determinaron la farmacocinética del florfenicol en alpacas administrando 20 mg/kg; sin embargo, no utilizaron parámetros farmacocinéticos para evaluar la eficacia de esta dosis en el tratamiento de las infecciones causadas por P. multocida y M. haemolitica.
Los modelos farmacocinéticos/farmacodinámicos (PK/PD) son ampliamente utilizados como indicadores de eficacia de los tratamientos antibióticos en humanos y animales (EMA, 2016, Abdelraouf, et al., 2017). La utilización de estos modelos junto con el método de simulación de Monte Carlo fue descrita por Dudley et al. (2000) y Trang et al. (2017). Actualmente, esta es la principal metodología empleada para la evaluación y optimización de dosis terapéuticas de los antibióticos (Rey et al., 2014; EMA, 2016; Toutain et al., 2016, 2017; Wei et al., 2017).
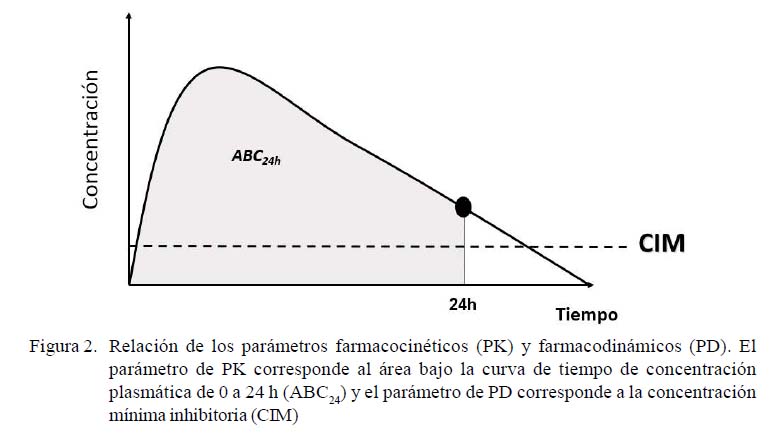
Se ha demostrado que el índice PK/PD adecuado para florfenicol es el área bajo la curva de concentración plasmática hasta 24 horas después de la administración sobre la concentración inhibitoria mínima de la bacteria infectante (ABC /CIM) (Ahmad et al., 2016). Los valores de ABC24 son obtenidos a partir de la realización de estudios de farmacocinética in vivo donde se administra la dosis de interés y se determina la curva de disposición plasmática a través del tiempo. Por otro lado, los valores de CIM son obtenidos mediante estudios in vitro realizados con la bacteria de interés frente a diferentes concentraciones del fármaco en estudio. El índice ABC24/CIM permite determinar si una dosis administrada resultara en un efecto bacteriostático, bactericida o de erradicación bacteriológica, considerando esta última cuando la reducción en el número de bacterias es mayor de 4 log (Dorey et al., 2017). De esta forma, los modelos PK/PD permiten identificar fallas en las dosis terapéuticas que incrementan el riesgo de selección de cepas resistentes.
El objetivo del presente trabajo fue evaluar el efecto del tratamiento con florfenicol en dosis de 20 mg/kg por vía intramuscular en el tratamiento de infecciones causadas por P. multocida y M. haemolitica en alpacas utilizando el modelo PK/PD.
MATERIALES Y MÉTODOS
El estudio fue realizado en el Laboratorio de Microbiología del Departamento de Medicina Veterinaria de la Universidade Estadual de Maringa, Umuarama, Brasil. Se evaluó la efi cacia del tratamiento con florfenicol en dosis de 20 mg/kg por vía intramuscular en el tratamiento de infecciones bacterianas causadas por P. multocida y M. haemolitica. Se realizó una simulación de Monte Carlo de los parámetros PK de 10 000 eventos y luego se realizó el modelado PK/PD para determinar las tasas de eficacia en la metodología descrita por Dudley et al. (2000) y Trang et al. (2017).
Los parámetros farmacocinéticos utilizados fueron obtenidos del estudio realizado por Pentecost et al. (2015). El índice ABC de la concentración plasmática fue de 37.8 ± 6.8 µg/ml (Figura 1). El parámetro de eficacia utilizado fue el índice ABC24/CIM (Ahmad et al., 2016: Toutain et al., 2007) (Figura 2). El efecto antibacteriano de florfenicol fue determinado en tres niveles de inhibición del crecimiento: acción bacteriostática (sin cambio desde el recuento de inóculo inicial), acción bactericida (reducción de 3 log10 en el recuento) y erradicación (reducción de 4 log10 en el recuento). Los índices ABC24/CIM para el efecto bacteriostático fueron de 10 y 14; para efecto bactericida fueron de 24 y 43 y para erradicación fueron de 36 y 63, según la bacteria sea P. multocida o M. haemolitica, respectivamente; valores que corresponden a los límites superiores de 95% de confianza para los límites establecidos por Sidhu et al. (2014).
Los cálculos fueron realizados para cepas con CIM en el intervalo de 0.125 µg/ml hasta 8 µg/ml (Sidhu et al., 2014). El análisis de los datos y la simulación de Monte Carlo se realizó en el programa Excel (Oda, 2011; Sharma et al., 2016) y en el programa BioEstat 5.0. Para la comparación de las tasas de eficacia se utilizó la prueba de Chicuadrado con una significancia de (p<0.05).
RESULTADOS
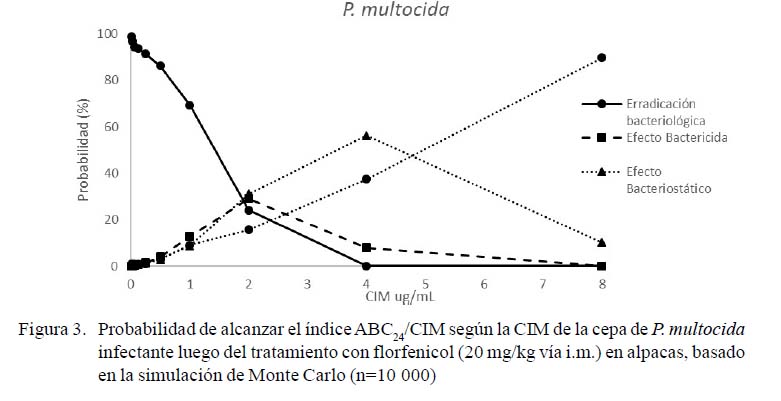
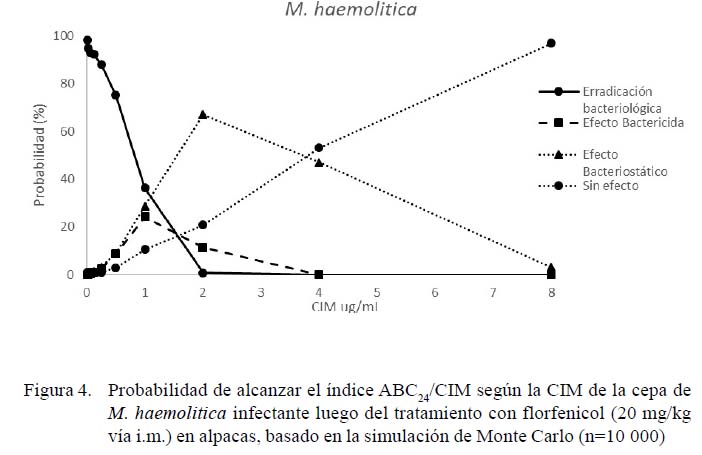
Se observaron cambios en las tasas de eficacia relacionadas con los cambios en la CIM (Figura 3). Las tasas de eficacia estimadas para P. multocida fueron de 99, 20 y 1%, según las CIM de las cepas 0.5, 1 y 2, respectivamente Así mismo, las tasas de eficacia estimadas para M. haemolitica fueron de 100, 95 y 3%, según las CIM de las cepas 0.5, 1 y 2, respectivamente. La probabilidad de obtener la cura bacteriológica después del tratamiento disminuyó de manera altamente significativa para infecciones causadas por bacterias con CIM superiores a 0.5 µg/ml para P. multocida (p<0.01) y 1 µg/ml para M. haemolitica (p<0.01).
DISCUSIÓN
El florfenicol es uno de los principales antibióticos utilizados en la terapéutica de las infecciones bacterianas respiratorias en la clínica de animales mayores, actúa uniéndose al ribosoma 50S, con lo cual inhibe la síntesis proteica bacteriana (Dudley et al., 2000; Pentecost et al., 2015). Sin embargo, no existen estudios de PK/PD que evalúen su eficacia en la antibioticoterapia de alpacas. El presente estudio permitió estimar la eficacia del tratamiento con 20 mg/kg de florfenicol vía i.m., según la susceptibilidad de la bacteria causante de la infección considerando los valores de CIM. El éxito terapéutico de la antibioticoterapia depende principalmente de la relación entre la concentración del fármaco en el sitio de infección con la concentración inhibitoria mínima de la bacteria causante de la infección (Toutain et al., 2002; Ahmad et al., 2016). Por lo tanto, la falla terapéutica podría ser de origen PK, PD o por una combinación de ambos. Las fallas terapéuticas de origen PK se presentan cuando el fármaco no alcanza la concentración necesaria en el sitio de acción y las de origen PD cuando la bacteria resiste las concentraciones terapéuticas originales (Torneke y Torrendo, 2015; Hu y Cheng, 2016; Toutain et al., 2016).
En la elección de las dosis terapéuticas debe considerarse la CIM de los microorganismos causantes de la infección para el fármaco seleccionado (Boothe y Boothe, 2015). En este sentido, los análisis de eficacia según la CIM establecen la información complementaria para el uso racional de antibióticos (Rey et al., 2014; Wei et al., 2017). El presente estudio permitió determinar las bajas tasas de erradicación bacteriológica de esta dosis para el tratamiento de las infecciones causadas por P. multocida y M. haemolitica con CIM superiores a 0.25 y 0.125 µg/ml, respectivamente (Figuras 3 y 4). Por lo tanto, se requieren estudios de ajustes a dosis terapéuticas que permitan obtener tasas de erradicación bacteriológicas adecuadas.
Una alternativa para aumentar la probabilidad de alcanzar el índice ABC /CIM correspondiente al efecto de erradicación bacteriológica es el aumento de la dosis (Toutain et al., 2016). Holmes et al. (2012) evaluaron la administración de dosis de 40 mg/kg, vía subcutánea, a intervalos de 48 h en alpacas adultas, encontrando que el antimicrobiano provocó un efecto supresor de la médula ósea, de allí que las dosis terapéuticas de florfenicol deberán ser menores.
Los resultados del presente estudio demuestran la eficacia de flofenicol para el tratamiento de estas bacterias en alpacas adultas, ya que el análisis fue basado en estudio de farmacocinética de esta categoría. Estudios realizados por Rímac et al. (2017), determinaron la participación de P. multocida en infecciones que provocaron la muerte de alpacas jóvenes; sin embargo, considerando las diferencias fisiológicas que podrían determinar perfiles farmacocinéticos diferentes entre las categorías de alpacas jóvenes y adultas, tal como sucede con la administración de danofloxacina en bovinos (Mzyk et al., 2017), los resultados del presente estudio podrían no ser reproducibles en alpacas jóvenes. Por lo tanto, son necesarios estudios adicionales que determinen el perfil farmacocinético de florfenicol en alpacas jóvenes para poder determinar la eficacia de su uso en esa categoría animal.
CONCLUSIONES
-
El modelo PK/PD permitió estimar el efecto subterapéutico de florfenicol en dosis de 20 mg/kg vía intramuscular en alpacas, demostrando la necesidad de optimización de las dosis terapéuticas.
-
Se demuestra que pequeños incrementos en la CIM determinan grandes cambios en las tasas de eficacia. Esto evidencia la necesidad de incorporar en el protocolo terapéutico el aislamiento bacteriológico, la determinación de la CIM y optimización de dosis terapéutica según la susceptibilidad bacteriana a fin de evitar fallas terapéuticas y, consecuentemente, potenciar el desarrollo de resistencia bacteriana.
LITERATURA CITADA
1. Abdelraouf K, Linder KE, Nailor MD, Nicolau DP. 2017. Predicting and preventing antimicrobial resistance utilizing pharmacodynamics: part I Gram-negative bacteria. Expert Opin Drug Met 12: 267-280. doi: 10.1080/17425255.2017.1329417 [ Links ]
2. Ahmad I, Huang L, Hao H, Sanders P, Yuan Z. 2016. Application of PK/PD modelling in veterinary field: dose optimization and drug resistance prediction. Biomed Res Int 2016: 5465678. doi: 10.1155/2016/546567 [ Links ]
3. Boothe DM , Boothe HW. 2015. Antimicrobial considerations in the perioperative patient. Vet Clin N Am-Small 45: 585-608. do i: 10.1016/j.cvsm.2015.01.006 [ Links ]
4. CENAGRO. IV. 2012. Censo Nacional Agropecuario. Ministerio de Agricultura de Perú.[Internet]. Disponible en: http://siea.minagri.gob.pe/siea/?q=iv-censo-nacional-agropecuario-2012/ivcenagro-2012 [ Links ]
5. Díaz AM, Ledesma MM, Calcagno ML, Leoni J, Manghi MA, Canellada AM, et al. 2017. Serological survey of antibodies to Mannheimia haemolytica and Pasteurella multocida in camelids from Argentina . Ann Infect Dis Epidemiol 2: 1-6. [ Links ]
6. Dudley MN, Ambrose PG. 2000. Pharmacodynamics in the study of drug resistance and establishing in vitro susceptibility breakpoints: ready for prime time. Curr Opin Microbiol 3: 515-521. doi: 10.1016/S1369-5274(00)00132-6 [ Links ]
7. Dorey L, Pelligand L, Cheng Z, Lees P. 2017. Pharmacokinetic/pharmacodynamic integration and modelling of florfenicol for the pig pneumonia pathogens Actinobacillus pleuropneumoniae and Pasteurella multocida. Plos One 12: e0177568. doi: 10.1371/journal.pone.0177568 [ Links ]
8. European Medicine Agency. 2016. Guideline on the use of pharmacokinetics and pharma codynamics in the development of antimicrobial medicinal products. Available in: https://www.ema.europa.eu/documents/scientificguideline/draft-guideline-use-pharmacokinetics-pharmacodynamicsdevelopment-antibacterial-medicinal-products_en.pdf [ Links ]
9 . Fassi-Fehri MM. 1987. Les maladies des camelides. Rev Sci Tech OIE 6: 355 373. [ Links ]
10. Guzmán K, Rosadio R, Maturrano L, Manchego A. 2013. Asociación de agentes virales y bacterianos en cuadros de neumonías agudas en alpacas tuis. Rev Inv Vet Perú 24: 524-536. doi: 10.15381/rivep.v24i4.2741 [ Links ]
11. Holmes K, Bedenice D, Papich MG. 2012. Florfenicol pharmacokinetics in healthy adult alpacas after subcutaneous and intramuscular injection. J Vet Pharmacol Ther 35: 382-388. doi: 10.1111/j.1365-2885.2011.01323 [ Links ]
12. Hu Yuanan, Cheng Hefa. 2016. Health risk from veterinary antimicrobial use in China’s food animal production and its reduction. Environ Pollut 219: 993-97. doi: 1016/j.envpol.2016.04.099.
13. Ledesma MM, Díaz AM, Barberis C, Vay C, Manghi MA, Leoni J, Castro MS, et al. 2017. Identification of Lama glama as reservoirs for Acinetobacter lwofûi. Front Microbiol 8: 278. doi: 10.3389/fmicb.2017.00278 [ Links ]
14. Mzyk DA, Baynes RE, Messenger KM, Martinez M, Smith GW. 2017. Pharmacokinetics and distribution in interstitial and pulmonary epitheliallining fluid of danofloxacin in ruminant and preruminant calves. J Vet Pharmacol Ther 40: 179-191. doi: 10.1111/jvp.12346 [ Links ]
15. Oda K. 2011. Development of software for antimicrobial PK/PD simulation incorporating Montecarlo simulation based on Microsoft® Office Excel. Jap J Pharma Health Care Sci 37: 335-344. doi: 10.5649/jjphcs.37.335 [ Links ]
16. [OIE] World Organisation for Animal Health. 2008. OIE Ad Hoc Group on Camelidae Diseases. Paris. [Internet]. Available in: https://www.icinfo.org/content/oie-ad-hoc-group-camelidae-diseases. [ Links ]
17. Pentecost RL, Niehaus AJ, Werle N, Lakritz J. 2015. Absorption and disposition of florfenicol after intravenous, intramuscular and subcutaneous dosing in alpacas. Rev Vet Sci 99:199-203. doi: 10.1016/j.rvsc.2015.02.006 [ Links ]
18. Quispe EC, Rodríguez TC, Iñiguez LR, Mueller JP. 2009. Producción de fibra de alpaca, llama, vicuña y guanaco en Sudamérica. Anim Genet 45: 1-14. doi: 10.1017/S1014233909990277. [ Links ]
19. Rey JF, Laffont CM, Croubel s S, Backer P, Zemirline C, Bousquet E, Guyonnet J, et al. 2014. Use of Monte Carlo simulation to determine pharmacodynamic cut offs of amoxicillin to establish a breakpoint for antimicrobial susceptibility testing in pigs. Am J Vet Res 75: 124-131. doi: 10.2460/ajvr.75.2.124. [ Links ]
20. Rimac R, Luna L, Hurtado R, Rosadio R, Maturrano L. 2017. Detection and genetic characterization of Pasteurella multocida from alpaca (Vicugna pacos) pneumonia cases. Trop Anim Health Pro 49:1325-1328. doi: 10.1007/s11250-017-1309-5 [ Links ]
21. Rosadio R, Cirilo E, Manchego A, Rivera H. 2011. Respiratory syncytial and parainfluenza type 3 viruses coexisting with Pasteurella multocida and Mannheimia hemolytica in acute pneumonias of neonatal alpacas. Small Ruminant Res 97: 110-116. doi: 10.1016/ j.smallrumres.2011.02.001 [ Links ]
22. Sharma VD, Singla A, Chaudhary M, Kumar M, Bhatnagar A, Kumar S, et al. 2016. Dose optimization of ceftriaxone-vancomycin combination using fractional inhibitory concentration kinetics in resistant bacteria. ADMET & DMPK 4: 241-260. doi : 10.5599/admet.4.3.286 [ Links ]
23. Sidhu P, Rassouli A, Illambas J, Potter T, Pelligand L, Rycroft A, Lees P. 2014. Pharmacokinetic-pharmacodynamic integration and modelling of florfenicol in calves. J Vet Pharmacol Ther 37: 231-242. doi: 10.1111/jvp.12093 [ Links ]
24. Törneke K, Torren-Edo J, Grave K, Mackay DK. 2015. The management of risk arising from the use of antimicrobial agents in veterinary medicine in EU/EEA countries–a review. J Vet Pharmacol Ther 38: 519-528. doi: 10.1111/jvp.1222 [ Links ]
25. Toutain PL. 2002. Pharmacokinetic/pharmacodynamic integration in drug development and dosage-regimen optimization for veterinary medicine. AAPS PharmSci 4(4): e38. doi: 10.1208/ps040438. [ Links ]
26. Tou ta in PL, Bousquet-Mélou A, Martinez M. 2007. AUC/MIC: a PK/PD index for antibiotics with a time dimension or simply a dimensionless scoring factor? J Antimicrob Chemoth 60: 1185-1188. doi: 10.1093/jac/dkm360 [ Links ]
27. Toutain PL, Ferran AA, BousquetMelou A, Pelligand L, Lees P. 2016. Veterinary medicine needs new green antimicrobial drugs. Front Microbiol 7: 1196. doi: 10.3389/fmicb.2016.01196. [ Links ]
28. Toutain PL, Potter T, Pelligand L, Lacroix M, Illambas J, Lees P. 2017. Standard PK/PD concepts can be applied to determine a dosage regimen for a macrolide: the case of tulathromycin in the calf. J Vet Pharmacol Ther 40: 16-27. doi: 10.1111/jvp.12333. [ Links ]
29. Trang M, Dudley MN, Bhavnani SM. 2017. Use of Monte Carlo simulation and considerations for PK-PD targets to support antibacterial dose selection. Curr Opin Pharmacol 36: 107-113. doi: 10.1016/j.coph.2017.09.009 [ Links ]
30. Wei Y, Jinru J, Tingting X, Chaoqun Y, Jiaheng F, Ping S, Yonghong X. 2017. Det ermining opt imal dosing re gimen of or al administration of dicloxacillin using Monte Carlo simulation. Drug Des Dev Ther 11: 1951-1956. doi: 10.2147/DDDT.S139632. [ Links ]
Recibido: 23 de septiembre de 2018
Aceptado para publicación: 26 de abril de 2019.