Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Veterinarias del Perú
versão impressa ISSN 1609-9117
Rev. investig. vet. Perú vol.30 no.4 Lima out./dez. 2019
http://dx.doi.org/10.15381/rivep.v30i4.15172
Educación veterinaria
Dos métodos de inclusión de biopsias de neoplasias en resina epóxica para la enseñanza de anatomía patológica veterinaria
Two methods of inclusion of biopsies of neoplasms in epoxy resin for teaching veterinary pathology
Alexander Ortloff Trautmann1,3, Mario Riquelme Gatica1, Gabriel Morán Ruz2
1 Departamento de Ciencias Veterinarias y Salud Pública, Núcleo de Investigación en Producción Alimentaria (NIPA), Facultad de Recursos Naturales, Universidad Católica de Temuco, Chile
2 Instituto de Farmacología, Facultad de Ciencias Veterinarias, Universidad Austral de Chile, Valdivia, Chile
3 E-mail: aortloff@uct.cl
RESUMEN
La tendencia actual en la enseñanza de la patología veterinaria es promover la participación de los estudiantes en su proceso de aprendizaje y un trabajo más autónomo en las actividades de prácticas. La práctica tradicional de análisis de neoplasias implica el análisis macroscópico de biopsias fijadas con formalina y el análisis histopatológico. El objetivo del estudio fue evaluar dos técnicas de inclusión de tejidos con resina epóxica EPO-100, material de bajo costo y de fácil acceso. Se hicieron inclusiones de biopsias obtenidas de tumores de perros y gatos en clínicas veterinarias de Temuco, Chile. Se trabajó con muestras con y sin deshidratación en etanol y acetona antes de la inclusión. Las muestras no deshidratadas conservaron todos los detalles de la muestra original, sin alteración del tamaño, forma o color, siendo más valoradas por los estudiantes en las actividades prácticas que las muestras deshidratadas. Estas últimas se vuelven transparentes y pierden los contrastes entre sus componentes tisulares; sin embargo, tienen la ventaja de mostrar la vascularización de las neoplasias. Ambas técnicas se complementan entre sí y son una contribución a las actividades prácticas desde el punto de vista de la enseñanza y reducen la exposición de los estudiantes a formalina.
Palabras clave: biopsias; neoplasia; resina epóxica; patología; veterinaria
ABSTRACT
The current trend in the teaching of veterinary pathology is to promote the participation of students in their learning process and more autonomous work in practical activities. The traditional practice of neoplasm analysis involves macroscopic analysis of formalin-fixed biopsies and histopathological analysis. The objective of this study was to evaluate two tissue inclusion techniques with EPO-100 epoxy resin, material of low cost and easily accessible. The biopsies were obtained from tumours of dogs and cats in veterinary clinics in Temuco, Chile. Samples were processed with or without dehydration in ethanol and acetone before inclusion. The non-dehydrated samples retained all the details of the original sample, without altering the size, shape or colour, being more valued by students in practical activities than the dehydrated samples. The latter become transparent and lose the contrasts between their tissue components; however, they have the advantage of showing vascularization of the neoplasms. Both techniques complement each other and are a contribution to practical activities from the point of view of teaching and reduce the exposure of students to formalin.
Key words: biopsies; neoplasm; inclusion; epoxy resin; pathology; veterinary
INTRODUCCIÓN
El conocimiento de la anatomía, la fisiología y la patología son esenciales para la formación médica, especialmente en el campo de la cirugía y la interpretación de imágenes (Triepels et al., 2018). Este principio se aplica tanto en la enseñanza de la medicina humana como la medicina veterinaria.
Los procesos de enseñanza-aprendizaje tradicionales de la anatomía veterinaria vienen siendo modificados, con tendencia a una reducción de las horas, requiriendo que los estudiantes utilicen más tiempo para su propio aprendizaje y, por lo tanto, surge la necesidad de elaborar recursos educativos que faciliten el proceso de enseñanza-aprendizaje no presencial, mejorando la participación activa del estudiante, convirtiendo al profesor como un facilitador y un mediador del conocimiento, y no como un simple transmisor de información (López y López, 2004; Vélez y Ruiz, 2017). Esta tendencia a fomentar el autoaprendizaje también conlleva responsabilidades de los educadores para con los estudiantes en cuanto a proveerles el material adecuado para su autoestudio; por ejemplo, que el material anatómico que utilice el estudiante no sea tóxico, de allí la importancia de prescindir del uso de la formalina debido a la evidencia de que esta sustancia es potencialmente carcinogénica (Duhayon et al., 2008).
Uno de los métodos más utilizados en las actividades prácticas clásicas con estudiantes de anatomía patológica es el análisis de piezas quirúrgicas (biopsias) y muestras obtenidas en la necropsia como material de colección fijado en formalina al 10%. Junto con el análisis macroscópico de estas muestras de casos patológicos se analizan las muestras histopatológicas del mismo caso, lo que provee al estudiante una visión más integral del proceso patológico que se está estudiando. Esto último cobra mayor importancia cuando el análisis es de neoplasias, donde es fundamental la descripción e identificación macroscópica de las biopsias (Sledge et al., 2016; Russell et al., 2017).
Debido a los estudios que han dejado en evidencia la toxicidad de la formalina en los estudiantes de medicina (Mohamed y Elsayed, 2017), se ha incentivado la búsqueda e implementación de otras técnicas anatómicas de conservación como la plastinación (Von Hagens et al., 1987) y técnicas de inclusión en resina (Valenzuela et al., 2015). Estas técnicas se vienen utilizando en la enseñanza de la anatomía; sin embargo, para la enseñanza de la anatomía patológica son poco utilizadas, a pesar de que las piezas anatómicas con lesiones de interés son únicas y debiera facilitarse su conservación con fines docentes y de investigación. Tal como lo indican Valenzuela et al (2015), la plastinación de piezas anatómicas es una técnica que logra preparados de muy buena calidad en cuanto a visualización de estructuras, con buena durabilidad y fácil manejo para fines docentes en morfología; sin embargo, su alto costo sigue siendo un factor limitante.
Una técnica para conservar piezas anatómicas a bajo costo es su inclusión en resina poliéster (P-4), la cual fue descrita por Valenzuela et al. (2015). En el mercado también está disponible la resina epóxica EPO100, de bajo costo y fácil acceso. El objetivo de este trabajo fue comparar dos técnicas de inclusión de biopsias de neoplasias con esta resina para fines de docencia en las clases prácticas de neoplasia en Medicina Veterinaria.
MATERIALES Y MÉTODOS
Se utilizaron 15 muestras correspondientes a biopsias quirúrgicas de neoplasias obtenidas por cirujanos veterinarios en clínicas veterinarias de Temuco, Chile. Las biopsias fueron obtenidas en el transcurso de 2017 de casos clínicos de perros con tumores en órganos y sospecha de neoplasias, y que fueran remitidas al Laboratorio de Anatomía Patológica del Departamento de Medicina Veterinaria y Salud Pública de la Universidad Católica de Temuco para su confirmación.
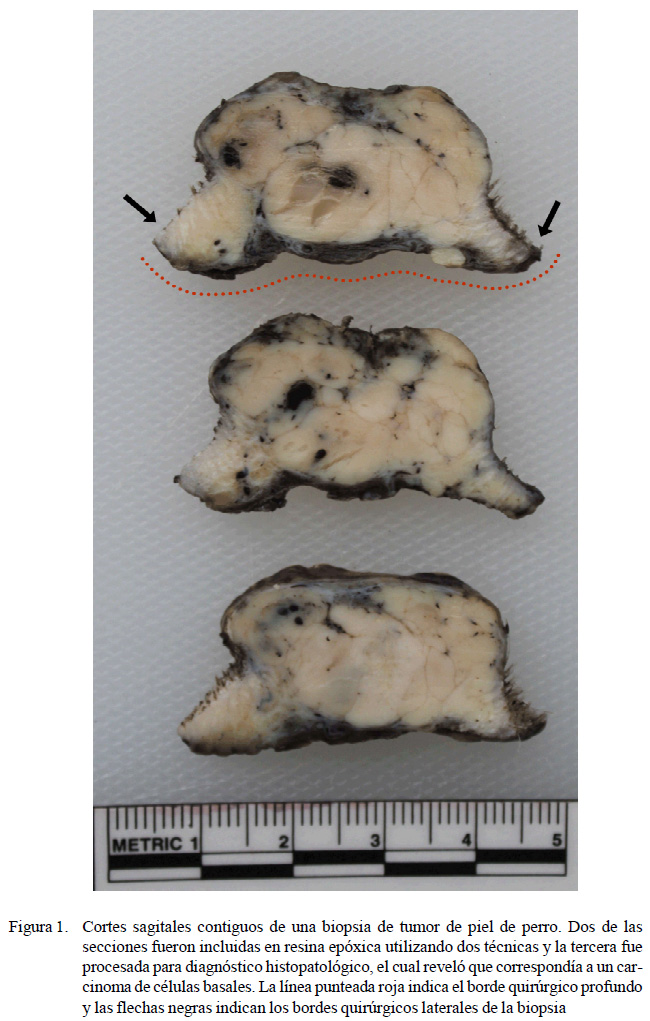
Los tumores incluidos en este estudio medían entre 3 y 10 cm de longitud (Figura 1) y fueron fijados en formalina acuosa tamponada al 10% inmediatamente a su resección para su análisis histopatológico. Todas las muestras correspondían a la totalidad de la masa tumoral, por lo que cada pieza quirúrgica presentaba los planos de corte que los cirujanos realizan para este tipo de patología y que es importante que el patólogo evalúe histopatológicamente (Figura 1), basándose en los criterios descritos por Rusell et al. (2017) y Sledge et al. (2016) para tumores de origen mastocítico y sarcomas de tejidos blandos. Cada pieza quirúrgica se cortó sagitalmente por la mitad con un cuchillo de disección. Una parte fue procesada para histopatología para obtener el diagnóstico y la otra mitad fue utilizada para el ensayo de inclusión en resina epóxica EPO-100 (Plasticenter®, Chile). Es importante destacar que el corte fue realizado de tal manera que ambas mitades sean idénticas en cuanto en los bordes quirúrgicos y la masa tumoral.
De la mitad destinada a inclusión en resina epóxica EPO-100 se obtuvieron dos secciones sagitales de 0.5 cm de grosor (Figura 1), que fueron procesadas siguiendo dos protocolos de inclusión a fin de determinar el método que mejor conserva los detalles de la muestra:
-La primera sección de cada tumor fue retirada de la solución de formalina acuosa al 10%, lavada en agua corriente por 2 h y sometida a un proceso de deshidratación en concentraciones crecientes de etanol (50, 70, 80, 96 y 100%) durante 1 h por cada concentración y posteriormente con una mezcla de 50% etanol y 50% acetona por 1 h a temperatura ambiente y dos pasajes en acetona 100% por 1 h a 4 ºC. Una vez deshidratada la muestra, se dejó durante 4 h en una mezcla 1:1 de acetona con resina epóxica EPO-100 sin endurecedor a temperatura ambiente (20 ºC).
-La segunda sección fue sacada de la solución de formalina 10%, lavada en agua corriente por 2 h y secada con papel absorbente para retirar el agua superficial al momento de ser incluida. Este procedimiento de secado superficial fue realizado en un laboratorio cuya temperatura ambiental no superaba los 15 ºC para evitar el secado excesivo de la muestra.Aestas seccionesno se les realizó ningún otro tratamiento, salvo la inclusión en resina epóxica EPO-100.
La inclusión y molde final fue común a ambos métodos. Para el proceso de inclusión se utilizó como molde una base de lámina de acrílico y cuatro paredes contenedoras de silicona de caucho de 1 cm de altura que formaban un recipiente (Figura 2). Se calentó la resina epóxica EPO-100 en baño María a 40 ºC y se mezcló con el endurecedor END 813 (Plasticenter®, Chile) en una relación 2:1, mezclando suavemente durante 5 min para evitar la formación de burbujas. La mezcla se introdujo en una campanade vacío a -0.08 MPa para reducir el número de burbujas de la mezcla. Posteriormente, se depositó suavemente la mezcla en el molde cubriendo hasta un 75% de su volumen y nuevamente se realizó el vacío a -0.08 MPa para eliminar burbujas (Figura 3a). Luego, se introdujo la muestra de cada protocolo en el molde con resina, se completó con mezcla hasta llenar el molde y se puso un techo de lámina de acrílico, dejando reposar por 48 h a temperatura ambiente (Figura 3b). Una vez lista la pieza, se lijaron y pulieron los bordes para mejorar la estética de la muestra que se utilizará en los pasos prácticos (Figura 3c).
Las muestras incluidas en resina fueron medidas y comparadas con el registro fotográfico de la biopsia original para ver si había cambios, tanto de tamaño como de color hasta los 22 meses de la inclusión. Las muestras fueron utilizadas en los pasos prácticos de neoplasia de segundo año de Medicina Veterinaria, donde el estudiante evaluó simultáneamente la muestra macroscópica real de un caso clínico con la histopatología de este. En el análisis práctico se observó la vascularidad, los límites de la neoplasia y los bordes quirúrgicos.
RESULTADOS Y DISCUSIÓN
La resina con las muestras se polimerizó a partir de las 2 h y en 24 h a temperatura ambiente ya estaban listas para ser desmoldadas. La resina no se adhiere a la silicona de caucho ni a las láminas de acrílico, por lo que el desmoldado es simple. Se obtuvieron preparados sólidos de 8 mm de espesor, resistentes a la tracción y a la manipulación. Se obtuvieron bloques inodoros, transparentes de superficie lisa en los que pueden verse las biopsias sin distorsión. Los preparados se pueden pulir fácilmente y lograr un acabado de colección (Figura 3c). Las muestras no presentaron cambios de color ni forma, permaneciendo intactas, hasta 22 meses después del ensayo.
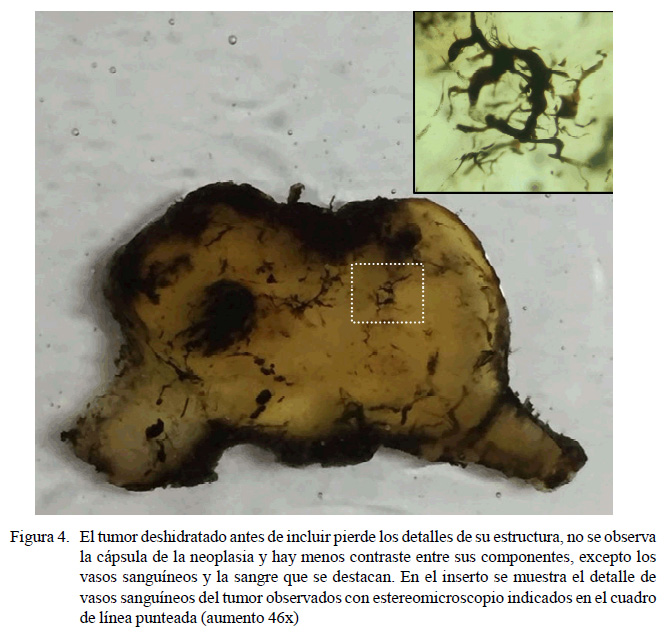
Al comparar las dos técnicas de inclusión se observó que las biopsias de tumores incluidos sin deshidratar mantuvieron sus cualidades originales, lo que muestra que prácticamente esta resina no altera las cualidades de la muestra como color, volumen y tamaño (Figura 3c). Distinto es el caso de las muestras que fueron deshidratadas antes de incluir. En el proceso de deshidratación mediante los pasajes por los solventes etanol, acetona y resina epóxica sin solidificante, la muestra se fue transparentando, especialmente en las zonas con mayor cantidad de tejido adiposo y conectivo que forman parte de la hipodermis y dermis o cápsula en el caso de las biopsias de neoplasias de piel. Este efecto de transparencia redujo el contraste entre los distintos componentes del tumor, por ejemplo, entre el parénquima y la cápsula, siendo prácticamente indistinguibles los límites de la neoplasia. Esta pérdida de información es una seria desventaja de este método; no obstante, esta transparencia muestra en forma muy detallada la vascularidad del tumor, permitiendo describir patrones de irrigación; por ejemplo, al observar las muestras con un estereomicroscopio se pueden visualizar los capilares sanguíneos con mucho contraste (Figura 4).
Desde el punto de vista pedagógico, los estudiantes valoraron varios aspectos de trabajar en prácticos con las biopsias incluidas en resina y no almacenadas en formalina al 10%, ya que no necesitaron usar guantes de látex ni mascarilla, podían manipular las biopsias incluidas mientras trabajaban simultáneamente con el microscopio (Figura 5), y podían tener tres visiones simultáneas de una muestra (biopsia incluida natural, visión de la vascularización y la histopatología).
La resina epóxica EPO-100 utilizada en este trabajo, así como la resina poliéster tipo P-4 usada por Valenzuela et al. (2015) en inclusión de muestras anatómicas son de bajo costo y se consiguen fácilmente en el mercado, debido a que son materiales que se usan comúnmente en procesos industriales y de artesanía. Por otra parte, los dos tipos de resina muestran resultados similares en cuanto a la calidad de la muestra que se logra y su potencial en el uso de actividades de docencia. Con estas técnicas de inclusión, así como con la plastinación de muestras (Bravo, 2006) se logra que el estudiante y el docente no queden expuestos directamente a la formalina en los pasos prácticos y en las actividades de autoestudio.
Desde el punto de vista técnico, para las inclusiones con P-4 se requiere contar con espacios bien ventilados debido a la toxicidad de los reactivos usados y para la polimerización se necesita una fuente de luz ultravioleta. Valenzuela et al (2015) recomiendan, además, que las muestras permanezcan inmóviles en una superficie plana por dos me-Figura 5. Los estudiantes en su trabajo autónomo pueden analizar las muestras de biopsias tumorales de forma segura y simultáneamente usan el microscopio para estudiar la histopatología de la misma muestra ses para su completa polimerización. Este tipo de requerimiento no fue necesario para la inclusión con EPO-100, ya que no se utilizan solventes (excepto acetona en el caso del protocolo de transparentado) y la resina empieza a polimerizar a las dos horas de tomar contacto con el endurecedor y en 24 horas ya estaba lista para ser desmoldada en un laboratorio a temperatura ambiente.
Si bien es ventajoso el rápido polimerizado de EPO-100 porque permite preparar y usar las muestras con prontitud en las actividades docentes, presenta la desventaja que las burbujas que se forman durante el proceso de mezclado de la resina con el endurecedor no alcanzan a llegar a la superficie y quedan atrapadas, alterando de manera irreversible la calidad de la muestra. Por otro lado, la única ventaja de deshidratar las muestras antes de incluir es que el tejido, al quedar transparente, permite visualizar la vascularización de manera clara, pero se pierde el contraste y detalle de los demás componentes de la muestra.
CONCLUSIONES
-
La inclusión con resina epóxica permite obtener preparados de bajo costo, de manera rápida, así como de muy buena calidad en cuanto a transparencia, durabilidad y conservación de los detalles originales.
-
La técnica permite que los tejidos puedan ser deshidratados en forma previa o ser incluidos directamente. Ambas formas se complementan en cuanto a la entrega de información.
-
Reduce los tiempos de exposición a tóxicos como la formalina que estaban sometidos los estudiantes y los docentes cuando usaban muestras fijadas.
LITERATURA CITADA
1. Bravo H. 2006. Plastination, an additional tool to teach anatomy. Int J Morphol 24: 475-480. doi: 10.4067/ S0717-95022006000400029 [ Links ]
2. Duhayon S, Hoet P, Van Maele-Fabry G, Lison D. 2008. Carcinogenic potential of formaldehyde in occupational settings: a critical assessment and possible impact on occupational exposure levels. Int Arch Occup Environ Health 81: 695-710. [ Links ]
3. López-Plana C, López-Béjar M. 2004. Elaboración de material didáctico adaptado al entorno web para la enseñanza y el aprendizaje de la anatomía veterinaria. Barcelona: Univ. Autónoma de Barcelona. [Internet]. Disponible en: https:// www.uab.-cat/iDocument/material-_veterinaria. pdf [ Links ]
4. Mohamed NS, Elsayed MA. 2017. Toxic effects of formalin-treated cadaver on medical students, staff members, and workers in the Alexandria Faculty of Medicine. Alexandria Med J 53: 337-343. doi: 10.1016/j.ajme.2016.11.006 [ Links ]
5. Russell DS, Townsend KL, Gorman E, Bracha S, Curran K, Milovancev M. 2017. Characterizing microscopical invasion patterns in canine mast cell tumours and soft tissue sarcomas. J Comp Pathol 157: 231-240. doi: 10.1016/ j.jcpa.2017.08.002 [ Links ]
6. Sledge DG, Webster J, Kiupel M. 2016. Canine cutaneous mast cell tumors: a combined clinical and pathologic approach to diagnosis, prognosis, and treatment selection. Vet J 215: 43-54. doi: 10.1016/j.tvjl.2016.06.003 [ Links ]
7. Triepels CPR, Koppes DM, Van Kuijk SMJ, Popeijus HE, Lamers WH, Van Gorp T, Futterer JJ, et al. 2018. Medical students’ perspective on training in anatomy. Anat Anzeiger 217: 60-65. doi: 10.1016/j.aanat.2018.01.006
8. Valenzuela OM, Catoia FB, Munjin PA, Valdés GF. 2015. Nuevo método de inclusión en resina poliéster P-4 para cortes anatómicos. Int J Morphol 33: 275-278. [ Links ]
9. Vélez-García JF, Ruiz-Lozano R. 2017. Reflexión sobre los procesos de enseñanza-aprendizaje de la anatomía veterinaria. Int J Morphol 35: 888-892. [ Links ]
10. Von Hagens G, Tiedemann K, Kriz W. 1987. The current potential of plastination. Anat Embryol 175: 411-421. doi: 10.1007/BF00309677 [ Links ]
Recibido: 10 de julio de 2019
Aceptado para publicación: 29 de agosto de 2019