INTRODUCCIÓN
La etapa de posdestete en los lechones es muy estresante, ya que suelen ocurrir trastornos intestinales e inmunológicos con efectos adversos sobre el crecimiento, la salud y la ingesta (Flores et al., 2015). Por otra parte, en esta etapa es común el uso frecuente de antibióticos como promotores de crecimiento, pese a que estos productos pueden presentar un efecto residual en la canal, así como propiciar la resistencia de las bacterias patógenas a dichos antibióticos (Dowarah et al., 2016). Desde hace algunos años, se viene trabajando con alimentos líquidos para mejorar el consumo de alimento en lechones recién destetados. En este sentido, los fermentados líquidos tienen un alto contenido de microorganismos beneficiosos dentro de los que se destacan bacterias ácido-lácticas (BAL) y levaduras que ocasionan un efecto benéfico en el tracto gastrointestinal (TGI) de los cerdos a través de la supresión de microorganismo patógenos (Scholten et al., 2001).
En la provincia de Pastaza de la región amazónica ecuatoriana (RAE) existe un gran potencial de recursos alternativos para elaborar fermentados líquidos, entre los que se pueden citar el banano orito (Musa acuminata AA), tubérculos de taro (Colocasia esculenta [L] Schott), camote (Ipomoea batatas L), plátano (Musa paradisiaca), caña (Saccharum spp), yuca (Manihot esculenta Crantz) y cacao (Theobroma cacao L), entre otros. La zona posee una superficie agrícola de 96 621 ha, de las cuales los cultivares de caña, plátano y banano representa el 5.67%, y la labranza de taro y yuca el 0.61% (GADMP, 2015). Se conoce que el banano orito y el taro poseen un buen tenor de carbohidratos y que tienen bajo contenido de proteína, fibra y grasa (Adejumo et al., 2013; Odenigbo et al., 2013).
Estos alimentos en estado natural poseen un alto contenido de humedad y tienen poca duración una vez que son cosechados, ya que son atacados por microorganismos descomponedores, de allí que se requiere realizar procesamientos de conservación como el ensilaje líquido para aprovechar sus nutrientes. Este proceso biotecnológico constituye un procedimiento sencillo y adecuado para preservar desechos agroindustriales por tiempo prolongado, utilizándose inóculos de bacterias (Lactobacillus plantarum, L. gasseri, L. acidophilus, L. rhamnosus [casei], Streptococus termofilus, L. bulgaricus, Leuconostoc spp, Pediococcus spp entre otras) en su formulación para generar alimentos para cerdos (Caicedo, 2015).
El objetivo de este estudio fue valorar los indicadores fisicoquímicos, biológicos y organolépticos de un ensilaje líquido de banano orito verde con tubérculos de taro y su efecto en la alimentación de cerdos en el posdestete.
MATERIALES Y MÉTODOS
Ubicación
El estudio se realizó en el Laboratorio de Química de la Universidad Estatal Amazónica y en las instalaciones de la Granja Agropecuaria Caicedo ubicadas en el cantón Pastaza, provincia Pastaza, Ecuador. La zona de estudio se encuentra ubicada a 900 msnm, posee un clima semicálido o subtropical húmedo, con precipitaciones anuales entre 4000 y 4500 mm, humedad relativa media de 87% y temperaturas que fluctúan entre 20 y 28 ºC (INAMHI, 2014).
Ensilado Líquido
Para la elaboración del ensilado se siguieron las indicaciones de Caicedo (2015). El ensilado líquido se realizó con fruta de banano orito y con tubérculos de taro de desecho que no cumplían con las características mínimas requeridas para el comercio para el consumo humano. Ambos insumos se obtuvieron en el predio de la Granja Agropecuaria Caicedo. Inmediatamente después de la cosecha se lavaron, escurrieron y molieron en forma fresca con un molino mixto provisto de cuchillas y criba de 1 cm para obtener partículas de tamaño uniforme. Así mismo, se utilizó yogur natural proveniente de la empresa Toni S.A. de la red de distribución Puyo, el cual se transportó en termos de acero inoxidable a 10 ºC. El agua potable provino de la red «Junta Parroquial Tarqui» que se distribuye en el sector. El tiempo de traslado de las materias primas hacia las instalaciones de la Granja Agropecuaria Caicedo fluctuó entre 5 y 15 minutos.
Los ingredientes se pesaron en una balanza digital Camry (100 kg de capacidad) y se depositaron en un tanque plástico con 100 kg de capacidad, a razón de 50 kg de mezcla. Primero se colocó el banano orito picado (30%) con los tubérculos de taro picados (30%). En segunda instancia se añadió el yogur natural que estaba a 8 °C (1%) y luego el agua potable (39%). Las mezclas se homogenizaron manualmente con una paleta de madera durante 15 minutos y a temperatura ambiente (25 ºC). Finalmente, se introdujeron en microsilos de polietileno con capacidad para 1 kg, se cerraron y se almacenaron bajo techo y protegidos de la luz solar (Caicedo, 2013). Todos los microsilos se hicieron en forma simultánea y en una sola oportunidad.
Indicadores Físicos y Microbiológicos
Los indicadores físicos (temperatura y pH) se determinaron en 30 microsilos en los días 1, 4, 8, 15, 30 y 60 del proceso de fermentación, evaluando cinco microsilos por cada medición. La temperatura se comprobó a 20 cm de profundidad, con un termómetro digital Martini 2012 de precisión ± 0.5 ºC (Caicedo, 2013). Para la determinación del pH se utilizó extracto acuoso formado por una fracción de 25 g de ensilado y 250 ml de agua destilada (Cherney y Cherney, 2003).
Para los indicadores microbiológicos se tomaron muestras al azar en tres microsilos de los cinco utilizados para la determinación de los indicadores físicos en cada día de conservación. En total se recolectaron 18 muestras, cada una de 200 g de fermentado, en frascos plásticos trasparentes estériles con capacidad para 250 g. Se realizó el contaje de Escherichia coli, Clostridium spp y Salmonella spp de acuerdo con las indicaciones de la AOAC (2003.01, Ed 20, 2016).
Indicadores Organolépticos y Químicos
Las características organolépticas (olor, color y consistencia) se determinaron a los 4, 8, 15, 30 y 60 d de conservación (Cuadro 1), según Caicedo y Valle (2016). Se tomaron muestras al azar en 3 de los 5 microsilos evaluados en los diferentes tiempos de preservación. En total se colectaron 15 muestras de 500 g cada una de ensilado en tarrinas plásticas de 1 kg de capacidad.
Cuadro 1 Descriptores para la valoración organoléptica de ensilajes de subproductos agrícolas

Fuente: Caicedo y Valle (2016)
Para el análisis químico se recolectaron 2 kg de muestra al azar procedente de los microsilos evaluados al día 8. Se determinó la materia seca (MS), fibra bruta (FB), cenizas (CENZ), proteína bruta (PB), grasa (G) y extractos libres de nitrógeno (ELN), según los procedimientos de AOAC (2005). El cálculo de la materia orgánica (MO) se hizo restando el porcentaje de cenizas de 100. La energía bruta (EB) se determinó con una bomba calorimétrica adiabática Parr 1241. La energía digestible (ED) y la energía metabolizable (EM) para cerdos se estimó según Noblet y Pérez (1993).
Animales e Instalaciones
La investigación se ejecutó según las Directivas para Bienestar Animal de la República de Ecuador (AGROCALIDAD, 2017) y el protocolo experimental de acuerdo con Sakomura y Rostagno (2007). Se emplearon 60 lechones machos castrados, cruce finalizador (Landrace x Duroc x Pietrain), luego del destete (25 días de edad), con un peso medio inicial de 8.53 ± 0.28 kg. Se utilizaron 20 cerdos por tratamiento, y cada cerdo fue considerado como una unidad experimental.
Los animales se alojaron en jaulas individuales de 0.8 x 1.0 m (0.80 m2) durante 28 días. Las jaulas estaban provistas de un comedero tipo tolva y un bebedero tipo chupón, ubicadas en una nave con paredes exteriores de 1.4 m de altura y piso plástico. La temperatura ambiente promedio en la nave fue de 26 °C. Se determinó el consumo de alimento/ día (CAD), el peso inicial (PI) y peso final (PF) la ganancia de peso/día (GPD), la conversión alimentaria (CA), y la incidencia de diarreas (ID) según Flores et al. (2015). El pasaje de los animales se hizo cada siete días, con el empleo de una balanza digital Camry TCS150 con capacidad para 150 kg.
Manejo de la Alimentación
Luego de los estudios de la dinámica de los indicadores físicos, químicos, microbiológicos y organolépticos del ensilaje, el alimento ensilado para los cerdos se preparó cada 8 días en tres tanques plásticos con capacidad para 150 kg cada uno. En cada tanque se dispuso 100 kg de mezcla, según metodología descrita anteriormente.
Se consideró 0, 2 y 4% de inclusión de ensilado en la dieta, estableciendo los tratamientos T0, T2 y T4, respectivamente. Las dietas fueron formuladas siguiendo los procedimientos de la NRC (2012) (Cuadro 2). El alimento se suministró dos veces al día: 08:00 y 15:00 horas, dividido en partes iguales. El agua para bebida se dispuso a voluntad.
Cuadro 2 Composición y aporte de las dietas experimentales (% Base seca)
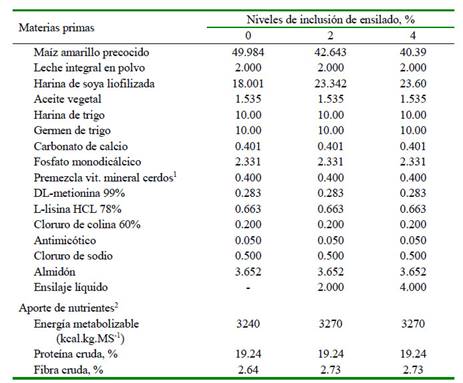
1 Premezcla suministrada (por kg de dieta seca): Vitaminas; A 1500 UI, D3 300 UI, E 37.5 mg, K 2.5 mg, B1 1.5 mg, B2 6.25 mg, B6 3 mg, B12 37.5 g, pantotenato de calcio 25 mg, ácido fólico 0.5 mg, niacina 30 mg, biotina 75 g. Minerales: cobalto 0.5 mg (como heptahidrato de sulfato de cobalto), cobre 25 mg (como sulfato de cobre pentahidratado), 1.25 mg de yodo (como yodo potásico), 150 mg de hierro (como sulfato ferroso), 100 mg de manganeso (como óxido de manganeso), selenio 0.5 mg (como selenito de sodio), zinc 0.25 mg (como óxido de zinc)
2 Calculados según NRC (2012) y/o determinados
Diseño Experimental
Los resultados de los indicadores físicos, microbiológicos, organolépticos y químicos se presentaron como media y desviación estándar. Los datos de los indicadores productivos se contrastaron a través de análisis de varianza y la comparación de medias se hizo con la dócima de Duncan (p<0.05). Todos los análisis fueron realizados con el programa estadístico Infostat (Di Rienzo et al., 2012).
RESULTADOS
No se evidenciaron síntomas de descomposición del material al momento de la apertura de los microsilos. La temperatura más alta del ensilado fue (22.56 ºC) fue en el día 1 (Figura 1), reduciéndose en el día 4, para mantenerse hasta el día 60 de la investigación.
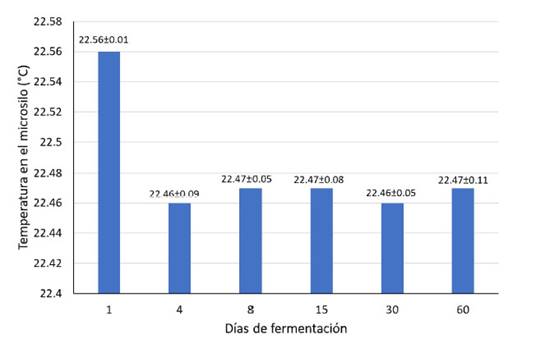
Figura 1 Conducta de la temperatura (ºC) en un ensilado líquido de banano orito con tubérculos de taro durante los primeros 60 días de conservación (media ± desviación estándar)
La dinámica del pH del ensilado líquido de banano orito con tubérculos de taro se muestra en la Figura 2. El valor de pH más alto (4.82) se obtuvo al inicio de la fermentación (día 1), manteniéndose estable entre los días 4 y 60.
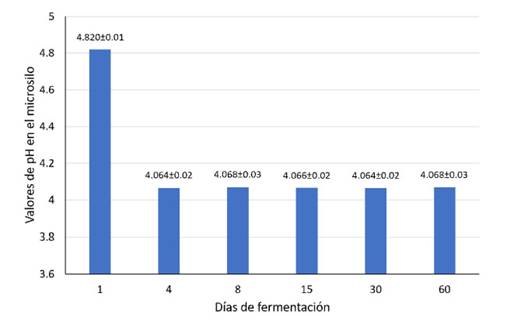
Figura 2 Comportamiento del pH en un ensilado líquido de banano orito con tubérculos de taro durante los primeros 60 días de conservación (media ± desviación estándar)
En el recuento de microorganismos no se encontró Escherichia coli, Clostridium spp ni Salmonella spp. Tampoco se evidenciaron cambios en las características organolépticas del ensilado, siendo aptas (100%) con relación a olor (dulce fermentado), color (verdoso claro) y consistencia (pastosa).
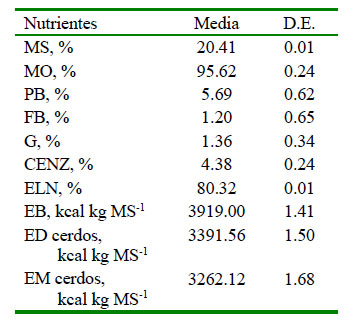
La composición química del ensilado se muestra en el Cuadro 3. El ensilado presentó un contenido aceptable de MS, MO, PB, ELN, EB, ED, EM y bajos niveles de CENZ, G y FB.
Cuadro 3 Composición química de un ensilado líquido de banano orito con tubérculos de taro en base seca
Los animales que consumieron los tratamientos que se incluyeron ensilado líquido al 2 y 4% presentaron el mejor consumo, ganancia de peso, conversión alimentaria, peso final y menor incidencia de diarreas, siendo diferentes de T0 (p<0.05; Cuadro 4).
Cuadro 4 Indicadores productivos de cerdos en fase de posdestete, alimentados con o sin inclusión de ensilaje líquido de banano orito con tubérculos de taro.
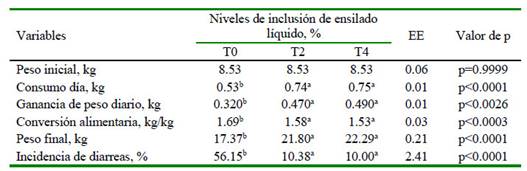
a,b,c Medias con letras distintas en la misma fila son estadísticamente diferentes (p<0.05) T0, T2, T4: 0, 2, y 4% de inclusión de ensilaje en la dieta, respectivamente.
DISCUSIÓN
El ensilaje de banano con tubérculos de taro presentó la mayor temperatura en el día 1 del proceso de fermentación. Diversos estudios indican que en el inicio del proceso de ensilaje existe una fase aeróbica que dura pocas horas, donde el oxígeno atmosférico presente en el material vegetal disminuye rápidamente debido a la respiración del material vegetal y por la presencia de microorganismos aeróbicos y aeróbicos facultativos (hongos, levaduras y enterobacterias), generándose una significante actividad de enzimas vegetales (proteasas, carbohidrasas) (Zahiroddini et al., 2004; Duniere et al., 2015). Al mismo tiempo, durante el proceso respiratorio en los silos se produce calor, agua y dióxido de carbono, causando una elevación de la temperatura (Blanco-Valdés et al., 2016).
La temperatura se mostró estable entre el día 4 y 60 del estudio, posiblemente debido a la inoculación con bacterias ácido lácticas (BAL) del yogur natural. Al respecto, la inoculación con BAL del material a conservar juega un papel clave para el éxito o el fracaso del proceso de ensilaje (Granados-Marín et al., 2014; Espinoza et al., 2017; Borreani et al., 2018). La inoculación con bacterias homolácticas (Pediococcus pentosaceus, Lactobacillus plantarum) promueven una rápida disminución del pH del medio. Lactobacillus buchneri produce ácido acético y mejora la estabilidad aeróbica del ensilaje. Estas bacterias, así como L. buchneri son inoculantes con capacidad de producir enzimas fibrolíticas que mejoran la digestibilidad del alimento ensilado (Cubero et al., 2010; Reich y Kung, 2010; Schmidt y Kung, 2010; Addah et al., 2012).
La escasa variación en la temperatura se atribuye a que no hubo actividad de microorganismos descomponedores (Penicillium, Fusarium, Aspergillus, Mucor, Byssochlamys, Absidia, Arthrinium, Geotrichum, Monascus, Scopulariopsis, Trichoderma, Clostridium) (Jonsson et al., 1990; Nout et al., 1993; Muck, 2010; Lima et al., 2017). Así también, este rango de temperatura permite mantener un equilibrio en el pH con valores cercanos a 4, y producir un ensilaje líquido de óptima calidad nutritiva para los animales (Caicedo, 2013). Por otro lado, cuando hay cambios bruscos en la temperatura de los silos se perturba la acción de las BAL (Song et al., 2014), pudiéndose generar pérdidas importantes de MS por el agotamiento de las fracciones de hidratos de carbono y ácidos orgánicos digestibles del material ensilado (Borreani et al., 2007; Bernardes et al., 2012).
El mayor valor de pH en el ensilado se evidenció en el día 1, dado que la actividad de las BAL es reducida al inicio del proceso fermentativo; así mismo, el cambio de pH depende de la cantidad del inóculo y de carbohidratos solubles que se utilicen en los ensilados para que la población microbiana benéfica se desarrolle rápidamente y se reduzca el pH para aumentar las concentraciones de lactato y acetato en el ensilaje (McEniry et al., 2008; Ogiy et al., 2015; Graf et al., 2016). La estabilización del pH a partir del día 4 se puede atribuir a la acción de las BAL que lograron colonizarse y fermentaron los carbohidratos hidrosolubles del banano y del taro produciendo ácido láctico y en menor cuantía ácido acético. En este sentido, Li y Nishino (2011) señalan que para mejorar la fermentación del ácido láctico y acético en los silos se deben utilizar inóculos de Lactobacillus, Enterococcus y Pediococcus. Al producirse estos ácidos, el pH del material ensilado baja a un nivel que inhibe la presencia de microorganismos que inducen la putrefacción.
Se reporta que la inoculación con L. plantarum a concentraciones de 3.0 x 1012 y 6.0 x 1011 UFC/ml y con Lactobacillus plantarum CCM 4000, L. fermentum LF2 y Enterococcus faecium CCM 4231 en una concentración de 1.0 x 109 UFC/ml a las 12 horas se genera un pH menor a 4.2 (Jalè et al., 2009; Jurado-Gámez et al., 2013). Al respecto, Nkosi y Meeske (2010), Jatkauskas et al. (2018) y Muck et al. (2018) mencionan que la estabilización del pH dentro de las primeras horas de iniciado el proceso de fermentación permite minimizar las concentraciones de ácido butírico, nitrógeno amoniacal y alcohol en los silos. Además, un bajo pH en los silos favorece la hidrolisis de los polisacáridos del material vegetal para las BAL (Li et al., 2016).
En todos los días de estudio hubo ausencia de Escherichia coli, Clostridium spp y Salmonella spp en los silos. Las BAL conservan los alimentos a través de la inhibición de microorganismos patógenos y descomponedores por medio de sus productos de fermentación (ácidos láctico y acético, peróxido de hidrógeno, diacetilo, bacteriocinas y otros productos concebidos por medio de lactoperoxidasa sobre el peróxido de hidrógeno y tiocianato) (Shirai et al., 1996; Zhang et al., 2018).
El ensilado mostró características organolépticas idóneas durante el estudio. En este sentido, la mayoría de las BAL se usan en la industria alimentaria para elaborar productos fermentados y como complementos alimenticios que mejoran la salud del hombre y animales (Ramírez et al., 2011). Así también, existe un deterioro más lento del ensilado luego de su exposición al aire (Rodríguez et al., 2016). Las BAL (Lactococcus, Lactobacillus, Enterococcus, Streptococcus, Leuconostoc y Pediococcus) desempeñan un papel importante en la industria alimentaria por su contribución con el sabor, olor, textura, características sensoriales, propiedades terapéuticas y el valor nutricional de los productos alimentarios. Entre sus metabolitos se incluyen vitaminas, ácidos orgánicos polisacáridos, sustancias persevantes y endulzantes (Parra, 2010).
El ensilado presentó un contenido aceptable de MS, MO, PB, ELN, EB, ED, EM y bajos niveles de CENZ, G y FB. Resultados superiores en cuanto a MS (24.63-33.75%) y PB (9.66-11.15%) fueron reportados por García et al. (2015) en un ensilado líquido (de 8 días de fermentación) compuesto por 60% de tubérculos de camote (Ipomoea batata) picados y, una mezcla de 40% entre crema de Saccharomyces cerevisiae, vinaza concentrada y melaza de caña de azúcar tipo B. El mayor valor de MS y PB registrado por estos autores pudiera deberse a que la melaza de caña de azúcar realizó un aporte significativo de materia seca (FEEDNA, 2019) y la crema de S. cerevisiae contribuyó con el incremento de la PB del ensilado (Morales 2007; Suárez-Machín et al., 2016).
Por otro lado, resultados similares con relación al tenor de MO, CENZ, G, FB, ELN, EB, ED y EM fueron reportados por Caicedo (2015) y Caicedo et al. (2015) en ensilados líquidos de tubérculos de taro tratados con yogur natural, suero de leche y melaza. En este sentido, Lezcano et al. (2015) destacan que los ensilados líquidos de recursos alternativos tienen un buen contenido energético, así como bajos niveles de CENZ, G y FB, lo cual es satisfactorio desde el punto de vista para la alimentación de porcinos en la etapa de posdestete (Bertechini, 2013).
Los animales que se alimentaron con las dietas T2 y T4 presentaron el mejor consumo, ganancia de peso, conversión alimentaria, peso final, y menor incidencia de diarreas en los lechones. En este sentido, se observa la conveniencia de utilizar alimentos líquidos fermentados para minimizar el uso de antibióticos en la producción porcina (PlumedFerrer y Von Wright, 2009). La fermentación líquida por la acción de las BAL y levaduras ha demostrado mejorar la calidad de los piensos y ser beneficioso para la salud de los animales, debido probablemente a la acción del ácido láctico y ácido acético en el estómago de los cerdos, los cuales reducen el pH intestinal y actúan contra las bacterias patógenas del intestino (Van Winsen et al., 2001; Scholten et al., 2002; Plumed-Ferrer et al., 2005).
En otros estudios referentes a ensilados líquidos de yuca (Manihot esculenta) producidos en Cuba y Brasil y suministrados a cerdos de crecimiento se lograron mejoras en el aprovechamiento de nutrientes y de los indicadores del comportamiento productivo de los animales; de hecho, en esta etapa lograron reemplazar completamente al maíz de la dieta (Lezcano et al., 2014; Araújo et al., 2016). Esto se atribuye a que los alimentos fermentados liberan con mayor facilidad sus nutrientes producto de la acción enzimática de los microorganismos beneficiosos que se desarrollan en el medio (levaduras y BAL) (Silva et al., 2008; Silva et al., 2010; Taysayavong, 2018).
En síntesis, existen varios estudios que demuestran que el uso de cepas de BAL en los alimentos mejoran el consumo, eficiencia en la conversión de nutrientes, utilización de nutrientes, microbiota intestinal benéfica, salud intestinal, sistema inmunitario, producción de sustancias antimicrobianas, patrones de resistencia a los antibióticos (Wang et al., 2012; Hou et al., 2015) y, previenen la colonización intestinal de patógenos entéricos (Lee et al., 2012).












 uBio
uBio 

