INTRODUCCIÓN
El empleo de fitoplancton y zooplancton como alimento vivo de larvas y alevinos de peces se ha convertido en una opción alimenticia y económica que asegura la sobrevivencia de los peces en las etapas iniciales de vida. Estos organismos planctónicos contienen proteínas, carbohidratos, ácidos grasos, aceites esenciales y enzimas, como proteinasas, pepsidasas y amilasas entre otras, que aseguran una adecuada nutrición y alimentación para las larvas de peces (Sipaúba-Tavares y Rocha, 2003). La producción de fitoplancton y zooplancton es una actividad rentable y de poca inversión, por lo que muchos centros de producción de semilla de peces vienen incorporando la tecnología de cultivo de estos organismos como una alternativa alimenticia al uso de quistes de Artemia salina, que es un producto importado y costoso (Velu y Munuswany, 2003).
Dentro del grupo de organismos zooplanctónicos, los cladóceros se destacan por su potencialidad nutritiva para larvas de peces que está en función directa con el sustrato donde se desarrollan (Muñoz, 2006); sin embargo, su producción requiere mantener un crecimiento sostenido. Existen varios estudios enfocados a la búsqueda de un alimento que permita el crecimiento sostenido de los cladóceros, entre ellos resalta el uso de microalgas y levaduras (Prieto et al., 2006). Los cladóceros, por ser filtradores no selectivos, se pueden alimentar de ambos tipos de alimentos a la vez (Romero, 2009). La combinación de microalgas + levaduras, así como de varias especies de microalgas han mostrado buenos resultados en el crecimiento de cladóceros (Santos et al., 2006; PrietoyAtencio 2008; Ocampo et al., 2010).
Un estudio de Moina sp alimentado con Ankistrodesmus sp y Ankistrodesmus sp + Saccharomyces cerevisiae encontraron mejor resultado en el crecimiento con la mezcla de dichos alimentos (Prieto et al., 2006). Peña-Aguado et al. (2005) evaluaron el crecimiento de Ceriodaphnia dubia y Moina macrocopa alimentados con Chlorella vulgaris, Scenedesmus acutus y Saccharomyces cerevisiae y obtuvieron los mejores resultados con las combinaciones de las dos microalgas, mientras que Jiménez et al. (2003) en Moina macrocopa, estudiando el efecto de diferentes fuentes de alimento como Scenedesmus abundans y Saccharomyses cerevisiae y alimento artificial Z-plus para protozoos de camarones marinos, encontraron mayor densidad con este último. El cladócero nativo Ceriodaphnia es un género frecuente y común que se encuentra en ecosistemas dulceacuícolas tropicales y subtropicales, y se distribuye ampliamente debido a su tolerancia a variaciones de temperatura (Villalobos y González, 2005).
El objetivo del presente trabajo fue evaluar el efecto de dos microalgas (Scenedesmus y Chlorella) como alimento sobre el desarrollo del cladócero nativo Ceriodaphnia sp de la Amazonia peruana.
MATERIALES Y MÉTODOS
Área de Estudio
El presente estudio fue realizado en el Laboratorio de Cultivo Auxiliares del Centro de Investigaciones Fernando Alcántara Bocanegra (CIFAB) del Instituto de Investigaciones de la Amazonia Peruana -IIAP, ubicado en el km 4.5 de la Carretera Iquitos-Nauta, Loreto-Perú.
Colecta y Aislamiento
Las muestras del cladócero Ceriodaphnia sp y de las clorofitas (Chlorella sp y Scenedesmus sp) fueron colectadas en los estanques del CIFAB, utilizando una red planctónica con abertura de 30 µm, donde se filtraron 50 L de agua. Las muestras fueron colocadas en frascos de polietileno de 500 ml de capacidad y transportadas al laboratorio de cultivos auxiliares, donde fueron identificadas y aisladas con ayuda de un microscopio Leica DM 750. Para la identificación de Ceriodaphnia sp se utilizaron las claves dicotómicas de EL-Moor (1997) y Pennak (1978) y para el aislamiento se empleó la técnica de la pipeta capilar. Para la identificación de las microalgas se utilizó la clave taxonómica de Bicudo y Menezes (2005) y el aislamiento se hizo mediante la técnica de rayado en placas y pipeta capilar.
Obtención de Cepas
La cepa de cada microalga (Chlorella sp y Scenedesmus sp) fue obtenida utilizando como medio de cultivo un fertilizante agrícola (Byfoland: NPK -11-8-6) a razón de 0.2 ml/l. En el caso de los cladóceros Ceriodaphnia sp fueron seleccionados aleatoriamente y colocados en un frasco Erlenmeyer de 1 L, utilizándose solo 500 ml de agua filtrada esterilizada y con una densidad inicial de 1 individuo x 100 ml.
Diseño Experimental
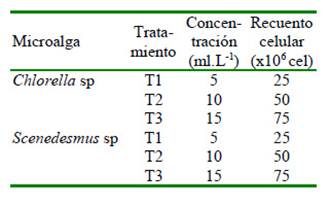
Se trabajó con tres tratamientos de alimentación del cladócero Ceriodapnia sp, utilizando concentraciones (T1: 5 ml.L-1, T2: 10 ml.L-1, T3: 15 ml.L-1) de cada microalga (Scenedesmus sp y Chlorella sp) (Cuadro 1). Para cada tratamiento se realizó un recuento celular aplicando la técnica de Pérez (1995), utilizando una cámara de Neubauer y un microscopio óptico (Leica ICC50 HD) con aumento de 40x. Durante el experimento se contó con aireación constante y luz las 24 horas del día. Se realizaron tres réplicas por tratamiento y dos ensayos para cada clorofita. El periodo de evaluación fue de 17 días para cada ensayo.
Conteo del Cladócero
El recuento de Ceriodapnia sp se hizo cada cuatro días utilizando la cámara de Sedgewick-Rafter, siguiendo el procedimiento descrito por Galván (1982). Se analizaron las siguientes variables poblacionales: Crecimiento Poblacional (Ind/ml), Tasa Instantánea de Crecimiento (TCE) (días-1), Tiempo de Duplicación (TD) (días) y Rendimiento (R) (Ind.ml.día), siguiendo los criterios reportados por Prieto et al. (2006) y Heugens et al. (2006).
Parámetros Fisicoquímicos
Los parámetros físicos y químicos de temperatura, (°C) oxígeno disuelto (mg/l) y pH del agua se evaluaron cada dos días. La temperatura y el oxígeno disuelto fueron medidos con un oxímetro digital (YSY 550) y el pH utilizando un pH metro digital (WWTpH3210).
Análisis Estadístico
Se empleó el Diseño Completamente al Azar y se utilizó una hoja de cálculo Excel (Microsoft Office 2010) para la base de datos del crecimiento poblacional y de los
parámetros fisicoquímicos. El análisis descriptivo se hizo mediante tablas y figuras empleando el programa BioEstat v. 5.0. Los resultados comparativos fueron analizados aplicando el análisis de varianza de una vía a un nivel de significancia de 0.05. Adicionalmente se realizó la prueba de Análisis Principales para relacionar los parámetros fisicoquímicos con el crecimiento de la Ceriodaphnia sp.
RESULTADOS Y DISCUSIÓN
Crecimiento Poblacional
Ceriodapnia sp presentó una fase de aclimatación durante los primeros cinco días del experimento. El crecimiento poblacional tuvo luego un comportamiento exponencial, llegando a obtenerse entre 62 y 107 individuos a los 17 días con Scenedesmus sp y entre 71 y 144 individuos con Chlorella sp. En ambos experimentos, el T2 (10 ml.L-1) presentó el mayor crecimiento poblacional (Figuras 1A, 1B). No obstante, la alimentación con Chlorella sp presentó un mejor rendimiento en comparación con la alimentación con Scenedesmus sp, debido probablemente a los efectos de la densidad. Al respecto, Espinoza et al. (1992) y Duncan (1989) indican que la densidad de alimento puede ser desfavorable en la sobrevivencia de cladóceros al afectar su proceso de filtración. De igual forma el alimento limitado conduce a la disminución del crecimiento coincidiendo con los resultados del presente estudio.
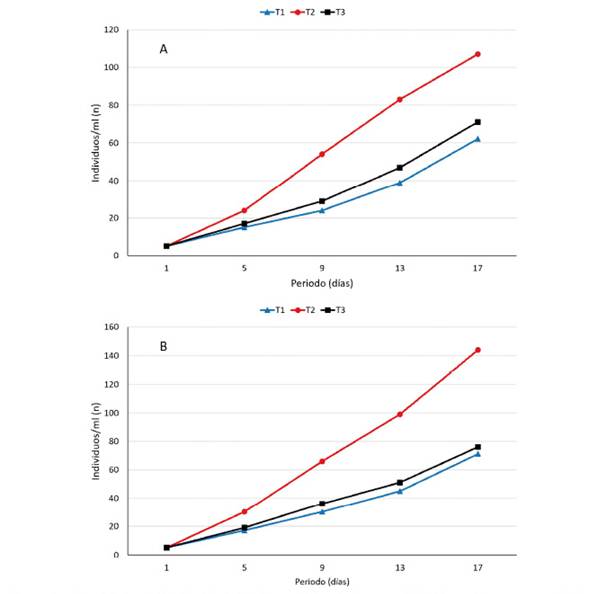
Figura 1 Crecimiento de Ceriodaphnia sp alimentados con (A) Scenedesmus sp y (B) Chlorella sp en condiciones de laboratorio
El mayor crecimiento de Ceriodaphnia sp alimentados con Chlorella sp coincide con Martínez (1999) trabajando con Ceriodahnia dubia y con clorofitas, entre ellas Chlorella. Así mismo, Nandini y Sarma (2003) señalan que cultivando Ceriodaphnia sp con Chlorella sp satisfacen sus requerimientos nutricionales e incrementan su desarrollo.
En contraste, las microalgas Scenedesmus sp y Chlorella sp favorecen la sobrevivencia de Ceriodaphnia sp. Estas diferencias puedan deberse a la calidad nutricional del alimento suministrado. Una estrategia de vida consiste en invertir su energía en sobrevivencia, por lo tanto, no todas las especies de microalgas proporcionadas como alimento son aprovechadas por todas las especies de cladóceros. Es importante tener en cuenta el tipo y concentración de alimento suministrado y la especie de cladócero (Pérez et al., 2015). Ceriodaphnia sp tiene preferencia por Chlorella sp, lo cual es fácilmente explicado en base a la mayor palatabilidad que ofrece en relación otras microalgas (Martínez, 1999).
Tasa Instantánea de Crecimiento (TCE), Tiempo de Duplicación (TD) y Rendimiento (R)
Los valores de TCE variaron entre 0.15 y 0.20 días, resultado inferior a los 0.57 a 0.35 d reportados en Moina micrura por Amarasinghe et al. (1997), pero similar a los 0.13 y 0.15 d reportados por Otero et al. (2013) trabajando con Diaphanosoma sp y Alona sp, respectivamente. Estos valores bajos podrían atribuirse a la baja densidad poblacional inicial (5 individuos), ya que la mayoría de los trabajos utilizan mayores densidades de siembra.
El tipo de dieta presentó diferencias entre los tratamientos (p<0.05) con referencia a la densidad poblacional, tasa de crecimiento y rendimiento en el cultivo. Los valores poblacionales fueron más altos en los individuos alimentados con Chlorella sp, presentando mayor TC (0.20 ± 0.01), menor TD (3.51 ± 0.03) y mayor R (8.19 ± 0.25 ind.ml.día) (Cuadro 2).
Cuadro 2 Parámetros poblacionales de Ceriodaphnia sp alimentadas con Chlorella sp y Scenedesmus sp (TCE: Tasa instantánea de crecimiento; TD: Tiempo de duplicación R: Rendimiento)
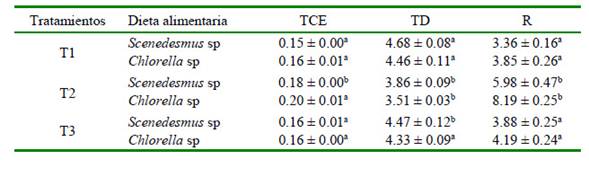
En este trabajo, el mayor valor encontrado en el T2 fue con la microalga Chlorella sp en la concentración de 50x106cel, resultado que concuerda con el trabajo de Romero et al. (2010) quién obtuvo densidades máximas en Moina sp alimentada con Chlorella sp. Sin embargo, Karlsson y Bystrom (2005) obtuvieron menor tiempo de vida con Ceriodaphnia rigaudi alimentados solo con Chlorella. Es posible que la duración de vida de Ceriodaphnia se vea afectada por el tipo de dieta, donde el régimen alimenticio con Chlorella ofrece un alcance positivo a su supervivencia. Los resultados indican que Ceriodaphnia encontró en Chlorella sp la mejor dieta para su supervivencia, desarrollo y reproducción, posiblemente debido a los mayores contenidos de lípidos si se compara con los resultados con Scenedesmus (Kumar y Hwang, 2008).
Condiciones Fisicoquímicas del Cultivo
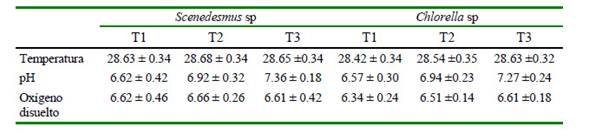
Los resultados de las condiciones fisicoquímicas del agua de cultivo se presentan en el Cuadro 3. La temperatura promedio varió entre 28.42 y 28.68 °C, el pH entre 6.57 y 7.36, y el oxígeno disuelto entre 6.34 y 6.66 mg/l, entre tratamientos. Jiménez et al. (2003) indica que la temperatura puede afectar el crecimiento y la reproducción en cladóceros, siendo la temperatura óptima entre 24 y 31 ºC. Los valores de este trabajo estuvieron dentro del rango considerado como óptimo.
Cuadro 3 Condiciones físicas y químicas registradas en el cultivo de Ceriodaphnia sp en condiciones de laboratorio durante los 17 días de la fase experimental
En el análisis de componentes principales (Figura 2), el primer componente (Axis 1) representa el 50.91% de la variabilidad de los tres tratamientos con sus respectivas réplicas sobre el crecimiento de Ceriodaphnia sp en condiciones de laboratorio, mientras que el segundo componente (Axis 2) lo hizo en un 25.29%. El Axis 1 y Axis 2 representan las variables de calidad de agua (pH, temperatura y oxígeno), los tratamientos con sus réplicas correspondientes y la variable explicativa índice de crecimiento de Ceriodapnia sp. Se observó que la temperatura está correlacionada positivamente con la variable índice de Ceriodaphnia. En este sentido, Rodríguez et al. (2003) y Sipaúba-Tavares y Brachion (2002) consiguieron los mejores resultados para los cladóceros Diaphanosoma birgei y Moina micrura con una temperatura en torno a 25 ºC y dietas a base de microalgas. Por el contrario, los valores de pH están correlacionados negativamente con el índice de crecimiento del cladócero.
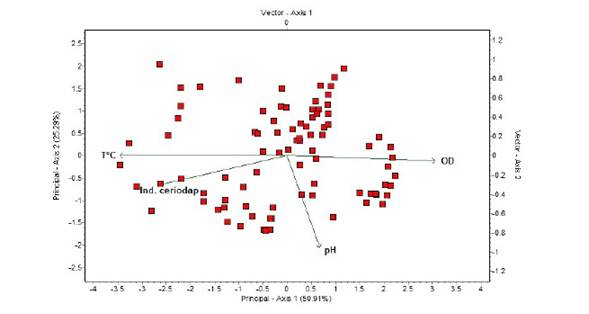
Figura 2 Análisis de componentes principales usando la matriz de correlación de parámetros de calidad de agua incluidas en el crecimiento de Ceriodaphnia sp en condiciones de laboratorio
El pH obtenido (6.57-7.36) concuerdan con los reportes de Prieto et al. (2006) y Romero (2009), que trabajaron con Moina sp alimentados con clorofitas y S. cereviseae, respectivamente, y puede atribuirse que estos organismos requieren en su alimentación la presencia de ácidos grasos esenciales, tales como ácidos grasos insaturados y polinsaturados. Los valores de oxígeno disuelto (OD) del agua no fueron limitantes para el cultivo de Ceriodaphnia, ya que estos organismos toleran ambientes bajos de oxígeno gracias a la capacidad de sintetizar hemoglobina (Rottman et al., 2003).












 uBio
uBio