INTRODUCCIÓN
La microbiota ótica de los perros se compone de bacterias, parásitos y hongos, la cual puede afectarse como consecuencia de una reacción alérgica, presencia de cuerpos extraños o neoplasias (Korbelik et al., 2019). Así mismo, los tratamientos empíricos sin haber identificado al agente infeccioso causante de la otitis externa causan una mayor alteración de la microbiota ótica, lo cual permite la sobrepoblación de bacterias oportunistas o el ingreso de bacterias ambientales (Wiebe, 2015).
Los gérmenes de mayor frecuencia en el ambiente ótico son los Staphylococcus sp. Uno de los factores de virulencia de estas bacterias es la enzima coagulasa o estafilocoagulasa, que convierte el fibrinógeno en fibrina, generando una capa de protección frente a los macrófagos (Hermans et al., 2010). Dentro del grupo de Staphylococcus coagulasa positiva (CoPS) se encuentra S. aureus, bacteria de importancia en la salud pública por su resistencia a los antimicrobianos (Sasaki et al., 2010). Entre otros CoPS que afectan a los animales se puede mencionar a S. pseudintermedius, S. intermedius y S. schleiferi subsp. coagu-lans, los cuales también han sido reportados como resistentes a la meticilina (Devriese et al., 2005; Kawakami et al., 2010; Penna et al., 2010).
Cada año se reportan más casos de bacterias multirresistentes a los antimicrobianos. El S. aureus resistente a la meticilina (SARM) se encuentra dentro del grupo de bacterias de alerta mundial, por ser el agente bacteriano de mayor importancia en las infecciones nosocomiales en medicina humana (Sakoulas et al., 2001; Merlino et al., 2002). Adicionalmente, otras especies de Staphylococcus como S. pseudintermedius y otros CoPS han mostrado ser resistentes a la meticilina (Frank et al., 2009; Weese y van Duijkeren, 2010). Además, se ha demostrado que existe una relación de bacterias resistentes a la meticilina con la presencia del gen mecA, lo cual le provee a la bacteria no solo resistencia contra los β-lactámicos, sino, además, a otros grupos de antibióticos (Bemis et al., 2006; Bannoehr et al., 2007; Schwarz et al., 2018). Sin embargo, en el Perú no se han realizado estas evaluaciones, de allí que el objetivo del presente estudio fue determinar el perfil de resistencia antimicrobiana de los aislados causantes de otitis externa en perros.
MATERIALES Y MÉTODOS
Especímenes
Se tomaron 148 muestras de secreción ótica a 104 perros con otitis externa, sin distinción de raza, edad ni sexo, que acudieron a la Clínica de Animales Menores de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos (Lima, Perú) entre enero y junio de 2018. Como criterio de exclusión para la toma de muestra fue perros que recibieron tratamiento antibiótico durante los tres días previos al muestreo. Las muestras fueron tomadas mediante hisopados de las secreciones óticas. De los 104 perros, 44 cursaron con una otitis bilateral y sus muestras fueron evaluadas de manera independiente debido a las diferencias clínicas reportadas por el médico veterinario tratante.
Identificación de Staphylococcus sp
Los hisopados de las muestras de otitis externa fueron sembrados en agar tripticasa de soya (TSA) y agar MacConkey (MC) e incubados a 37 °C por 24 horas. Adicionalmente, se investigó la posible presencia de levaduras en los hisopados. La identificación de las bacterias del género Staphylococcus se realizó mediante características macroscópicas, tinción Gram, catalasa y oxidasa (Schleifer y Bell, 2015).
Staphylococcus Coagulasa Positiva
Se realizó la prueba de coagulasa en tubo mezclando los aislados de Staphylococcus sp con plasma de conejo (Bactident® Coagulase) e incubando a 37 °C por 4 horas. La formación de un coágulo fue considerada como positivo. Las cepas consideradas como negativas fueron dejadas a temperatura ambiente (20-25 °C) hasta 24 horas para confirmar el resultado como negativo (Zdovc et al., 2004).
Susceptibilidad Antimicrobiana
La prueba de sensibilidad antimicrobiana se hizo siguiendo el método de difusión en disco Kirby-Bauer. Se hizo una dilución bacteriana semejante a la escala de turbidez de 0.5 de McFarland y la muestra fue sembrada en el agar Müller-Hinton con la ayuda de un hisopo estéril (Fariña et al., 2013). Se seleccionaron los antibióticos más usados en la clínica de animales de compañía para el tratamiento de otitis externa. Así, se emplearon los discos de sensibilidad antimicrobiana (Lab Oxoid) de gentamicina (30 µg), cefalexina (30 µg), clindamicina (2 µg), nitrofurantoína (300 µg), ciprofloxacina (5 µg), neomicina (30 µg), doxiciclina (30 µg) y amoxicilina con ácido clavulánico (20 µg/10 µg). Adicionalmente, se evaluó la susceptibilidad a la meticilina usando el disco de oxacilina (1 µg) (Bemis et al., 2006). La interpretación de la susceptibilidad se categorizó de acuerdo con las tablas del Instituto de Estándares Clínicos y Laboratoriales (CLSI) (Weinstein et al., 2018).
RESULTADOS
Se aislaron 113 (76.4%) cepas del género Staphylococcus sp de las 148 muestras colectadas. Las cepas fueron identificadas por ser colonias blanquecinas, circulares y de bordes definidos, cocos Gram positivas agrupados en racimos, catalasa positiva y negativa a la oxidasa. Además, entre las bacterias aisladas se encontraron Pseudo-monas sp (20.3%), Proteus sp (12.8%), Escherichia coli (3.4%) y Streptococcu|s sp (2.0%). También se observó un crecimiento excesivo de Malassezia pachydermatis (51.4%, 76/148).
De las 113 cepas de Staphylococcus sp, 105 fueron positivas a la prueba de coagulasa en tubo. De estas, 72.4% (76/105) fueron positivas en las primeras 4 horas y 27.6% (29/105) fueron inicialmente negativas, pero resultaron positivas en el transcurso de las 24 horas.
Los resultados a la susceptibilidad antimicrobiana demostraron que el antibiótico con mayor número de cepas resistentes fue la ciprofloxacina (27.4%, 32/105), mientras que la nitrofurantoína fue el antibiótico con el menor número de cepas resistentes (3.4%. 4/105). Por otro lado, la susceptibilidad de la oxacilina fue de 15.4% (18/105) para las cepas de Staphylococcus coagulasa positiva (Cuadro 1).
Cuadro 1 Perfil de susceptibilidad antimicrobiana (%) de 105 cepas de Staphylococcus coagulasa positiva (CoPS) aislados de muestras de otitis externa en perros
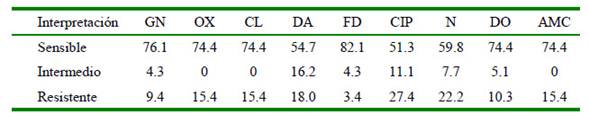
GN: gentamicina, OX: oxacilina, CL: cefalexina, DA: clindamicina, FD: nitrofurantoína, CIP: ciprofloxacina, N: neomicina, DO: doxiciclina, AMC: amoxicilina con ácido clavulánico
Técnica de Kirby-Bauer e interpretado con los estándares del CLSI (2017)
DISCUSIÓN
El estudio concuerda con las investigaciones de otros autores donde Staphylococcus sp es la principal bacteria aislada en otitis externa de perros (Yamashita et al., 2005; Muñoz et al., 2012; Zur et al., 2016). No obstante, Bugden (2013) la reportó como la segunda bacteria más común en este tipo de patología.
Las pruebas bioquímicas para la identificación de especies de Staphylococcus sp no logran ser altamente específicas debido a la gran variabilidad de esta bacteria (Schleifer y Bell, 2015). Para lograr la adecuada identificación bacteriana se requiere realizar pruebas moleculares tales como la secuenciación del ARNr 16S (Rodicio y Mendoza, 2004).
Los Staphylococcus poseen genes de resistencia hacia las fluoroquinolonas (Schwarz et al., 2018). Esto, en combinación con el uso excesivo de este grupo de antibióticos para las otitis externas explicaría la elevada resistencia que muestra frente a la ciprofloxacina (Kunder et al., 2015).
La resistencia a los β-lactámicos (penicilinas y cefalosporinas) encontrados en este estudio (15.4%) fueron similares a los reportados por Morris et al. (2006). Estos resultados fueron corroborados con la resistencia a la oxacilina, la cual se relaciona con la presencia del gen mecA (Bemis et al., 2006).
La resistencia hacia los aminoglucósidos, como la gentamicina (9.4%) y la neomicina (22.2%), fueron inferiores al estudio de Penna et al. (2010), quienes obtuvieron 67.1% de resistencia a la gentamicina y 87.8% a la neomicina. Debido a sus características ototóxicas, dichos antibióticos deberían ser reservados para casos de bacterias multirresistentes.
La nitrofurantoína, otro antibiótico reservado para bacterias multiresistentes, fue el antibiótico con mayor sensibilidad en el presente estudio (82.1%). Sin embargo, se debe considerar que en otras localidades, como es el caso de Brasil donde se ha encontrado hasta 42% de resistencia a este antibiótico (Penna et al., 2010). Esto supone una terapia primaria diferente en otros países, por lo cual genera un perfil de resistencia diferente.
En algunos casos, la M. pachydermatis puede permanecer como un factor perenne y desencadenar una infección ótica secundaria (Bajwa, 2019). En este estudio se observó un sobrecrecimiento de este microorganismo en el 51.4% (76/148) de los casos, pero debido a que no se tiene un registro citológico previo a la otitis, se hace imposible determinar si el agente desencadenante fue fúngico o bacteriano.












 uBio
uBio 

