INTRODUCCIÓN
La alometría, en su sentido más amplio, describe cómo las características de los seres vivos cambian con el tamaño (Klingenberg, 2016). El término se refería originalmente a la relación de escala entre el tamaño de una parte del cuerpo y el tamaño total del cuerpo como un todo, representaba la medida en la que ambos crecen durante el desarrollo.
La relación curvilínea entre dos características biológicas se lineariza cuando los datos se transforman a una escala log-log: log y=α log x + log b (Weber, 1994) donde x es el tamaño del cuerpo, y es el tamaño del órgano, log b es el intercepto de la línea en el eje y, y α es la pendiente de la línea, también conocido como el coeficiente de alometría. Cuando la pendiente α de esta línea es más pronunciada que 1 significa que para cualquier aumento de la unidad en tamaño de cuerpo hay un aumento proporcional más grande en tamaño para el carácter en cuestión, o sea, un ritmo de crecimiento más rápido que el resto del cuerpo, lo que recibe el nombre de alometría positiva o hiperalometría (Klingenberg, 2016; Anzai et al., 2017). Cuando el órgano tiene una tasa de crecimiento menor que el cuerpo en conjunto, α<1, se llama alometría negativa o hipoalometría (Klingenberg, 2016; Anzai et al., 2017). Cuando un órgano crece al mismo ritmo que el
resto del cuerpo, α=1, una condición llamada isometría, implica que tal órgano mantiene un tamaño constante proporcional (Klingenberg, 2016; Anzai et al., 2017).
En general, el uso del método alométrico se ha divulgado en su utilización como una técnica para el estudio del crecimiento relativo, de dimorfismo sexual, hermafroditismo protándrico o reversión sexual, polimorfismo en machos, reconocimiento de formas locales y razas geográficas, dilucidamiento de problemas taxonómicos y genéticos y determinación de relaciones filogenéticas y de procesos adaptativos (Klingenberg y Froese, 1991; Cardini y Polly, 2013; Voje et al., 2014). De hecho, se pueden describir relaciones alométricas para casi cualquier característica con diferentes medidas biológicas (France et al., 1996).
En biología del desarrollo, la heterocronía abarca todos aquellos cambios en el ritmo de los procesos ontogenéticos que dan lugar a transformaciones de la forma y tamaño de los organismos (Rice, 1997). Al analizar los cambios en forma que están asociados al cambio en tamaño en individuos en crecimiento se describe una alometría ontogénica; es decir, mientras los individuos crecen y aumentan de tamaño, cambia la forma principalmente porque diferentes estructuras presentan distintos patrones de crecimiento (Denoël y Joly, 2000). La pedomorfosis consiste en el mantenimiento de caracteres juveniles de las formas ancestrales en el estado adulto y puede afectar a órganos aislados o a la totalidad del organismo (Skulachev et al., 2017). En muchos casos, estos caracteres juveniles son adquiridos a través de neotenia, la cual consiste en un retardo del desarrollo somático de uno o varios caracteres de modo que cuando la capacidad reproductiva es alcanzada el organismo aún retiene en esos caracteres la morfología de una fase juvenil (Skulachev et al., 2017). Un ejemplo es el acortamiento del hocico en los perros y los caballos (Brooks et al., 2010; Drake, 2011). Esta retención de las características juveniles morfológicas en el animal adulto doméstico es bien conocida en el proceso de la domesticación, aunque los mecanismos por los cuales se produce son aún poco comprendidos (Godfrey y Sutherland, 1996; Borgi y Cirulli, 2016).
Los animales domésticos -hemerotipos- han sido seleccionados en favor de un perfil juvenil de la cabeza, hocico corto y otros rasgos, o sea, una retención de aspectos llamativos de la morfología infantil con respecto a la especie considerada origen -agriotipo- (Borgi y Cirulli, 2013). Los cambios físicos también suelen relacionarse con cambios en el comportamiento (Sierra Alfranca, 2001; Künzel et al., 2003).
En animales domésticos se han realizado pocos trabajos sobre crecimiento alométrico (Borgi y Cirulli, 2016; Geiger y Haussman, 2016; Özkadif y Eken, 2016; Parés-Casanova et al., 2018). El objetivo del presente trabajo fue evaluar el dimorfismo en varios tipos de conejo a lo largo de su ontogenia, poniéndose a prueba la hipótesis nula de que para cada tipo no hay diferencias en sus trayectorias de alometría cefálica. Se considera que es la proporción longitud facial/longitud craneal la que puede indicar un posible proceso de pedomorfización, puesto que en el caso de retención de caracteres juveniles a nivel cefálico se detectaría un menor crecimiento relativo de la cara (ParésCasanova et al., 2018). En el presente estudio se comparan diversos hemerotipos -de compañía y de producción sarcopoiética- con su agriotipo, el conejo silvestre (Oryctolagus cuniculus) (Irving-Pease et al., 2018).
MATERIALES Y MÉTODOS
Se colectaron 291 cadáveres frescos de conejos de edades diversas, todos destetados. De ellos, 73 correspondían al tipo «belier» (de oreja caída, longitud de la oreja 85-160 mm, 1.7 ± 0.54 kg de peso corporal), 112 al tipo
«toy» (de oreja pequeña y erecta, longitud de la oreja 42-140 mm, 1.3 ± 0.37 kg), 71 al tipo carnicero (neozelandeses, californianos y sus cruces, 1.0 ± 0.59 kg), y los otros 35 correspondían al conejo silvestre (1.4 ± 0.19 kg). Se registró el sexo de los animales y se midieron las longitudes facial y craneal utilizando un pie de rey (Figura 1).
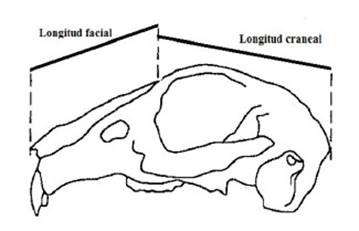
Figura 1 Esquema ilustrativo sobre los puntos de referencia para la medición de las dos longitudes de la cabeza de los conejos
Los datos se introdujeron en una hoja de cálculo y posteriormente fueron exportados al software PAST (Hammer et al., 2001) para realizar los análisis estadísticos. Las posibles diferencias entre tipos y sexos se analizaron con un NPMANOVA (Non Parametric Multivariate ANalysis Of VAriance) de dos vías, recurriendo a las correlaciones como medida de distancia. Se analizó la distribución normal con la prueba W de Shapiro-Wilk y la correlación r de Spearman entre ambas variables. Se compararon las rectas de regresión lineales con los valores transformados logarítmicamente, utilizando la variable «longitud craneal» como variable independiente. Así mismo, se establecieron los parámetros de las rectas para cada tipo, con los datos igualmente transformados logarítmicamente y utilizando el algoritmo RMA (Reduced Major Axis). La inclinación (α) permitió captar la relación entre la longitud facial y craneal entre tipos. Se estableció en un 5% el nivel de confianza. El intercepto b se estableció en 0, puesto que cada tipo presenta tamaños cefálicos muy dispares.
RESULTADOS
La prueba NPMANOVA no reflejó diferencias estadísticamente significativas ni para tipos (p=0.280) ni para sexos (p=0.280), con lo que se procedió a los siguientes análisis independientemente del sexo. Las dos variables -longitudes craneal y facial- presentaron una distribución no normal (W<0.982; p<0.001), y altamente correlacionadas (r =0.776; p<<0,0001), por lo que se justificó la transformación logarítmica de los datos. Por tipos, las rectas de regresión aparecieron homogéneas entre ellas (F=2.40, p=0.068), pero con inclinaciones estadísticamente muy diferentes (p<0.001) (Cuadro 1, Figura 2). En todos los casos se encontraron alometrías positivas y pendientes excediendo de 1 (Cuadro 1). Se observó igualmente que las trayectorias de los conejos
«beliers» y carniceros están extendidas con respecto del resto de tipos -»toys» y silvestres-, fruto del mayor tamaño de los primeros.
Cuadro 1 Valores de las rectas de regresión para los tipos de conejo estudiados (73 "beliers"; 112 "toys"; 71 de tipo carnicero; 35 conejos silvestres), utilizando el algoritmo RMA (Reduced Major Axis) e intersección 0. Datos de la regresión transformados logarítmicamente
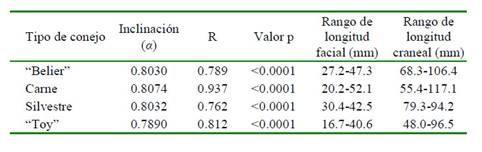
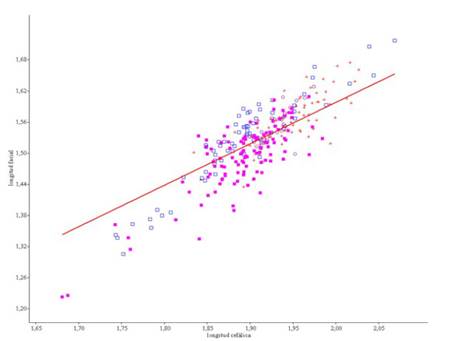
Figura 2 Distribución de los individuos y recta de regresión linear para los 291 tipos de conejo estudiados (73 «beliers», cruces; 112 «toys», cuadrados rellenos; 71 de tipo carnicero, cuadrados vacíos; y 35 conejos silvestres, círculos vacíos). Datos transformados logarítmicamente. Las trayectorias de los conejos «beliers» y carniceros están extendidas con respecto del resto de tipos -»toys» y silvestres-, fruto del mayor tamaño de los primeros
DISCUSIÓN
El análisis de regresión simple indicó que en los tipos de conejo estudiados hay una gran proporción en el cambio de longitud relativa facial, debido a un crecimiento mayor de la cara respecto de la del cráneo a lo largo del periodo postnatal; dicho de otro modo, la proporción relativa de la cara no es constante con el desarrollo. Los resultados muestran diferentes formas heterocrónicas entre los tipos estudiados; o sea, diferentes cambios en la longitud facial asociados a los diferentes cambios en la longitud craneal.
Las diversas alometrías entre tipos indican diferencias sobre cambios de la longitud relativa de la cara con la longitud craneal, siendo este crecimiento facial es en todos los casos heterogénico con alometría positiva (a>1). La inclinación α en los «toy» (0.789) aparece inferior a la establecida para el conejo silvestre (0,796), mas no así en los otros tipos de conejos. Esta «ralentización» implica un desarrollo somático más lento de la cabeza, dando lugar a la retención de características juveniles. Se interpretaría ello, pues, como un fenómeno claro de pedomorfia (Waller et al., 2013; Ivanovic et al., 2014). Por otro lado, la inclinación de la recta en el caso de los carniceros (0.807) excede claramente a la del conejo silvestre, presentando además una extensión de su desarrollo (la relación longitud facial/longitud craneal se extiende a lo largo del crecimiento), producto de su selección para peso y, por ende, desarrollo rápido (Tuyttens et al., 2005). Los silvestres, por su lado, presentan un desarrollo que cesa pronto, fruto de su menor peso corporal, y por ende, con una menor longitud craneal final.
CONCLUSIONES
Los hemerotipos del conejo se comportan de modo pedomórfico o gerontomórfico en su ontogenia, en función de su aptitud y, por ende, del proceso de selección a la que han sido sometidos.
Los conejos de compañía («toy») son claramente pedomórficos, mientras que los «Belier» aparecen claramente isomórficos. Los carniceros son gerontomórficos.












 uBio
uBio 

