INTRODUCCIÓN
Los probióticos son microorganismos vivos que, al administrarse en cantidades apro- piadas, confieren un beneficio para la salud del huésped (FAO, 2006; Steenbergen et al., 2015). Estos microorganismos emergen como una alternativa viable para la acuicultura mundial, debido a que pueden prevenir y controlar patógenos gastrointestinales y mejorar el rendimiento y la productividad de los animales de producción mediante una mejor digestión y absorción de nutrientes (Zhang y Kim, 2014; García-Naranjo et al., 2015; Loh, 2017), la promoción de una microflora favorable (Romero et al., 2014), la producción de sustancias antimicrobianas (Lei et al., 2015), la alteración en la expresión génica en microorganismos patógenos (Hughes y Sperandio, 2008), la modulación, estimulación o supresión del sistema inmune (Harikrishnan et al., 2010, Pagnini et al., 2010; Andani et al., 2012; Bai et al., 2013) y la resistencia a la colonización gastrointestinal (Johnson-Henry et al., 2007).
Los probióticos más comunes utilizados en la acuicultura son bacterias lácticas (Lactobacillus y Carnobacterium) y representantes de los géneros Vibrio (V. alginolyticus y V. parahaemolyticus), Bacillus, Pseuomonas y otros, incluyendo Aeromonas y Flavobacterium (Balcázar et al., 2006, 2007; Das et al., 2012; Banerjee y Ray, 2017). Por otra parte, Saccharomyses cerevisiae es la levadura más frecuente, debido a su contenido en compuestos inmunoestimulantes como β-glucanos, ácidos nucleicos y mananos, con capacidad para estimular una respuesta inmune (Ortuño et al., 2002, Ruiz-González et al., 2018), que coloniza y promueve el desarrollo del intestino como mecanismo de acción para la maduración del sistema digestivo (Gatesoupe, 2007; Abdel-Tawwab et al., 2008; Lara-Mantilla et al., 2016). De igual forma, es un potencial sustituto como alimento vivo en la producción (Nayar et al., 1998), o como remplazo de proteína animal (Ozorio et al., 2012).
La tilapia roja (Oreochromis sp) es uno de los peces más cultivados en el mundo y Colombia tuvo una producción de 100 000 t (FAO, 2017). Por sus condiciones favorables para la producción, experimentación, docilidad, fácil manejo y alta demanda en el mercado interno, es necesario promover su cultivo, considerando las Buenas Prácticas de Producción Acuícola, desde la primera fase de crecimiento (reversión en el caso del híbrido de tilapia roja Oreochromis sp), para el mejoramiento de la condición corporal y resistencia a fenómenos adversos (Díaz y Gallego-Alarcón, 2016; Lara-Mantilla et al., 2016).
Por otro lado, se plantea la optimización y estandarización del empleo de probióticos, tipo levadura, para la mejora en el crecimiento y sobrevivencia de poslarvas, en busca de la rentabilidad y sostenibilidad de la producción para el fortalecimiento de la acuicultura (IICA, 2012). Por ello, se planteó como objetivo del presente estudio utilizar dos dosis experimentales del probiótico Saccharomyces cerevisiae en la alimentación de poslarvas de tilapia roja Oreochromis sp, con el fin de observar su efecto en la salud digestiva y variables zootécnicas.
MATERIALES Y MÉTODOS
El ensayo se realizó en el Centro Experimental Piscícola (CEPI), Vereda Loma Hermosa, en el municipio de San Jerónimo (Antioquia, Colombia) (6°26’49.88’’ N, 75°43’55.42’’ W), a 780 msnm, con temperatura media de 28 °C, humedad relativa del 50% y medioambiente clasificado como Bosque seco tropical (bs-T) (Holdridge, 1979). El agua se obtuvo de la quebrada Guaracú, perteneciente a la cuenca del río Cauca, con los siguientes parámetros fisicoquímicos: temperatura: 23-25 °C, pH: 7.5-9.0, dureza 120 ppm, oxígeno 7.8 mg/l, amonio 1.46 ppm, cloro 6 ppm, topografía pendiente, 900 mm de precipitación anual y alta turbidez en épocas de invierno.
Se utilizaron 9000 poslarvas, 1000 poslarvas/canaleta, de tilapia roja Oreochromis sp en fase de reversión, con un peso promedio inicial de 0.022±0.001 g, distribuidas en nueve canaletas de fibra de vidrio (3.07 m largo x 0.35 m alto x 0.32 m ancho), con un volumen de agua efectivo de 0.25 m3. El ensayo tuvo tres repeticiones y el diseño experimental correspondió a un modelo 3x3. Los tratamientos fueron: Control (T1) (alimento comercial hormonado con 17-α-metiltestosterona) y Tratamientos 1 (T2) y 2 (T3) como el Control más un suplemento de 16 y 31 g/kg de alimento (1.6 y 3.1%, respectivamente) del probiótico Saccharomysses cerevisiae (Levapan®). Los reportes en la literatura científica han indicado inclusiones en la dieta que oscilan entre 1-5 g/kg (0.10.5%) (Abdel-Tawwab et al., 2008) hasta 100-400 g/kg (10-40%) (Ozorio et al., 2012), con el objetivo de obtener beneficios productivos y protección inmunitaria. Por lo anterior, se quiso medir el efecto de S. cerevisiae sobre la incidencia productiva y la salud digestiva en los animales, mediante dos dosis experimentales. Las dosis fueron suministradas en base húmeda (activa), buscando una mayor efectividad en los tratamientos.
El alimento comercial ofrecido contenía 45% de proteína en una cantidad que correspondió al 15% de la biomasa, dividida en ocho raciones al día. La corrección de la alimentación se realizó a los 15 días. Las canaletas tuvieron un recambio individual de 7%/hora del volumen de agua y estuvieron cubiertas con malla para controlar depredadores. Se tomaron las siguientes variables fisicoquímicas del agua: nivel de oxígeno (mg/l) con el oxímetro PinPoint II® (American Marine, USA), temperatura (°C) y pH con el medidor multiparámetro (Oakton®, México) y la turbidez del agua registrado con el disco de Secchi. El tiempo de experimentación fue de 30 días que correspondió a la etapa de reversión de las poslarvas. Una vez finalizado el ensayo, se procedió a contar y pesar las poslarvas.
Las fórmulas para establecer los parámetros zootécnicos fueron:
Porcentaje de sobrevivencia (%) = (Número final / Número inicial)*100
Incremento en peso (g) = Peso final (g) Peso inicial (g)10
Tasa especifica de crecimiento (%/día) = [(Ln Peso final Ln Peso inicial) / (T T )]*100, donde Ln= Logaritmo natural, T = Tiempo final, T = Tiempo inicial
Al final del experimento se hizo la necropsia en el Laboratorio de Histopatología de la Universidad de Antioquia (Medellín, Colombia) de seis individuos por tratamiento para evaluar el tracto intestinal anterior (duodeno) y el hepatopáncreas. Las muestras se colocaron en formol buferado al 10% para su fijación durante 24 h y se procesaron mediante la técnica de inclusión en parafina y coloración de Hematoxilina Eosina. Para establecer lesiones o patologías se observó la estructura de la mucosa intestinal, la distribución del epitelio con sus vellosidades y la lámina propia, alteraciones de los hepatocitos, sinusoides hepáticos y de los acinos del páncreas en microscopio óptico con objetivo de 20x y 40x. Para las descripciones se siguieron las recomendaciones de Jubb et al. (2016).
Los datos cumplieron con el supuesto de normalidad de la prueba Shapiro-Wilk. Se realizó estadística descriptiva y análisis de varianza entre los tratamientos, y se hizo las comparaciones de medias con la prueba de Tukey entre las variables numéricas continuas. Todos los datos fueron procesados en el paquete estadístico PAST®.
RESULTADOS
Parámetros Fisicoquímicos del Agua
Los valores observados se encontraron dentro de los rangos óptimos para el cultivo del híbrido de tilapia roja Oreochromis sp. No se presentaron diferencias significativas entre las variables por efecto de los tratamientos (Cuadro 1). La temperatura del agua varió entre 27.48 ± 3.0 °C (Control) y 27.74 ± 3.1 °C (Tratamiento 2), lo cual está dentro de lo esperado en el cultivo de peces en aguas cálidas. El nivel de oxígeno varió entre 8.7 ± mg/l (Control) y 9.4 ± 2.9 mg/l (Tratamiento 1), muy superior a lo requerido (>0.5 mg/l) (Alcántar-Vázquez et al., 2014). El pH no tuvo ninguna variación, siendo muy homogéneo entre los tratamientos (8.9 ± 0.35). La turbidez fue baja (visibilidad de fondo a través de una columna de agua superior a 20 cm, según el disco de Secchi), con ningún material particulado (Cuadro 1).
Cuadro 1 Parámetros fisicoquímicos promedio del agua en las canaletas de crianza de poslarvas de tilapia roja Oreochromis sp (Antioquia, Colombia)
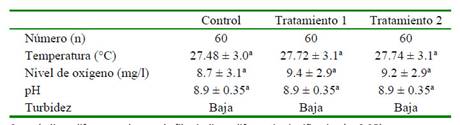
Superíndices diferentes dentro de filas indican diferencia significativa (p<0.05) Control (alimento comercial con 17-α-metil-testosterona), Tratamientos 1 y 2: como el Control más 16 y 31 g/kg (1.6 y 3.1%) de probiótico Saccharomysses cereviciae (Levapan®), respectivamente
Parámetros Zootécnicos
Se encontraron diferencias significativas en el incremento en peso y en la tasa especifica de crecimiento (p<0.05) entre tratamientos. Por otro lado, el porcentaje de sobrevivencia osciló entre 46.0% (T1) y 53.4% (T 2) (Cuadro 2).
Cuadro 2 Parámetros zootécnicos obtenidos en el cultivo de poslarvas de tilapia roja Oreochromis sp con dos dosis de Saccharomyses cerevisiae
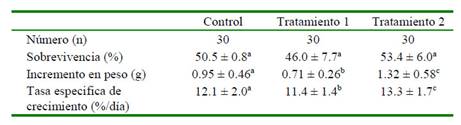
Superíndices diferentes dentro de filas indican diferencia significativa (p<0.05) Control (alimento comercial con 17-α-metil-testosterona), Tratamientos 1 y 2: como el Control más 16 y 31 g/kg (1.6 y 3.1%) de probiótico Saccharomysses cerevisiae (Levapan®), respectivamente
Salud Digestiva
El efecto de Saccharomyces cerevisiae fue notorio en los tejidos bajo evaluación. El grupo Control presentó leve estratificación de la lámina epitelial con poco infiltrado de leucocitos en lámina propia, con un diagnóstico leve de enteritis, a diferencia de los tratamientos 1 y 2 donde se observó necrosis apical multifocal de las vellosidades, infiltrado leucocitario mixto de lámina propia con exocitosis y estratificación de lámina propia, con un diagnóstico de enteritis necrótica subaguda (Figura 1).
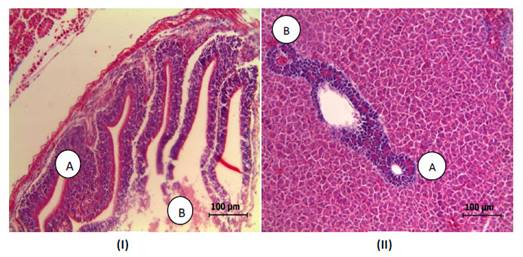
Figura 1 Intestino anterior e hígado de tilapia roja Oreochromis sp suplementadas con Saccharomysses cerevisiae mostrando lesiones histopatológicas. (I) Intestino anterior: (A) lámina propia: con abundante infiltrado leucocitario mixto. (B) epitelio intestinal con necrosis apical de vellosidades multifocal. Diagnóstico: Enteritis necrótica subaguda; (II) Hígado: (A). Hepatocitos tumefactos. Apariencia turbia de citoplasmas. (B). Espacios sinusoides reducidos. Diagnóstico compatible con infiltración glucogénica
En la integridad hepática y del páncreas se observó en el grupo Control hepatocitos con vacuolas bien formadas, de tamaño variable intracitoplasmática, sinusoides típicas, bien definidas y normales. En el hepatopáncreas de los individuos del Tratamiento 1 se observó infiltración grasa moderada, mientras que en el Control se observaron hepatocitos típicos, normales y sinusoides normales, considerándose como hepatopáncreas con características normales. En el hepatopáncreas de los individuos del Tratamiento 2 se observaron hepatocitos tumefactos, con apariencia turbia del citoplasma. espacios sinusoides reducidos, páncreas típico, considerándose como hepatopáncreas compatible con infiltración glucogénica (Figura 1).
Los resultados de la mucosa intestinal e hígado de tilapia roja manifiestan los efectos ocasionados por la dieta suplementada con el probiótico Saccharomyces cerevisiae en exceso. Se observaron lesiones sobre la lámina propia y en el epitelio de las vellosidades, resultando una enteritis necrótica subaguda.
DISCUSIÓN
Los parámetros fisicoquímicos del agua estuvieron dentro de los niveles establecidos por otros autores, quienes coinciden con las características ajustadas del cultivo en aguas cálidas para el hibrido de tilapia roja (Hussain, 2004; Nicovita, 2015). Las tilapias soportan grandes variaciones de temperatura (2035 °C) para un desarrollo normal (AlcántarVázquez et al., 2014). La temperatura es uno de los parámetros más importantes y limitantes en los procesos productivos, ya que afecta las actividades metabólicas, crecimiento, alimentación, reproducción y el comportamiento en general de los organismos acuáticos (Meyer, 2004).
Los niveles de oxígeno disuelto en el agua pueden cambiar radicalmente en pocas horas, desde niveles óptimos hasta letales para los peces, debido a aspectos tales como la alta tasa de descomposición de la materia orgánica, disminución del recambio de agua, alta densidad de siembra y lenta difusión en el agua en atmósferas tranquilas (GarcíaOrtega y Calvario-Martínez, 2008). En este ensayo, el porcentaje de recambio fue suficiente para el volumen de agua utilizado, proporcionando niveles de oxígeno apropiado. Los valores fueron superiores a 5 mg/l, debido en parte, a la época del año (sin lluvias), por lo cual la radiación solar permitió que los procesos fotosintéticos oxigenaran el agua de ingreso.
Alcántar-Vázquez et al. (2014) sugieren que el rango óptimo recomendado de pH para las tilapias se encuentra entre 6.5 y 9.0. Si bien el resultado obtenido tiene una tendencia a la alcalinidad, no llegó al rango de peligro de 10.5 (Kubitza, 2009; PerdomoCarrillo et al., 2012); por lo tanto, los animales no presentaron evidencia de estar afectados y tuvieron una secreción normal de mucus sobre la piel. Del mismo modo, la turbidez no tuvo ningún efecto sobre las poslarvas. Por otro lado, no hubo diferencias en el porcentaje de sobrevivencia entre los grupos experimentales, pero se observó una mayor tendencia en T2.
Diversos autores sostienen que los peces alimentados con probióticos muestran una mayor ganancia de peso, longitud, biomasa final, eficiencia en la conversión de alimento, mejora de la microbiota gastrointestinal y estado inmunológico, así como mayor sobrevivencia en comparación con dietas control o sin probiótico (Bidhan et al., 2014, Zhang y Kim, 2014; Lei et al., 2015), lo cual refuerza el concepto benéfico de estas sustancias cuando se dan en dosis apropiadas a los peces. No obstante, se deben considerar los riesgos potenciales del uso de los probióticos en la alimentación (Doron y Snydman, 2015).
La dosis de 31 g/kg (3.1%) de S. cerevisiae como suplemento en T2 presentó mejores resultados de crecimiento, lo cual concuerda con otros reportes (Abu-Elala et al., 2013, Díaz et al., 2014, Lara-Mantilla et al., 2016). Abdel-Tawwab et al. (2008) encontraron un mayor crecimiento con la inclusión en la dieta de 1 g/kg de alimento (0.1%), una dosis más baja que la empleada en este trabajo. Por otra parte, Ozorio et al. (2012) manifestaron que la inclusión de hasta 150 g/kg (15%) en sustitución de la harina de pescado promueve el crecimiento sin afectar la calidad del producto final. Medri et al. (2000), sugirieron que una sustitución desde 100 a 300 g/kg (10 a 30%) de S. cerevisiae no presentaron efectos adversos sobre el peso, pero el largo tiempo de crecimiento (11 meses para un peso de 150 g) debido a la densidad y estación climática fría, genera dudas sobre el efecto real del probiótico. Pérez-Leonard (2007) indica que la dosis óptima sería de 10 g/kg de peso (1%). Por otro lado, Hassaan et al. (2018) reportaron mejoras en la salud digestiva y en la ganancia de peso en alevinos de tilapia del Nilo (Oreochromis niloticus L) con dietas que contenían 5, 10 y 15 g/kg.
T1 no tuvo el resultado productivo esperado, lo cual podría deberse a un efecto externo que pudo afectar directamente los parámetros zootécnicos. Es necesario mencionar que, el peso o biomasa en general, es un registro altamente variable, porque depende de una diversidad de factores ambientales y otros que interactúan, tales como la temperatura del agua, los niveles de oxígeno disuelto, el amonio, la salinidad, el fotoperiodo, el grado de competencia, la cantidad y calidad del alimento ingerido, la edad y el estado de madurez de los peces (García-Ortega y Calvario-Martínez, 2008).
El resultado obtenido en el presente trabajo fue bueno, en términos de crecimiento de las poslarvas, pero las lesiones observadas fueron evidentes. Los resultados histopatológicos mostraron que la alta concentración de la levadura (31 g/kg = 3.1%) de S. cerevisiae provocó una respuesta excesiva del sistema de defensa del huésped, con un infiltrado mixto leucocitario a nivel de la mucosa intestinal (inflamación: enteritis), daño estructural en varios puntos, incluyendo necrosis sobre las vellosidades intestinales, lo cual af ecta la absorción de nutrientes (Figura 1). Además, hubo daño hepático, marcando el inicio de un efecto irreversible como la necrosis, sumado al deterioro en los sinusoides hepáticos. El sistema digestivo de las tilapias del género Oreochromis sp, caso específico de la Oreochromis niloticus var. Chitralada oscila entre 160.51±23.58 y 249.06±29.91 cm (Pineda-Santis et al., 2012), lo que sugiere tener muchos sectores de absorción, y tener focalizada la patología.
Por lo anterior, es necesario considerar para futuros trabajos la estandarización de la dosis apropiada mediante concentraciones puras del probiótico [<0.6% = (6 g/kg) *100) o hasta 1x109 UFC], cultivo del probiótico especifico extraído del mismo organismo y cantidad ajustada a los requerimientos de los animales.
CONCLUSIONES
Sacccharomyses cerevisiae, suministrado a poslarvas de tilapia roja Oreochromis sp causó lesiones en el tejido intestinal que comprometieron la integridad de las vellosidades, ocasionando enteritis y necrosis de estas. Así mismo, el hígado fue afectado a nivel de los hepatocitos y sinusoides, alterando la estructura y funcionalidad de dicho órgano.
S. cerevisiae mostró resultados relevantes sobre los parámetros productivos, lo cual apoya el buen concepto de su uso como probiótico en los cultivos de peces.












 uBio
uBio 

