INTRODUCCIÓN
Por medio de la crioconservación se busca la estabilización de las células a temperaturas criogénicas (-196 ºC), donde se detiene la actividad metabólica, permitiendo su preservación por periodos de tiempo indefinidos (Cruz et al., 2006).
A pesar de que el semen bovino se ha descrito como uno de los más criotolerantes dentro de las especies domésticas, se observa una disminución considerable en su capacidad fecundante posterior al proceso de congelación (Amirat et al., 2005). A pesar de sus utilidades prácticas en el campo de la reproducción, la criopreservación produce cambios adversos en la composición lipídica de la membrana, el estado del acrosoma, la movilidad y la viabilidad de los espermatozoides, debido a un daño irreversible a nivel estructural y funcional de los compartimentos de las células espermáticas (Gangwar et al., 2018). Por esto, se han creado diversas estrategias como la utilización de diluyentes y la suplementación del semen con sustancias crioprotectoras, estabilizantes y antioxidantes.
En la especie bovina, la yema de huevo ha sido ampliamente utilizada por presentar un efecto crioprotector (no permeable), al generar una mayor resistencia al choque térmico (Murphy et al., 2018). La yema de huevo se considera como uno de los componentes esenciales en los diluyentes (Crespilho et al., 2012), Las lipoproteínas de baja densidad (LDL) son el principal componente en los diluyentes con yema de huevo, pues evitan la pérdida de fosfolípidos de la membrana, aumentan la tolerancia al frío y reducen las lesiones durante la criopreservación (Medeiros et al., 2002; Muiño et al., 2007).
Diversos investigadores han sugerido la sustitución de los diluyentes que contienen productos de origen animal como la yema, por posibles riesgos de contaminación por bacterias, hormonas, drogas u otros microorganismos, siendo una posible fuente de endotoxinas capaces de afectar la capacidad de fecundación de los espermatozoides (Bousseau et al., 1998; Amirat et al., 2005). Esto ha conllevado al desarrollo de diluyentes alternativos libres de productos derivados de animales (Murphy et al., 2018). Así mismo, los diluyentes de origen vegetal, en algunos casos son preferidos para la comercialización internacional para evitar una posible contaminación de la yema de huevo con microorganismos por lo anteriormente mencionado (Van Wagtendonk-de Leeuw et al., 1999); sin embargo, el uso de estos diluyentes suplementados con yema de huevo han presentado, en algunos casos, mejores resultados de calidad del semen posdescongelación, con respecto a diluyentes alternativos como los de origen vegetal (Abdel-Aziz et al., 2019).
Por esta falencia se requiere estandarizar la concentración de yema de huevo utilizando yemas centrifugadas que permitan obtener rendimientos óptimos después de la criopreservación. Resultados de investigación indican que la suplementación con lipoproteínas de baja densidad (LDL) y otras sustancias crioprotectoras como azúcares (Varela et al., 2019), pueden mejorar la calidad pos-descongelación del semen bovino. El objetivo de esta investigación fue evaluar varias concentraciones de yema de huevo centrifugada en un diluyente comercial para la criopreservación de semen bovino.
MATERIALES Y MÉTODOS
Animales y Colecta de Semen
El material de investigación fue recolectado en los municipios de Marinilla, Envigado y Rionegro en el departamento de Antioquia (Colombia). Se utilizaron cuatro toros para la recolección de tres eyaculados por animal. Los animales se encontraban en condiciones óptimas de alimentación, ambiente, manejo reproductivo, con condición corporal entre 3 y 4 (escala 1-5, siendo 1 extremadamente delgado y 5 extremadamente obeso). Las colectas se realizaron con vagina artificial o con electroeyaculador, indistintamente del animal o número de colecta.
El volumen se determinó utilizando una probeta graduada, la concentración del semen mediante un fotómetro Spermacue® (Minitube,Alemania). Los 12 eyaculados tuvieron una concentración no menor de 500 millones cel/ml yuna motilidadsuperior o igual al 60%. El semen fue diluido acorde con lo indicado para cada tratamiento y fue llevado al Laboratorio de Biotecnología Animal (Medellín, Colombia) en refrigeración utilizando un equipo especializado (Equitainer®,Minitube). Las distancias entre los municipios de Marinilla, Envigado y Rionegro hasta el Laboratorio de Biotecnología fueron de 48.2, 23.4 y 44.9 km, respectivamente, y los tiempos de traslado oscilaron entre 50 y 70 minutos. Al arribo al laboratorio se determinó la movilidad espermática, la morfología anormal, la vitalidad espermática y la integridad de membrana (HOS) previo a la congelación.
Preparación de la Yema de Huevo
La yema huevo fue diluida en una proporción de 3:1 con agua ultra-pura y centrifugada a 3400 x g durante 100 minutos. Se extrajo el sobrenadante y este fue empleado en la suplementación de los medios de congelación en tres concentraciones (10, 20 y 30%), según el protocolo modificado de Nouri et al. (2013).
Criopreservación de Semen
El semen fue dividido en tres alícuotas para la criopreservación utilizando como medio base de congelación el diluyente comercial Trilady® (Minitub,Alemania) suplementado con la yema de huevo centrifugada en las tres concentraciones indicadas.
El semen de cada tratamiento fue diluido a una concentración de 60 x 106espermatozoides/ml, enfriado de 32 a 5 °C, y equilibrado en nevera a 5 °C durante 90 minutos, según el protocolo descrito por Amirat et al. (2004) y Jian-Hong et al. (2011). Posteriormente, el semen fue empacado en pajillas de 0.5 ml, mediante un equipo automático de empaque y sellado de pajillas por ultrasonido (MRS1 Dual V2, IMV Technologies, Francia) y se mantuvieron nuevamente a una temperatura de 5 °C durante 30 minutos. Luego fueron llevadas a vapores de nitrógeno líquido a una temperatura aproximada de -120 °C durante 15 minutos donde finalmente fueron sumergidas en un tanque de nitrógeno líquido (IMV Technologies, Francia) para su almacenamiento.
Evaluación Seminal Post-descongelación
La motilidad y la cinética espermática se evaluaron mediante el sistema Sperm Class Analizer (SCA®, Microptic, España) según lo descrito por Restrepo et al. (2013). Se ajustó la configuración del sistema para la especie bovina, con base al tamaño de partícula, la concentración de la muestra y el número de espermatozoides evaluados. Se utilizó un microscopio de contraste de fase (Eclipse E200, Nikon, Japón) con una cámara digital (Scout SCA780, Basler, USA). Se evaluó la movilidad total (MT), movilidad progresiva (MP), y la velocidad lineal (VSL), curvilínea (VCL) y media (VAP).
La morfología anormal (MA) fue evaluada por la técnica de eosina-nigrosina modificada por Barth y Oko (1989), donde sobre un portaobjetos se depositó una gota de muestra y una gota de eosina-nigrosina (Sigma-Aldrich, USA).Ambas gotas se mezclaron y se realizó un extendido, el cual se fijó sobre una platina térmica a 37 °C. Se realizó la evaluación de la morfología de 200 espermatozoides en un microscopio de contraste de fase (Eclipse E200, Nikon, Japón).
Se determinó la vitalidad espermática (VE) utilizando el procedimiento descrito por Gamboa et al. (2010), con el kit Live/Dead (Molecular Probes, USA). Se suspendieron 200 µl de semen, en solución Hanks Heppes (HH) con 1% de albúmina sérica bovina (BSA, Sigma Aldrich, USA), para una concentración de 20 x 106 espermatozoides/ml. La mezcla se incubó a 37 °C durante 8 minutos, con 6 mM de SYBR-14. Seguidamente se incubó de la misma manera, con 0.48 mM de yoduro de propidio (IP). Luego, a partir de una muestra de 5 µl, se evaluaron 200 espermatozoides mediante un filtro UV-2A de un microscopio E200 con fluorescencia HBO (Nikon, Japón).
Se avaluó la integridad funcional de la membrana plasmática (HOS) mediante la prueba hipoosmótica descrita por Neild et al. (1999). Se tomaron 100 ìl de semen y se adicionaron a un tubo con 500 µl de una solución hipoosmótica de sacarosa 5.4% (100 mOs-mol/l). La mezcla se incubó a 38.5 ºC durante 30 minutos y seguidamente se evaluó la reacción de 200 espermatozoides por microscopia de contraste de fase (Eclipse E200, Nikon).
Evaluación Estadística
Se realizó un modelo completamente al azar. Para evaluar las fuentes de variación se ajustó un modelo lineal generalizado (GLM) para cada una de las variables dependientes. La evaluación de la normalidad fue realizada por la prueba de Shapiro-Wilk. Se incluyeron los efectos fijos de fecha de recolección, bovino y la concentración de yema de huevo centrifugada, y como segundo efecto las interacciones entre las variables MP, MT, VCL, VSL, VAP, VE, MA e IM. Las comparaciones de medias entre los experimentos se realizaron mediante la prueba de Tukey. Todas las evaluaciones fueron realizadas con el programa SAS 9.2 (SAS, USA).
RESULTADOS
Se realizó la crioconservación y evaluación de 144 pajillas de semen (4 pajillas por cada eyaculado [12] y por cada tratamiento [3]). Los modelos estadísticos explicaron en una alta proporción (R2>0.72-0.50) las variables dependientes MT, MP y VE, mientras que los parámetros cinéticos (VCL, VSL y VAP) fueron explicados en menor medida por los efectos incluidos (R2=0.50-0.40). En los modelos estadísticos para la MT y la VE fue significativo el eyaculado del toro (p<0.05), para la MP, VCL y VSL fueron significativos el eyaculado del toro y el tratamiento (p<0.05), y para la VAP fue significativo el tratamiento (p<0.05).
Los coeficientes de variación (CV) para MT y MP fueron de 40.8 y 56.2%, respectivamente. Para los demás parámetros se hallaron CV menores al 30%. El Cuadro 1 presenta los resultados para los parámetros de calidad seminal previos a la congelación del semen bovino suplementado con tres concentraciones de yema de huevo.
Cuadro 1 Evaluación de semen bovino fresco, diluido y suplementado con tres concentraciones de yema de huevo centrifugada (10, 20 y 30%)
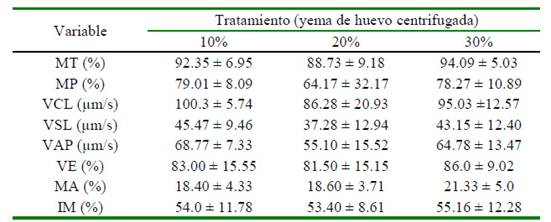
Los resultados se expresan como media ± desviación estándar MT: Movilidad total, MP: Movilidad progresiva, VCL: Velocidad curvilínea, VSL: Velocidad lineal, VAP: Velocidad media, VE: Vitalidad espermática, MA: Morfología anormal, IM: Integridad de membranas
No se encontraron diferencias significativas por efecto de la concentración de la yema de huevo centrifugada en la MT, VE, MA e IM. Sin embargo, hubo diferencias significativas (p<0.05) al emplear un 10% de yema huevo centrifugada en la suplementación de los diluyentes con respecto a VCL, VSL y VAP. El Cuadro 2 presenta los resultados de la evaluación espermática post-descongelación del semen criopreservado en presencia de tres concentraciones diferentes de yema de huevo en el diluyente
Cuadro 2 Evaluación pos-descongelación de semen bovino diluido y suplementado con tres concentraciones de yema de huevo centrifugada (10, 20 y 30%)
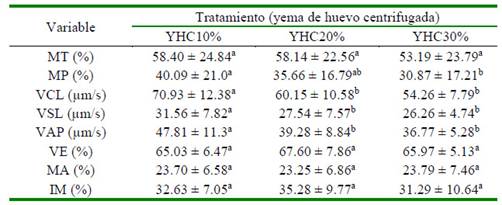
Los resultados se expresan como media ± desviación estándar
MT: Movilidad total, MP: Movilidad progresiva, VCL: Velocidad curvilínea, VSL: Velocidad lineal, VAP: Velocidad media, VE: Vitalidad espermática, MA: Morfología anormal, IM: Integridad de membranas
a,b Letras diferentes dentro de filas denotan diferencia estadística significativa (p<0.05) YHC10, YHC20, YHC30: Yema de huevo centrifugada 10, 20 y 30%, respectivamente.
DISCUSIÓN
El uso de yema de huevo en los diluyentes de congelación se debe principalmente al aporte en LDL compuestos por triglicéridos y colesterol (Moussa et al., 2002), permitiendo la prevención en la formación de cristales de hielo y, de esa forma, protegiendo la membrana plasmática durante la congelación y la descongelación (Morillo-Rodríguez, 2013). Además, la crioconservación puede afectar la organización de los lípidos y la composición química de la membrana plasmática de los espermatozoides (Jiang-Hong et al., 2011). Por esto, un diluyente que contiene LDL es menos complejo en la composición química que el diluyente estándar de yema de huevo (Jiang-Hong et al., 2011).
Se sabe que la capacidad del esperma para soportar los protocolos de congelación y descongelación se basa en algunos parámetros como la movilidad y la integridad de la membrana de los espermatozoides (Contri et al., 2012; Yeste et al., 2015). En el presente estudio se encontraron valores similares en las medias para los tratamientos pre-congelación al 10, 20 y 30% de yema de huevo centrifugada (YHC) en MT, MP, VE, MA e IM (Cuadro 1); sin embargo, Gangwar et al. (2018) encontraron valores de 68±1.11%, 81.50±0.73% y 71.40±0.69 para MT, VE e IM, respectivamente, antes de la congelación con YHC al 20%, donde los valores en la MT fueron superiores en la presente investigación y equiparables para los otros parámetros.
Tarig et al. (2017) utilizando yema de huevo en concentraciones del 12 y 20% reportan valores relativamente similares para motilidad total, vitalidad espermática e integridad de la membrana que en el presente estudio, pero con resultados significativamente mejorescon lasuplementaciónde20% deyema de huevo, a diferencia del presente estudio donde no hubo diferencias significativas en la suplementación con YHC al 10 y al 20% pata la MT, MP, VE, MA e IM (Cuadro 2).
Iaffaldano et al. (2014) encontraron como mejor alternativa para la congelación de semen de conejos la utilización de LDL extraídas de yema de huevo por centrifugación en una concentración del 10% para la motilidad total y la movilidad progresiva, a diferencia del presente estudio donde no hubo efecto del nivel de yema de huevo para estos parámetros. Sin embargo, se coincide con dicho estudio donde la concentración del 10% aporta mejores valores en los parámetros de VCL, VSL y VAP. Esto puede ser debido a que una mayor concentración en yema de huevo genera una mayor viscosidad del medio (Sariozkan et al., 2010; Nouri et al., 2013), pudiendo influir sobre las velocidades analizadas cuando se incrementaron las concentraciones de la yema de huevo.
Son pocos los estudios que evalúan específicamente los parámetros de cinética para VCL, VSL y VAP; sin embargo, Rastergania et al. (2013) en semen de búfalos utilizando diluyentes de congelación libres de yema de huevo reportaron valores de 40.1 ± 5.25 µm/s, 15.9 ± 6.28 µm/s y 21.6 ± 7.06 µm/s para VCL, VSL y VAP, respectivamente, siendo estos valores inferiores a los encontrados en la presente investigación. Esto puede ser un indicativo que la suplementación en la congelación de semen en bovinos con LDL provenientes de la yema de huevo se convierten en una alternativa viable para la criopreservación de las células espermáticas.
El tratamiento del 10%, presenta mejores resultados en cuanto a las velocidades espermáticas (VCL, VSL y VAP). Además, puede considerarse que concentraciones altas de yema de huevo en los diluyentes de congelación podrían desencadenar procesos de peroxidación lipídica en el medio y, por consiguiente, el efecto deletéreo sobre las membranas plasmáticas de los espermatozoides (Montoya et al., 2017).












 uBio
uBio 

