INTRODUCCIÓN
El aumento en la demanda comercial de carne de conejo a nivel mundial ha llevado a muchos criadores a establecer la inseminación artificial como el método más eficiente para el manejo reproductivo (Rosato y Iaffaldano, 2011). El éxito de la inseminación artificial está estrechamente relacionado con el uso de diluyentes que mantengan la viabilidad de los espermatozoides (Kaka et al., 2015). Por esta razón, ha sido indispensable establecer protocolos de conservación de semen, así como reconocer los diluyentes más adecuados para preservar las características seminales (Di Iorio et al., 2014; Johinke et al., 2014).
Las temperaturas usadas en los procesos de refrigeración de semen de conejo han sido muy variables, desde 4 °C (Aksoy et al., 2010) y 5 °C (Di Iorio et al., 2014; Mocé y Vicente, 2002) hasta 15 °C (López-Gatius et al., 2005; Roca et al., 2000) y 18 °C (Lopez y Alvariño, 1998). Así mismo, se han utilizado tiempos máximos de refrigeración, desde 72 h (Di Iorio et al., 2014) y 96 h (Aksoy et al., 2010), hasta tiempos tan prolongados como 240 h (López-Gatius et al., 2005).
Aunque los componentes de los diluyentes para la criopreservación de semen son bastante similares entre especies, los espermatozoides presentan peculiaridades propias de las especies que se requiere optimizar los diluyentes para cada especie en particular (Mocé y Vicente, 2009). En el conejo se agregan crioprotectores permeables a las soluciones de congelación, solas o en combinación con agentes no penetrantes, proteínas o sacarosa (Rosato y Iaffaldano, 2013). Para la congelación seminal se utilizan usualmente diluyentes a base de tris-ácido cítrico, glucosa y yema de huevo (El-Seadawy et al., 2017; Lavara et al., 2017) o lecitinas de soya (Nishijima et al., 2015).
Para la refrigeración de semen de conejo se han evaluado diferentes formulaciones en los diluyentes, como aquellas basadas en Tris (tris[hidroximetil] aminometano), ácido cítrico, glucosa, fructosa, HEPES (áci-do 4[2-hidroxietil] -1-piperazina-metanosulfónico) y yema de huevo (Roca et al., 2000; Aksoy et al., 2010; López-Gatius et al., 2005). Así mismo, se dispone de diluyentes comerciales para semen de conejo basados en dextrosa, citrato sódico y acetato potásico; sin embargo, no se encuentran estudios sobre sus implicancias en la calidad y la fertilidad del semen refrigerado.
Otras sustancias usadas en la conservación de semen son los caseinatos, los cuales han sido efectivos en garantizar la longevidad de los espermatozoides en el enfriamiento. Se conoce su efecto favorable en el mantenimiento de la movilidad espermática y la integridad de la membrana plasmática, e incluso en el incremento de algunos parámetros cinéticos del semen equino (Lagares et al., 2012; Martins et al., 2016); sin embargo, no existen reportes de su uso en el semen de conejo. Con base a esto, el objetivo de esta investigación fue evaluar diferentes diluyentes para la refrigeración de semen de conejo y su efecto sobre la calidad espermática.
MATERIALES Y MÉTODOS
Colecta de semen
Se utilizaron 10 conejos machos (Oryctolagus cuniculus) sexualmente maduros de la raza ruso grande, también conocido como californiano, con edades entre los 6 y 18 meses, ubicados en una producción cunícola en el municipio de Marinilla (Antioquia, Colombia) con una temperatura ambiente de 20 °C. Los animales tuvieron actividad reproductiva constante, fertilidad comprobada mediante crías nacidas vivas y eran alimentados dos veces al día con concentrado comercial. El semen fue colectado mediante una vagina artificial modelo PLQ135 (Pledge Agro, China), la cual contenía agua aproximadamente a 42 °C y utilizando una coneja para estimular al macho durante la colecta. Se colectaron tres eyaculados por conejo, dando un total de 30 muestras seminales. Solo los eyaculados que poseían más del 70% de espermatozoides móviles totales fueron utilizados en el experimento (Mocé et al., 2010).
Dilución y Refrigeración del Semen
Cada muestra de semen se diluyó separadamente en proporción 1:10 en cuatro diluyentes (tratamientos), compuestos por: leche descremada y azucares (T1); dextrosa, citrato sódico y acetato potásico (T2); caseinatos de sodio, fosfatos y azúcares (T3); y tris-ácido cítrico y yema de huevo (T4). El semen diluido se sometió a refrigeración a 16 ºC, (basado en los trabajos de LópezGatius et al. [2005] y Roca et al. [2000]) durante tres días (72 horas), evaluándose la movilidad, la vitalidad y la morfología espermática a las 0, 24, 48 y 72 h de refrigeración.
La movilidad espermática se evaluó mediante el sistema computarizado Sperm Class Analyzer (SCA® v. 5.1, Microptic, España). Se utilizó un microscopio de contraste de fase (Eclipse E200, Nikon, Japón) con una cámara digital (Scout SCA780, Basler, USA). Se estableció una configuración específica para el software de: cubreobjetos de 20x20 mm, óptica en lente de ph-, gota de 7 µl, especie conejo y platina térmica a 37 °C. Se evaluó la movilidad total (MT), movilidad progresiva (MP), velocidad rectilínea (VSL), velocidad curvilínea (VCL), velocidad media (VAP), espermatozoides rápidos, amplitud lateral de la cabeza (ALH) y frecuencia de batido de la cola (BCF). La morfología y la vitalidad espermática se evaluaron mediante la prueba de eosina-nigrosina (El-Seadawy et al., 2017). Para esto, en un portaobjetos se mezcló una gota de semen y una gota de eosina-nigrosina (Sigma-Aldrich, USA), y se realizó un extendido. La evaluación individual de 200 espermatozoides se hizo en un microscopio de contraste de fase Eclipse E200 (Nikon, Japón).
Análisis Estadístico
El análisis estadístico se realizó mediante el ajuste de modelos mixtos. Se evaluó la normalidad mediante la prueba de Shapiro-Wilk y se realizó la comparación de medias por la prueba de Duncan. Se estableció un nivel de significancia de p<0.05. Los análisis se realizaron con el programa estadístico SAS v. 9.2 (SAS Inst, USA).
RESULTADOS Y DISCUSIÓN
El almacenamiento prolongado del semen de conejo en condiciones de refrigeración causa el deterioro gradual de la calidad y de la fertilidad (Roca et al., 2000; LópezGatius et al., 2005; Rosato y Iaffaldano, 2013). En esta investigación se encontró un máximo deterioro de la movilidad total (Figura 1) y la movilidad progresiva (Figura 2) de los espermatozoides con el diluyente a base de dextrosa, citrato sódico y acetato potásico (T2). Este, en las primeras 48 h tuvo una capacidad de conservación de la movilidad similar al diluyente formulado con tris-ácido cítrico y yema de huevo (T4). Por otro lado, se encontró un efecto superior para la protección de la movilidad de los diluyentes compuestos por azucares, acompañados ya sea por leche descremada (T1) o caseinato de sodio (T3). Dicho efecto se redujo en periodos de refrigeración superiores a las 48 h. El daño de los espermatozoides durante la refrigeración ha sido descrito como un factor que limita los programas de inseminación artificial, dado el corto periodo que se puede almacenar el semen de conejo (Iaffaldano et al., 2010).
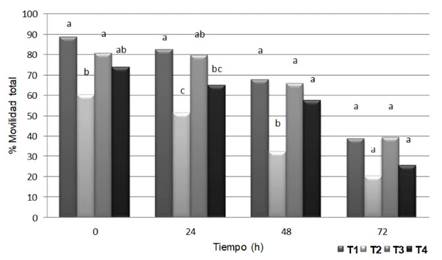
Figura 1 Movilidad total del semen de conejo refrigerado con diferentes diluyentes. T1: leche descremada y azúcares. T2: dextrosa, citrato sódico y acetato potásico. T3: caseinato de sodio, fosfatos y azúcares. T4: tris-ácido cítrico y yema de huevo. Letras diferentes para cada tiempo de evaluación indican diferencia significativa entre tratamientos (p<0.05)
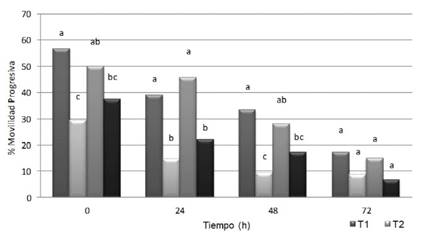
Figura 2 Movilidad progresiva del semen de conejo refrigerado con diferentes diluyentes. T1: leche descremada y azúcares. T2: dextrosa, citrato sódico y acetato potásico. T3: caseinato de sodio, fosfatos y azúcares. T4: tris-ácido cítrico y yema de huevo. Letras diferentes para cada tiempo de evaluación indican diferencia significativa entre tratamientos (p<0.05)
Se conoce que el uso de leche descremada ultra-pasteurizada (UHT) para la dilución del semen de conejo produce valores superiores de espermatozoides móviles y con membrana plasmática intacta y funcional, así como mayor número de embriones recuperados después de la inseminación, en comparación con un diluyente basado en tris-ácido cítrico y glucosa (Hozbor et al., 2016). Esto coincide con lo observado en el presente estudio, donde los diluyentes con leche descremada (T1) o caseinato de sodio (T3) mostraron mejores resultados durante la refrigeración, no solo en la movilidad, sino también en la proporción de espermatozoides rápidos (Figura 3), en algunos parámetros cinéticos (Cuadro 1) y en la proporción de espermatozoides viables o con membrana intacta (Figura 4). Esto podría ser explicado por el aporte antioxidante de la leche descremada, dado que se ha reportado su capacidad para compensar la pérdida de la protección antioxidante no enzimática del semen (Filho et al, 2009).
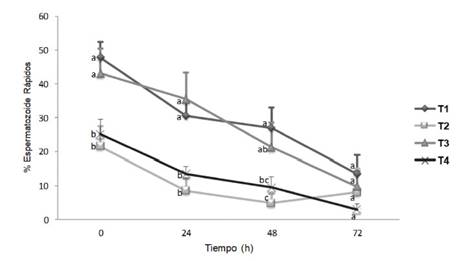
Figura 3 Espermatozoides rápidos en el semen de conejo refrigerado con diferentes diluyentes.T1: leche descremada y azúcares. T2: dextrosa, citrato sódico y acetato potásico. T3: caseinato de sodio, fosfatos y azúcares. T4: tris-ácido cítrico y yema de huevo. Letras diferentes para cada tiempo de evaluación (verticales) indican diferencia significativa entre tratamientos (p<0.05)
Cuadro 1 Parámetros cinéticos del semen de conejo refrigerado con diferentes diluyentes.
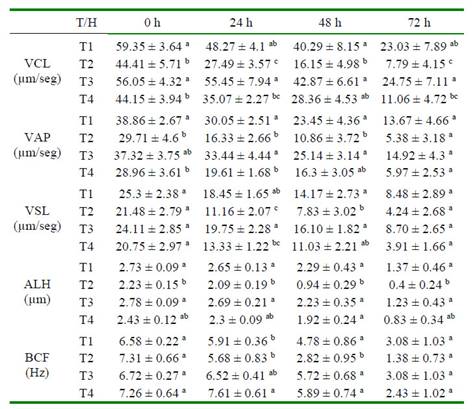
T1: leche descremada y azúcares, T2: dextrosa, citrato sódico y acetato potásico, T3: caseinato de sodio, fosfatos y azúcares, T4: tris-ácido cítrico y yema de huevo Letras diferentes para cada parámetro y tiempo de evaluación indican diferencia significativa entre los tratamientos (p<0.05).
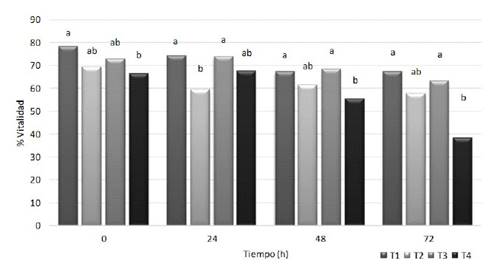
Figura 4 Vitalidad espermática del semen de conejo refrigerado con diferentes diluyentes. T1: leche descremada y azúcares. T2: dextrosa, citrato sódico y acetato potásico. T3: caseinato de sodio, fosfatos y azúcares. T4: tris-ácido cítrico y yema de huevo. Letras diferentes para cada tiempo de evaluación indican diferencia significativa entre tratamientos (p<0.05)
Por otra parte, un problema importante de los diluyentes de semen a base de leche o yema de huevo es el hecho que estos productos biológicos consisten en una variedad de sustancias, las cuales pueden variar entre lotes y, además, pueden incluir fracciones tanto con efectos beneficiosos como perjudiciales sobre la función espermática (Pagl et al., 2006). Esto puede justificar el uso de proteínas definidas o fracciones proteicas purificadas, que para el caso de esta investigación, con el uso de caseinato de sodio (T3), permitieron niveles de protección espermática equivalentes al uso de leche descremada (T1). Estos resultados coinciden con reportes que demuestran que las fracciones de proteína de leche purificada pueden ser tan efectivas para preservar la fertilidad del semen refrigerado como los diluyentes que contienen leche descremada (Pagl et al., 2006; Lagares et al., 2012).
En el presente estudio fue evidente el efecto de la composición del diluyente sobre la cinética espermática. Se sabe que los diluyentes juegan un papel clave en el almacenamiento de semen de conejo, al proporcionar los nutrientes necesarios para el mantenimiento metabólico, asi como para el control del pH y la presión osmótica del medio, haciendo que se reduzcan los cambios perjuidiciales sobre los espermatozoides (Di Iorio et al., 2014). Por otro lado, se sabe que el almacenamiento del semen en refrigeración tiende a reducir el metabolismo de los espermatozoides (Dessouki et al., 2016). En el presente estudio, se observó una marcada reducción de la mayoría de los parámetros cinéticos a las 72 horas de refrigeración, donde solo se hallaron diferencias entre los diluyentes, para VSL y ALH (Cuadro 1), lo cual confirma que el tiempo ideal para el almacenamiento en refrigeración del semen de conejo es de 48 horas (Iaffaldano et al., 2010).
No se observaron alteraciones significativas de morfología espermática en ninguno de los tratamientos durante las primeras 48 h de refrigeración (Figura 5); sin embargo, la reducción de la morfología normal, observada a las 72 h para el diluyente tris-ácido cítrico y yema de huevo (T4), podría estar relacionada con la más temprana pérdida de la viabilidad de este tratamiento (Figura 4), la cual podría contribuir al incremento de la presencia de células degeneradas o apoptóticas.
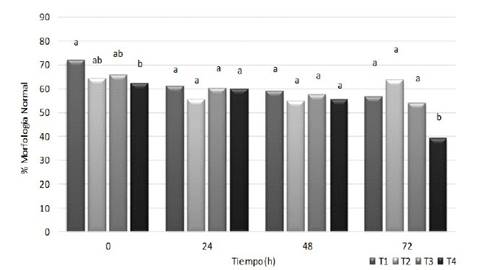
Figura 5 Morfología espermática del semen de conejo refrigerado con diferentes diluyentes. T1: leche descremada y azúcares. T2: dextrosa, citrato sódico y acetato potásico. T3: caseinato de sodio, fosfatos y azúcares. T4: tris-ácido cítrico y yema de huevo. Letras diferentes para cada tiempo de evaluación indican diferencia significativa entre tratamientos (p<0.05)
Son pocas las publicaciones que reportan específicamente el uso de dextrosa en diluyentes para la refrigeración o la congelación de semen (Yulnawati et al., 2009; Bhakat et al., 2011). Así mismo, son escasos los reportes de la adición de acetato de potasio en los diluyentes, el cual se ha incluido principalmente en investigaciones con semen de cerdos y aves (Siudziñska y £ukaszewicz, 2008; Dziekoñska et al., 2009), no habiéndose encontrado investigaciones de ambos aditivos en semen de conejo. Sin embargo, los resultados de este estudio mostraron una menor capacidad de conservación de la calidad seminal por efecto de la refrigeración del semen con el diluyente a base de dextrosa, citrato sódico y acetato potásico (T2), con el cual se observó una rápida disminución de la movilidad y de algunos parámetros cinéticos (Cuadro 1). Así mismo, se observó cierto nivel de reducción de la vitalidad a las 48 y 72 h de refrigeración (Figura 4), aunque sin diferencia estadística con los demás tratamientos.
CONCLUSIONES
Los diluyentes compuestos por leche descremada o caseinatos, y azucares protegen de forma más eficiente los espermatozoides de conejo conservados mediante refrigeración.
La presencia de caseinato de sodio en lugar de leche descremada en el diluyente produce niveles equivalentes de protección espermática durante la refrigeración, con la ventaja de aportar un diluyente de composición definida.
El uso de un diluyente a base de dextrosa, citrato sódico y acetato potásico provee una menor capacidad de conservación de la calidad del semen de conejo sometido a refrigeración.












 uBio
uBio 

