INTRODUCCIÓN
El cuy (Cavia porcellus) es una especie oriunda de los Andes sudamericanos, cuya crianza se ha expandido en los últimos años y actualmente constituye una alternativa de ingreso económico para familias campesinas y pequeños productores (Bustamante y Bustamante, 2009; Chauca, 2018); sin embargo, su producción puede estar limitada por diversas enfermedades parasitarias, causando un impacto económico negativo. La susceptibilidad a un rango amplio de especies parasitarias se facilita por el mecanismo de cecotrofia, compensación biológica que permite recuperar nutrientes facilitando su absorción (Chauca, 1997).
Estudios sobre helmintiasis en cuyes de Ancash y Junín, Perú, criados bajo el sistema familiar-comercial mostraron prevalencias superiores al 80% a través de la evaluación de tractos gastrointestinales de la fase de acabado (García et al., 2013; Sánchez, 2013), siendo Paraspidodera uncinata, Trichuris spp y Capillaria spp las especies parasitarias más frecuentes. Así mismo, Vargas et al. (2014) encontraron que la época de lluvia en la zona de Oxapampa, Perú, presentaba 5.7 veces mayor riesgo de endoparasitismo intestinal que la época de seca.
Existen diversas técnicas coprológicas cualitativas y cuantitativas para el diagnóstico de la helmintiasis intestinal, tales como la técnica de sedimentación y de flotación (Barriga, 2002; Conceição et al., 2002; Bowman, 2014). El objetivo del estudio fue estimar la prevalencia de helmintiasis gastrointestinales en cuyes de producción familiar-comercial del distrito de Matahuasi en Junín, Perú. Así mismo, determinar los géneros y especies de helmintos gastrointestinales, carga parasitaria, tipo de parasitismo, grado de concordancia entre la técnica de recuento diferencial de parásitos al examen post mortem vs. las técnicas coprológicas y la sensibilidad/especificidad de las técnicas coprológicas en el diagnóstico de la helmintiasis gastrointestinal en cuyes.
MATERIALES Y MÉTODOS
El estudio se realizó en el distrito de Matahuasi, provincia de Concepción, departamento de Junín, Perú, ubicado a 21 kilómetros al noroeste de la ciudad de Huancayo a una altitud de 3262 msnm, con temperaturas medias anuales entre 16.3 y -3.5 °C. La toma de muestras se llevó a cabo entre enero y marzo de 2017. El procesamiento de muestras, diagnóstico, identificación y cuantificación de parásitos se realizó en el Laboratorio de Parasitología de la Facultad de Medicina Veterinaria (FMV) de la Universidad Nacional Mayor de San Marcos (UNMSM), Lima.
El tamaño muestral se determinó mediante la fórmula para estimar una proporción basada en la aproximación normal a la distribución binomial, con 95% de confianza y 5% de precisión (Daniel, 2007), utilizando la prevalencia de 82.5% obtenida por Sánchez (2013). El tamaño muestras resultante fue de 222; sin embargo, se llegaron a utilizar 262 tractos gastrointestinales.
Los tractos gastrointestinales fueron adquiridos del centro de acopio del distrito de Matahuasi. Fueron seleccionados de manera aleatoria y sistemática cogiendo un tracto gastrointestinal por cada cuatro animales sacrificados.
El procesamiento de las muestras se realizó en dos etapas: la primera se realizó en el distrito del estudio donde luego de la identificación de los tractos gastrointestinales (fecha de colecta, número del animal, sexo, etapa productiva y productor), se ligaron en puntos estratégicos del tracto (cardias, píloro, inicio de ciego y recto) a fin de evitar la migración de parásitos. Se procedió al recuento diferencial de parásitos por el examen post mortem siguiendo los lineamientos de Leguía y Casas (1999). Cada sección se trabajó por separado. Una vez abierta la víscera, el contenido junto con el raspado de la mucosa se colocó en un frasco tamiz de 60 hilos/pulgada, el cual se completó con agua de grifo y agitó repetidas veces hasta el aclaramiento del agua. Se evaluó el contenido mediante el empleo de una lupa, colectando los parásitos adultos con pinzas entomológicas, siendo conservados en alcohol al 70% para su posterior identificación. Durante este procesamiento, se obtuvieron muestras fecales (10 g) obtenidas del recto siendo conservados con formol al 10% para su evaluación posterior, mediante exámenes coprológicos cualitativos.
La segunda etapa se realizó en el laboratorio de la FMV-UNMSM, donde se aclararon los parásitos con alcohol-fenol durante 15 minutos para su identificación mediante claves taxonómicas (Skrjabing et al., 1970; Cordero del Campillo et al., 1999; Urquhart et al., 2001; Barriga, 2002; Rossin et al., 2004; Quiroz, 2010; Da Silva et al., 2015). Además, se utilizaron las técnicas coprológicas de Flotación de Sheather modificado de Barriga (Barriga, 2002) y Dennis modificado para evaluar la presencia de huevos de helmintos gastrointestinales.
Se calculó la prevalencia de helmintos y se expresó en forma porcentual con sus respectivos intervalos de confianza al 95% (Daniel, 2007). Se estimó la cantidad de parásitos adultos mediante la técnica de recuento diferencial de parásitos al examen post mortem. Así mismo, se utilizó la prueba de Kappa para determinar el grado de concordancia entre las técnicas coprológicas y el recuento diferencial de parásitos al examen post mortem (González y Falcón, 1999). Se calculó la sensibilidad y especificidad de las técnicas coprológicas (Daniel, 2007).
RESULTADOS
La presencia de parásitos gastrointestinales fue evaluada en cuyes del distrito de Matahuasi, provincia de Concepción, Junín mediante el recuento diferencial de parásitos al examen post mortem, obteniéndose una prevalencia del 82.8 ± 4.6% al 95% de confianza. La prevalencia por especie parasitaria fue: P. uncinata (74%), Capillaria spp (34%), T. axei (6.1%) y Trichuris spp (3.4%) (Cuadro 1). La carga parasitaria en promedio fue de 24.7 helmintos por animal, pudiéndose encontrar Paraspidodera uncinata, Capillaria spp, Trichostrongylus axei y Trichuris spp (Figuras 2, 3, 4 y 5) con promedios aritméticos de 23.5, 8.7, 1.2 y 1.2 especímenes por individuo, respectivamente (Cuadro 1).
Cuadro 1 Prevalencia por especies de helmintos y cargas parasitarias en 262 cuyes (Cavia porcellus) mediante el recuento diferencial de parásitos al examen post mortem en el distrito de Matahuasi, provincia de Concepción - Junín (2018)
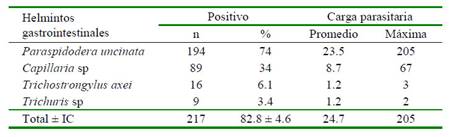
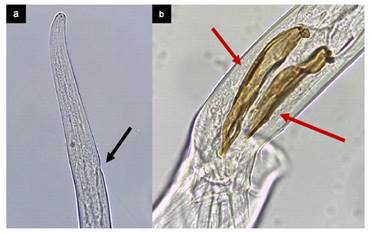
Figura 2 Características morfológicas de Trichostrongylus axei: (a) Vista ventral del extremo anterior. Nótese el poro excretor (fecha negra) característico de este género (100X); (b) Vista ventral del extremo posterior de un macho. Se observan las espículas desiguales (flecha roja) (400 X)
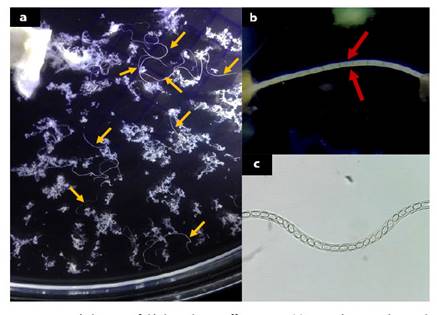
Figura 3 Características morfológicas de Capillaria spp: (a) Especímenes observados al estereoscopio (fecha amarilla); (b) Esticosoma (fecha roja); (c) Hembra grávida (100X)
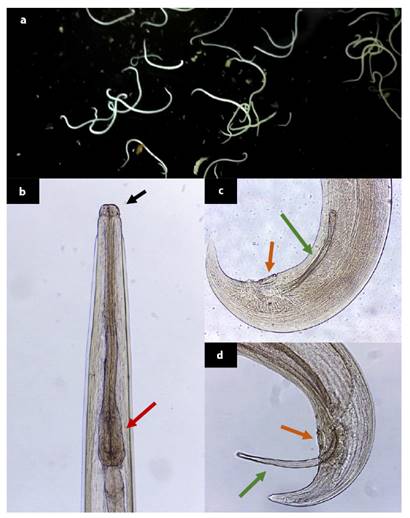
Figura 4 Características morfológicas de Paraspidodera uncinata: (a) Especímenes observados al estereoscopio; (b) Vista ventral del extremo anterior. Obsérvese los tres labios prominentes característicos de esta especie (flecha negra), así como el bulbo esofágico (flecha roja) (100X); (c) (d) Vista lateral del extremo posterior. Se observan las espículas uniformes (fecha verde) y la papila precloacal (flecha naranja) (100X)
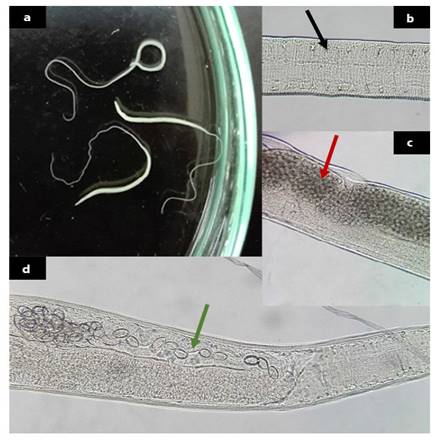
Figura 5 Características morfológicas de Trichuris spp: (a) Especímenes observados al estereoscopio; (b) Vista ventral del extremo anterior. Se observa el esticosoma (flecha negra) (400X); (c) (d) Vista ventral del extremo anterior de una hembra grávida. Nótese el útero lleno de huevos (flecha roja) (400X) y el oviyector (flecha verde) (400X)
El Cuadro 2 muestra los tipos de parasitismo encontrados en el presente estudio. La mayor frecuencia fue de monoparasitismo (50.4%). Dentro del biparasitismo, el más común fue la asociación de P. uncinata con Capillaria spp (25.6%).
Cuadro 2 Tipos de parasitismo en 217 cuyes parasitados, según especies de helmintos hallados, en el distrito de Matahuasi, provincia de Concepción, Junín (2018)
En la observación directa de los huevos se pudo identificar las mismas especies parasitarias que mediante el conteo diferencial al examen post mortem (Cuadro 3, Figura 1). Adicionalmente, se realizaron 100 micromediciones de huevos de P. uncinata determinándose un valor promedio de 65.23 µm de largo por 51.61 µm de ancho. Además se id e n ti f i c a r on h ue vos d e Fasciola hepatica mediante la técnica de Dennis modificada en dos de las muestras. Solo se encontraron infecciones leves (1 a 3 huevos por campo).
Cuadro 3 Especies y formas parasitarias identificadas con las técnicas coprológicas (Flotación con "Sheather" y Dennis Modificado) y el recuento diferencial de parásitos al examen post mortem en el distrito de Matahuasi, provincia de Concepción, Junín (2018)
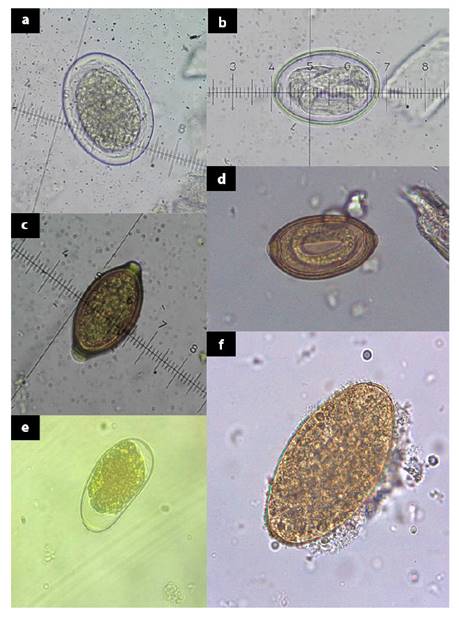
Figura 1 Huevos de helmintos encontrados mediante los métodos coproparasitológicos de Flotación de Sheather y Sedimentación de Dennis Modificado: (a) (b) Huevos de Paraspidodera uncinata (400 X); (c) Huevo de Trichuris spp (400 X); (d) Huevo de Capillaria spp larvado; (e) Huevo tipo Strongylus «HTS» (400 X); (f) Huevo de Fasciola hepatica (400 X)
Los resultados obtenidos mediante la prueba de Kappa muestran que los métodos coproparasitológicos utilizados tienen un grado de asociacion leve con relación al recuento diferencial de parásitos al examen post mortem y que, además, son irremplazables.
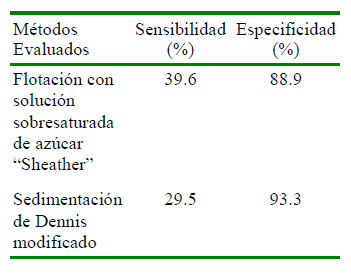
Así mismo, la sensibilidad de la técnica de flotación de Sheather y la técnica de Dennis modificada para el diagnóstico de helmintiasis gastrointestinal fue baja (39.63 y 29.49%, respectivamente) (Cuadro 4).
DISCUSIÓN
El presente estudio reportó una alta prevalencia de helmintiasis gastrointestinal (82.8 ± 4.6%) en cuyes del distrito de Matahuasi, Junín (Cuadro 1), mediante el recuento diferencial de parásitos al examen post mortem, correspondiendo la totalidad de estos parásitos a nematodos. El porcentaje resultante es similar al encontrado en otros estudios en Ancash 82.5% (García et al., 2013) y en Junín de 89% (Sánchez, 2013) mediante el análisis de tractos gastrointestinales durante el beneficio.
La helmintiasis gastrointestinal en cuyes presenta una múltiple etiología parasitaria, pudiendo estar comprometidos nemátodos, cestodos y trematodos, aunque la nematodiasis es la más frecuente. Las mayores frecuencias encontradas en el estudio correspondieron a Paraspidodera uncinata (74%) y Capillaria spp (34%). Diversos estudios en el país coinciden en señalar que la nematodiasis por P. uncinata es la principal parasitosis helmíntica en cobayos de producción (García et al., 2013; Sánchez, 2013; Suárez et al., 2014; Vargas et al., 2014; Becerra, 2015; Morales, 2017), así como en cobayos mascotas y de laboratorio de en América del Sur (Magalhães et al., 2002; Alves et al., 2007; Medeiros, 2012; Arroyo y Padilla, 2013), Europa (Coman et al., 2009; d’Ovidio et al., 2015), Asia (Motamedi et al., 2014) y África (Kouam et al., 2015; Meutchieye et al., 2017).
Si bien P. uncinata es el helminto de mayor reporte en cuyes a nivel mundial, su efecto patológico en el hospedero es discutido, y parece que su presencia es asintomática; sin embargo, Conder et al. (1989) reportó la ocurrencia de eosinofilia en cuyes. La frecuencia de este parásito es alta (hasta 83%) en cuyes de producción (García et al., 2013; Sánchez, 2013; Suárez et al., 2014; Vargas et al., 2014; Becerra, 2015; Morales, 2017), pero en cuyes utilizados como mascotas y de laboratorio no supera el 40% (Magalhães et al., 2002; Coman et al., 2009; Motamedi et al., 2014; d´Ovidio et al., 2015; Meutchieye et al., 2017), posiblemente debido al mejor manejo sanitario y poblacional.
La presencia de Trichuris spp en el estudio fue baja (3.44%) al igual que en otros estudios (Aquino et al., 2010; García et al., 2013; Sánchez, 2013; Suárez et al., 2014; Vargas et al., 2014; Becerra, 2015; Morales, 2017). No obstante, se debe tener en cuenta su efecto patológico, pues con cargas elevadas causa diarreas muco-sanguinolentas en animales jóvenes (Cordero del Campillo, 1999; Quiroz, 2010). No se pudo identificar la especie, debido a que todos los especímenes encontrados eran hembras; sin embargo, se podría sospechar de Trichuris gracilis y Trichuris leporis, especies reportada en la familia Caviidae (Zaldivar, 1990; Dittmar, 2002).
La frecuencia encontrada de Capillaria spp a nivel del intestino delgado (33.97%), sin haberse podido identificar la especie, fue superior a otros reportes en el país que variarían entre 3.5 y 25% (Aquino et al., 2010; Padilla, 2012; García et al., 2013; Sánchez, 2013; Vargas et al., 2014; Becerra, 2015). La literatura lo describe como una especie no patógena, incluso con cargas elevadas (Soulsby, 1987; Quiroz, 2010); sin embargo, dentro de este género se encuentra C. hepatica, helminto con potencial zoonótico y agente causante de la capillariasis (calodiasis) hepática que genera inflamación crónica focal en hígado y que ha sido reportada en Cavia porcellus y Cavia aperea aperea (Olortegui, 1961; Dittmar, 2002).
T. axei y T. columbriformis son las únicas especies del género Trichostrongylus que se han reportado en cuyes y demás roedores del género Cavia. Ambas especies son zoonóticas, lo cual constituye un riesgo potencial para los productores. En el presente trabajo solo se encontraron especímenes de T. axei a nivel de estómago, con una frecuencia de 6.11%. Si bien Trichostrongylus spp es considerado asintomático, cargas elevadas en rumiantes pueden producir diarreas acuosas (Bowman, 2014).
No se encontraron especímenes de trematodos en el intestino delgado e intestino grueso de los cuyes evaluados, aunque se ha reportado Pseudoquinqueserialis caviae y Taxorchis caviae en cuyes silvestres (Cavia aperea aperea) en Brasil (Kawazoe et al., 1981; Pereira, 2006). Sin embargo, mediante el método de Dennis Modificado se encontraron huevos de Fasciola hepatica (0.76%), sin encontrarse estadios juveniles ni adultos, al no haberse evaluado los hígados. La frecuencia de huevos de F. hepatica fue baja a pesar de que se realizó durante la época de lluvia y en una zona mesoendémica para poligástricos (Valderrama, 2016) e hiperendémica para humanos (Marcos et al., 2004), debido a que el método de diagnóstico no sería el más adecuado en cuyes por el corto periodo de vida comercial (aprox. 3 meses), el cual se encuentra muy cercano al periodo prepatente de este trematodo.
No se evidenció la presencia de cestodos adultos ni de formas larvarias (metacéstodos); sin embargo, se ha reportado Monoecocestus parcitesticulatus (Anoplocephalidae) en roedores del género Cavia (Cavia aperea, C. porcellus, C. tschudii) en Brasil y Perú (Magalhães et al., 2002; Pereira, 2006; Quispe et al., 2011). Por otro lado, en el país se ha reportado Cysticercus tenuicollis y quiste hidatídico (INIA y CIID, 1991) en cuyes de crianza familiar.
No existen estudios que correlacionen la carga parasitaria de helmintos en cuyes de producción, como se encuentra documentado en bovinos y ovinos (parasitismo leve, moderado y alto). Las mayores cargas observadas en el estudio (Cuadro 1) fueron para P. uncinata con 23.5 parásitos adultos en promedio; siendo mayor a lo reportado por García et al. (2013) (13.7) y Sánchez (2013) (10.9). Sin embargo, los animales evaluados se hallaban aparentemente sanos y con buen estado de carnes. La frecuencia de monoparasitismo (50.38%), biparasitismo (30.15%) y triparasitismo (1.91%) (Cuadro 2) fue similar a otros estudios en el país (García et al., 2013; Sánchez, 2013).
Las prevalencias encontradas mediante las técnicas coprológicas de flotación con solución sobresaturada de azúcar - Sheather (34.76%) y el método de Dennis modificado (30.12%) (Cuadro 3) evidenció su baja sensibilidad con respecto al recuento diferencial de parásitos al examen post mortem (82.82%), método considerado gold standard.
La baja sensibilidad de las técnicas coprológicas puede deber a factores como la cantidad de materia fecal procesada (Conceição et al., 2002), intermitencia en la eliminación de huevos y densidad de la solución flotadora (Hinaidy et al., 1988), entre otros, lo cual indica una baja probabilidad de encontrar cuyes infectados. Por otro lado la especificidad fue mayor al 85%, indicando la probabilidad que un cuy sin helmintos resulte negativo a las pruebas, dando mayor confianza sobre los resultados.
CONCLUSIONES
Se encontró una alta prevalencia de helmintiasis gastrointestinal (82.8 ± 4.6%) en cuyes de crianza familiar-comercial del distrito de Matahuasi, provincia de Concepción, Junín.
Se identificaron las especies Paraspi-dodera uncinata (74%), Capillaria spp (34%), Trichostrongylus axei (6.1%) y Trichuris spp (3.4%).
El número promedio de parásitos en los tractos gastrointestinales fue 24.7, hallándose mayormente Paraspidodera uncinata y Capillaria spp.
Se identificaron las siguientes asociaciones: monoparasitismo (50.4%) biparasitismo (30.2%) y triparasitismo (1.9%).
El grado de concordancia entre las técnicas de flotación y Dennis modificado vs recuento diferencial de parásitos al examen post mortem fue pobre (0.13 y 0.19, respectivamente).
La sensibilidad de las técnicas de flotación de Sheather y Dennis modificado fue 39.6 y 29.5% respectivamente, mientras que la especificidad fue 89.9 y 93.3%, respectivamente.












 uBio
uBio