INTRODUCCIÓN
La población ovina en el Perú es de 9 523 200 cabezas, de las cuales el 81% son criollos y el 94.2% se crían en las zonas altoandinas, mayormente en el centro y sur del país (INEI, 2012). Los departamentos de Puno, Cusco y Junín son los mayores productores de ovinos criados en forma semiextensiva, con pasturas naturales y con escasas tecnologías de manejo y mejoramiento genético (MINAGRI, 20017).
La población ovina era cerca de 20 millones en la década del 60. La disminución de la población se ha debido a diversos factores técnicos, así como por la disminución de los precios de la lana y la presencia de enfermedades infecciosas, entre otras (MINAGRI, 2017). El calentamiento global y cambio climático podría afectar la salud de los ovinos de modo directo por la inadecuada respuesta inmunitaria frente a infecciones, debido al estrés de calor o al presentarse un incremento de patógenos y artrópodos transmosores de enfermedades virales (Bett et al., 2017).
El ovino puede ser afectado por diversas enfermedades bacterianas, parasitarias y virales, entre estos últimos, por el virus de la Lengua Azul (VLA), un arbovirus perteneciente al género Orbivirus, familia Reoviridae (Mertens et al., 2004). El VLA posee 27 serotipos con diversos grados de patogenicidad, presentes en todos los continentes excepto la Antártida (Purse et al., 2005; Mann et al., 2011). El VLA es transmitido a rumiantes domésticos y silvestres por especies de mosquitos del género Culicoides, que están expandiéndose fuera de su conocido hábitat geográfico (40° N y 35° S) a mayores altitudes y latitudes, ocasionando severas pérdidas económicas por sus efectos en la salud animal, la reproducción y por ser restrictiva para el comercio internacional de ovinos y otros rumiantes domésticos en pie y de germoplasma (Purse et al., 2005; OIE, 2018).
La expansión de los Culicoides spp a muchos países europeos entre 2006 y 2008 permitió que el VLA ocasionara severos brotes de la enfermedad causado por un solo serotipo donde más de 800 000 cabezas de ovinos fueron afectados. Por ejemplo, los brotes ocurridos en el 2006-2007 en Bélgica ocasionó pérdidas por 180 millones de euros (Wilson y Mellor, 2009).
En el Perú, lengua azul ha sido detectada serológicamente en ovinos (Rosadio et al., 1984; Navarro et al., 2019) y en huanganas (Tayassu pecari) en la zona tropical (Rivera et al., 2013). Recientemente se ha detectado el segmento 7 del genoma del VLA en ovinos y en mosquitos del género Culicoides insignis en Pucallpa, Ucayali (Navarro et al., 2018, 2019). El Perú es considerado uno de los países más vulnerables a los efectos del cambio climático (MINAM, 2016), condición que podría favorecer la migración de los mosquitos transmisores del virus a zonas de mayores altitudes donde se crían ovinos y otros animales.
El objetivo del presente estudio fue detectar anticuerpos contra el virus de lengua azul en ovinos de raza Junín (doble propósito) de una empresa ovejera criados a 3800 msnm en la provincia de Jauja, Junín y en ovinos de raza Blackbelly criados a 600 msnm en la provincia de Chanchamayo, Junín, en un contexto de vigilancia epidemiológica de la enfermedad de lengua azul.
MATERIALES Y MÉTODOS
Lugar del Estudio
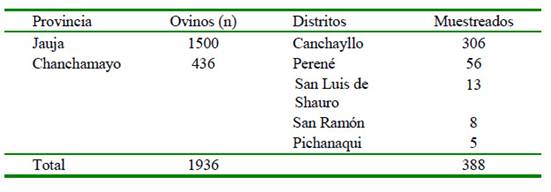
La obtención de las muestras sanguíneas de los ovinos se realizó en abril y mayo de 2017. Se colectaron 306 muestras de ovinos de raza Junín, mayores a 4 meses, machos y hembras, de una de las unidades de producción de una empresa ovejera localizada en el distrito de Canchayllo, provincia de Jauja, Junín, a una altitud de 3800 msnm. Además, fueron colectadas 82 muestras de ovinos de raza Blackbelly, de 4 meses a 8 años, machos y hembras, de pequeños criadores de cuatro distritos de la provincia de Chanchamayo, Junín, a 600 msnm (Cuadro 1). Las muestras de sangre fueron obtenidas por punción de la vena cefálica o yugular utilizando tubos al vacío sin anticoagulante, centrifugado a 800 g por 10 minutos y los sueros resultantes fueron conservados a -20 °C hasta su procesamiento.
Tamaño de Muestra
El tamaño de muestra fue obtenido considerando una prevalencia referencial del 50% al no existir datos previos en ovinos con intervalo de confianza de 95% y un porcentaje de error del 5%, según la fórmula descrita para poblaciones infinitas (Daniel, 1996) (Cuadro 1). El tamaño de muestra de los ovinos de la provincia de Chanchamayo (n=205) no fue completado debido a dificultades logísticas.
Anticuerpos contra VLA
La detección de anticuerpos contra el virus de Lengua azul fue realizada mediante la prueba de ELISA competitiva (Bluetongue VirusAntibody Test Kit cELISAv2) (VMRD, USA) siguiendo las especificaciones del fabricante. Las muestras fueron consideradas positivas si el porcentaje de inhibición fue igual o mayor a 60%, y negativas si fue menor al 60%. La presencia anticuerpos contra el virus de lengua azul fue estimada mediante la fórmula de Ahlbom y Norell (1990).
RESULTADOS
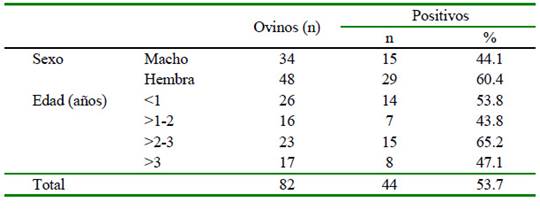
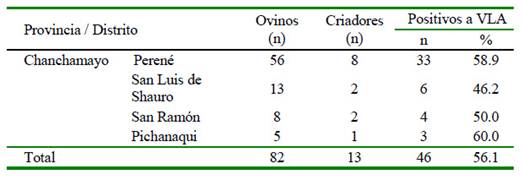
Todas las muestras de suero de los ovinos de raza Junín resultaron negativas a anticuerpos contra el VLA, mientras que 56.1% de las muestras de los ovinos Blackbelly tuvieron anticuerpos contra el virus (Cuadro 2). La seropositividad según sexo y edad de los animales se presenta en el Cuadro 3.
Cuadro 2 Detección de anticuerpos contra el virus de lengua azul (VLA) en ovinos Blackbelly de la provincia de Chanchamayo, Junín, mediante la prueba de ELISA de competición
DISCUSIÓN
La seronegatividad al VLA de los ovinos de raza Junín indica que no fueron expuestos al virus. Posiblemente la altitud y temperatura constituyen barreras para la incursión de los mosquitos transmisores del VLA desde el trópico. Existen más de 1500 especies del género Culicoides, pero aproximadamente 30 especies son consideradas competentes para transmitir el virus (Purse et al., 2005). Son escasas las informaciones sobre seropositividad al VLA en ovino y otras especies de animales criados en la zona andina. Se tiene el estudio de Rivera et al. (1987), quienes reportaron 21% de seropositividad al VLA en alpacas de Puno, utilizando la prueba de inmunodifusión que detecta anticuerpos no solo contra el VLA, sino también contra el virus de Enfermedad Hemorrágica Epizoótica.
Estudios realizados en ovinos y yaks de la meseta del Tibet, donde el clima es frío y con bajo porcentaje de oxígeno, indicó que 17.3% de los ovinos y 13.3% de los yaks tuvieron anticuerpos específicos contra el VLA. Según los autores, Culicoides spp, vector de esta enfermedad, tiene una dinámica estacional en la zona, siendo más activos en la época cálida (Ma et al., 2017). Esta situación podría darse también en el Perú ante el cambio climático, ya que los Andes limitan por el flanco oriental con las zonas subtropicales que poseen las condiciones favorables para la existencia de los mosquitos hematófagos (UNESCO, 2009).
El 56.1% (46/82) de las muestras de los ovinos Blackbelly tuvieron anticuerpos contra el VLA. Los anticuerpos detectados evidencian la exposición al virus por la picadura del mosquito transmisor, más no enfermedad clínica, indicando que esta infección es enzoótica en el trópico y subtrópico con condiciones ecológicas que caracterizan al ámbito geográfico comprendido entre 40° N y 35° S y donde parte de los EEUU, América Central y parte de América del Sur están comprendidos (Purse et al., 2005). La seropositividad detectada en el presente estudio fue similar al resultado obtenido por Navarro et al. (2019) de 50% (23/46) en ovinos de pelo clínicamente sanos en Pucallpa, Ucayali; departamento de la región tropical del país con factores favorables para la vida de los Culicoides spp y, por tanto, con una continua exposición de los animales al virus, comolo refiereNoamanyArzani (2017).En un estudio en huanganas (Tayassu pecari) de la zona de Madre de Dios, solo el 7.5% de los animales muestreados tuvieron anticuerpos específicos al VLA de la zona de Madre de Dios, solo el 7.5% de los animales muestreados tuvieron anticuerpos específicos al VLA (Rivera et al., 2013). Purse et al. (2015) mencionan que los Culicoides spp muestran preferencias por ciertas especies de vertebra-dos para alimentarse, de allí que la baja sero-positividad al VLA detectada en las huan-ganas podría deberse a la escasa preferencia de los vectores por esta especie animal.
Los estudios que se han realizados en ovinos, caprinos y bovinos en varios países de América Latina indican exposición al virus más no enfermedad clínica. Así, en Brasil encontraron frecuencias de animales seropositivos entre 0.4 y >50% (Souza et al., 2010), en ovinos de la provincia de Corrientes, Argentina, hubo una seroconversión del 95% (Clavijo et al., 2012; Legisa et al., 2013) y en bovinos clínicamente sanos del Ecuador y en algunas áreas de Venezuela se ha detectado seroprevalencias de 98.9 y 94.7%, respectivamente (Verdezoto et al., 2018).
En América Latina se han reportado la enfermedad clínica de lengua azul en dos cérvidos (Mazama gouazoubira) y en un venado (Blastocerus dichotomus) en dos zoológicos de Rio de Janeiro, y en ocho ovinos y una cabra en el estado de Paran; asimismo, en 2017 hubo severos brotes en ovinos del Estado de Rio Grande do Sul, Brasil, causado por el serotipo 17 (Bianchi et al., 2017). Los países donde se ha logrado aislar al VLA son Brasil y Argentina (Lager, 2004). En Ecuador se han reportado los serotipos 9, 13 y 18 del VLA mediante pruebas moleculares (Verdezoto et al., 2018), mientras que en Perú se ha detectado el segmento 7 del genoma del VLA en muestras sanguíneas de ovinos seropositivos y en un pool de Culicoides insignis identificados previamente (Navarro et al., 2018) y capturados en las cercanías al corral de las ovejas seropositivas al VLA (Navarro et al., 2019).
Recientes estudios en ovinos en el Perú indican que el VLA está presente en animales domésticos y silvestres del trópico, pero sin la ocurrencia de enfermedad clínica. Sin embargo, se considera importante realizar un muestreo en las unidades de producción de ovinos y otros rumiantes criados en diferentes altitudes a nivel nacional como una línea de base de información epidemiológica del VLA, enfermedad considerada como emergente, ante la posibilidad de migración de los mosquitos transmisores fuera de su ámbito geográfico (Brugger y Rubel, 2013; Guichard et al., 2014), y más aún cuando la mayor población de ovinos, bovinos y camélidos sudamericanos en el Perú son criados en valles y zonas altoandinas.












 uBio
uBio