INTRODUCCIÓN
El Rabdomiosarcoma (RMS) es una neoplasia maligna que pertenece a un grupo de sarcomas de tejidos blandos. Estos incluyen un conjunto de neoplasias que comparten algunas características comunes como: el origen mesenquimal, alta capacidad de invasión yexpansión local, potencial metastásico moderado y alta recurrencia pos-operatoria (Caserto, 2013). El RMS puede desarrollarse en cualquier parte del cuerpo, incluso en lugares donde el músculo esquelético estriado no está presente como faringe, vejiga urinaria, útero y cérvix (Russell et al., 2015).
El RMS se clasifica histológicamente en alveolar, pleomórfico y embrionario. Un subtipo de RMS embrionario es el botrioide (Enzinger y Weiss, 2008). Los fibrosarcomas, leiomiosarcomas y rabdomiosarcomas tienen un potencial metastásico medio a alto (Gómez-Laguna et al., 2012). El RMS es una neoplasia poco frecuente en animales de compañía, siendo los pacientes menores de dos años los más afectados. Las ubicaciones más frecuentes son la zona urogenital y visceral (49%), así como la cabeza, cuello o cara (37%) (Caserto, 2013). También se ha reportado en canes una pequeña proporción en localizaciones cardiacas como aurículas, paredes ventriculares y septo interventricular (Machida et al., 2003; Akkoç et al., 2006; Gómez-Laguna et al., 2012).
Para el diagnóstico se requiere un examen físico sistemático complementado con pruebas por imágenes como radiografías, ecocardiografías o tomografía computarizada (Scollan et al., 2015). Sin embargo, las sensibilidades de estas pruebas son bastante bajas para tumores cardiacos y pericárdicos, por lo que su importancia se relacionaría más a la detección de metástasis pulmonares y lesiones extra cardiacas (MacDonald et al., 2009; Côté et al., 2013). El diagnóstico definitivo del RMS se realiza mediante un estudio histopatológico, además de las técnicas de histoquímica, microscopía electrónica y análisis inmunohistoquímico (Kobayashi et al., 2004).
Es difícil determinar con precisión el pronóstico del RMS debido a la escasez de casos clínicos, falta de seguimiento y datos de supervivencia, así como la frecuencia de metástasis. No obstante, se debe tener presente que el pronóstico puede ser reservado en la mayoría de los casos (Caserto, 2013). El mayor éxito del tratamiento dependerá del diagnóstico temprano, de la buena delimitación del tumor y que no existan metástasis distantes; aunque hay evidencias que siempre existen micro metástasis al momento de realizado el diagnóstico (Orton, 2013).
CASO CLÍNICO
Evaluación y Hallazgos Clínicos
Se presentó para consulta en la Clínica de Animales Menores de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima, Perú, un canino Schnauzer macho de 9 años, no castrado y con historia de inapetencia, letargia e intolerancia al ejercicio. Se realizó un estudio completo físico-clínico registrándose condición corporal 2/5, grado de deshidratación de 5%, mucosas pálidas y marcada disnea con posición de ortopnea. Los sonidos cardiacos se encontraban levemente audibles a la auscultación, además de un pulso femoral disminuido. En base a los hallazgos clínicos, se planteó un cuadro compatible con efusión pericárdica con taponamiento cardiaco.
Pericardiocentesis
Se realizó una ecocardiografía, identificándose acumulación moderada de líquido de característica anecoica entre el saco pericárdico y las paredes auriculo-ventriculares. Al realizar la medida en modo M, hubo disminución del diámetro de pared libre del miocardio con movimientos descompasados por falta de espacio para la dilatación de las cámaras. Bajo estas condiciones y con relación al estado clínico del paciente, se confirmó el diagnóstico de taponamiento cardiaco.
Se realizó una pericardiocentesis para brindar estabilidad hemodinámica y ayudar a determinar la causa de la efusión. Se realizó la pericardiocentesis guiada por ecocardiografía en el quinto espacio intercostal derecho al nivel de la unión costo condral. Se utilizó un catéter de diámetro 18G al cual se adiciono una llave de tres vías. Luego de la punción se colectó 300 ml de líquido serosanguinolento turbio rojizo que no coagulaba. Seguidamente, se realizó una nueva ecocardiografía lográndose identificar una masa nodular ecogénica relacionada al pericardio y base del esternón en hemitórax derecho (Figura 1). Se evidenció una moderada cantidad de efusión pleural, la cual fue drenada mediante toracocentesis.
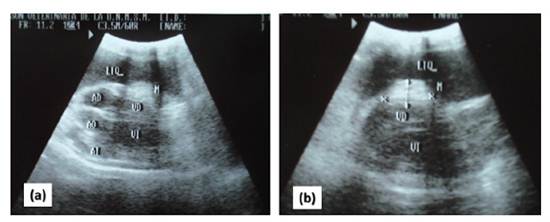
Figura 1 Ecocardiografía de un canino Schnauzer de 9 años posterior a la pericardiocentesis: (a) en eje largo y (b) eje corto. (M): Masa nodular ecogénica relacionada a pericardio; (VD): Ventrículo derecho; (LIQ): Efusión pleural
En las muestras colectadas (toracocentesis y pericardiocentesis), se realizaron estudios citológicos y bacteriológicos. El cultivo bacteriológico resultó negativo y los resultados del estudio citológico fueron compatibles con exudado serosanguinolento, sin evidencias de células neoplásicas.
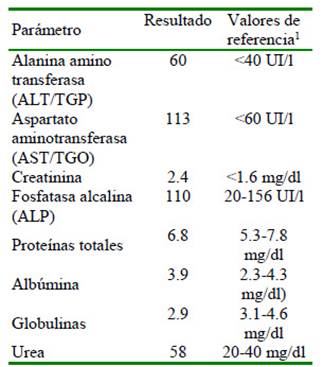
Se tomaron muestras para análisis hematológico, bioquímica sanguínea completa y de orina. No se encontraron alteraciones en células rojas ni en células blancas. El número de plaquetas estaban en el límite inferior del valor de referencia. En la bioquímica sanguínea se encontró un leve incremento de la urea y la creatinina. En el uroanálisis se encontró proteinuria (100 mg/dl), lo que indicaba signos de insuficiencia renal aguda. Los valores de alanina aminotransferasa estaban elevados, las proteínas totales se encontraron alteradas con la albumina en valores normales y las globulinas disminuidas (Cuadro 1).
Pericardiectomía Parcial Subfrénica
La cirugía tuvo por finalidad brindar al paciente una mejora clínica sostenida al controlar la causa de la efusión pericárdica, además de realizar el diagnóstico definitivo mediante el estudio histopatológico. Como manejo preanestésico se administró acepromacina maleato 0.05 mg/kg combinado con morfina 0.5 mg/kg por vía i.m. y cefalotina 25 mg/kg por vía i.v. como profilaxis antibiótica. La inducción se realizó con la combinación de midazolan 0.25 mg/kg y propofol a 2 mg/kg vía i.v. Al obtenerse la inconciencia, el paciente fue intubado y se le mantuvo el plano anestésico con isofluorano en oxígeno al 100% y con un circuito de no reinhalación. Se realizó ventilación asistida durante todo el proceso quirúrgico.
El paciente fue colocado en decúbito lateral izquierdo. El campo quirúrgico fue preparado de manera protocolar en asepsia y antisepsia. Se realizó un bloqueo anestésico paravertebral e intercostal con lidocaína al 2% entre los espacios intercostales 3 al 7. La cirugía se inició con una incisión sobre la piel a nivel del 5° espacio intercostal y se diseccionó los planos subcutáneos y musculares. Para ingresar a la cavidad torácica se realizó una inciso punción en los músculos intercostalesyla pleuraparietal.Acontinuación, se abrió el espacio intercostal usando un separador autoestático de Finochietto.
En la exploración de la cavidad torácica se identificó escasa cantidad de líquido libre serosanguinolento y signos de hepatización pulmonar difusa. No se observaron signos de metástasis en órganos torácicos. El saco pericárdico estaba engrosado, encontrándose una masa no encapsulada de tipo neoplásica rojo pálido en la cara derecha del pericardio y con relación al ápice cardiaco. Se realizó la pericardiectomía mediante una incisión en forma de T a lo largo de la base cardiaca, previa localización del nervio frénico derecho, que sirvió como límite superior para la exéresis del pericardio. Esta maniobra permitió extraer la totalidad de la masa pericárdica (Figura 2).
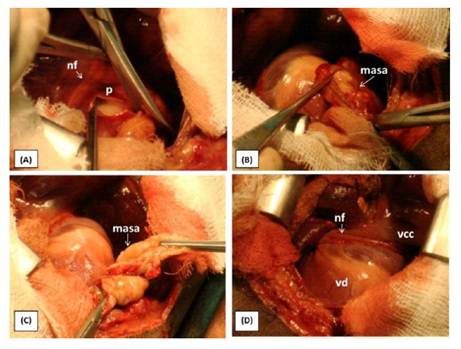
Figura 2 Toracotomía lateral derecha en un canino Schnauzer de 9 años. (A): Inicio de la pericardiectomíaparcial subfrénica;(B)y(C):Pericardiectomía yextraccióndemasa; (D): Pericardiectomía parcial subfrénica realizada. (nf): Nervio frénico; (vcc):Vena cava craneal; (vd) Ventrículo derecho
Se realizó la síntesis de la pared torácica, los planos musculares y piel. El paciente ingresó a cuidado pos-operatorio en internamiento. Se colocó un tubo de tórax para recuperar la negatividad intratorácica y sirvió de vía de administración de lidocaína 2% para brindar analgesia local. El manejo pos-quirúrgico se realizó con morfina 0.5 mg/kg c/8 h por vía i.v. y meloxican 0.2 mg/kg c/24 h por vía i.m. El paciente fue dado de alta 72 horas después de la intervención para el manejo ambulatorio.
Histopatología
El diagnóstico histopatológico de las piezas operatorias extraídas, y teñidas con hematoxilina y eosina fue de rabdomiosarcoma de pericardio de tipo pleomórfico (Figura 3). La técnica histoquímica de tricrómico de Masson apoyó el diagnostico histopatológico.
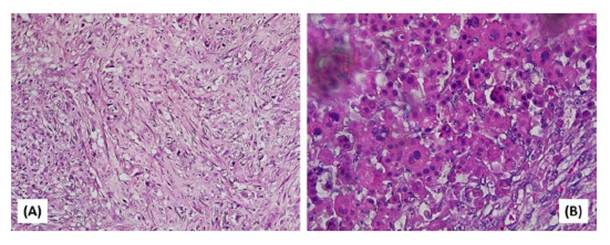
Figura 3 Rabdomiosarcoma (RMS) pericárdico pleomórfico en un canino Schnauzer de 9 años. (A). Las células neoplásicas son fusiformes/pleomórficas en un entornomixoide(H&E,100x).(B)Célulasredondas concitoplasmaeosinófilo. Se ven células gigantes multinucleadas con núcleos muy bizarros, atípicos y citoplasmas intensamente eosinófilos. Una población altamente pleomórfica con estroma mínimo, y alta actividad mitótica (H&E, 400X)
Evolución
Se realizó un seguimiento tanto clínico como por imágenes (radiografías y ecocardiografía) a las 2, 4 y 8 semanas sin alteraciones distinguibles. El paciente presentó disfunción respiratoria a las 10 semanas de la cirugía. Se realizaron estudios radiográficos y ecocardiográficos que resultaron compatibles con efusión pleural y neoplasias pulmonares. Dada la alta sospecha de metástasis del RMS pericárdico, los propietarios decidieron realizar la eutanasia al paciente, no autorizando realizar una necropsia.
DISCUSIÓN
El pericardio presenta una baja frecuencia de neoplasias. La mayoría de los reportes médicos indican que las neoplasias cardiacas y del pericardio suelen ser asintomáticas por largos periodos (Orton, 2013; Fiorini et al., 2017). Con el crecimiento de la masa tumoral y su ubicación (grandes vasos, cámaras cardiacas o pericardio) es frecuente que generen efusión pericárdica. Estas condiciones desencadenan alteraciones hemodinámicas graves, pudiendo llevar a muerte súbita.
En el presente caso, la acumulación anormal de líquido en el saco pericárdico incrementó la presión intrapericárdica. Esta condición superó la presión en el atrio derecho, disminuyendo su llenado y causando falla en la función cardiaca, para llegar a producir un taponamiento cardiaco (Stafford et al., 2004; Parra et al., 2009). Este evento produjo una insuficiencia cardiaca, reduciendo la precarga y el gasto cardiaco. La decisión inicial para el tratamiento de la efusión pericárdica y taponamiento cardiaco fue la pericardiocentesis con el fin de disminuir la presión intrapericárdica y restablecer la hemodinámica del sistema cardiovascular En el paciente, el volumen drenado fue 10 veces la capacidad máxima del saco pericárdico. Esta condición correspondería a una efusión pericárdica de tipo crónica, debido principalmente a la acumulación sostenida en el tiempo del fluido producido por el tumor pericárdico (Stafford et al., 2004).
El acercamiento al diagnóstico del RMS se logró mediante el uso de la ecocardiografía 2D. En el presente caso permitió identificar la masa de tipo neoplásica, así como su ubicación en el pericardio; herramienta de gran utilidad para identificar alteraciones o neoplasias en pericardio y miocardio (MacDonald et al., 2009; Karlin et al., 2018). Así mismo, debido a su afinidad de los ecos por los materiales líquidos, la ecocardiografía es la herramienta más adecuada para diagnosticar derrames pleurales y abomínales que puedan presentarse a la vez en los pacientes.
La recomendación quirúrgica para una neoplasia pericárdica es la exéresis quirúrgica del tumor, ya sea una pericardiectomía completa si la masa está muy diseminada (al mediastino) o pericardiectomía subfrénica en casos de masas circunscritas al corazón (Karlin et al., 2018). En el presente caso, la pericardiectomía fue un procedimiento paliativo que tuvo por objetivo evitar una futura acumulación de líquido en el saco pericárdico y el taponamiento cardiaco (Parra et al., 2009).Además, sirvió como herramienta para obtener el diagnóstico definitivo mediante el estudio histopatológico de la pieza extraída (Kerstetter et al., 1997; Stafford et al., 2004).
El paciente desarrolló una mediana sobrevida pos-quirúrgica (10 semanas), explicada por el mal pronóstico de los sarcomas cardiacos y pericárdicos. Estos tumores, como la mayoría de los tumores cardiacos, generalmente no presentan una sintomatología específica, lo cual impide realizar un diagnóstico temprano en el paciente. En el humano, la clasificación histológica del RMS contribuye a plantear el pronóstico de la neoplasia, siendo el RMS alveolar y pleomórfico de pronóstico no favorable, el RMS embrionario de pronóstico intermedio y los RMS embrionarios subtipo botrioides de pronóstico más favorable (Caserto, 2013).
Una alternativa para brindar un mayor tiempo de sobrevida al paciente pudo ofrecerse con quimioterapia. Se han informado tratamientos médicos exitosos (quimioterapia y radioterapia) en perros y humanos a pesar del mal pronóstico de este tumor (Papoo et al., 1997; Russell et al., 2015). Sin embargo, debido al número limitado de casos informados y la falta de estudios aleatorizados, no existen pautas estandarizadas con respecto al papel de la quimioterapia adyuvante en el RMS.
CONCLUSIONES
Se diagnosticó un rabdomiosarcoma pericárdico pleomórfico en un Schnauzer de 9 años, sin evidencia de metástasis en órganos torácicos y abdominales.
La pericardiectomía sirvió de tratamiento paliativo a la efusión pericárdica, además de contribuir al diagnóstico definitivo del rabdomiosarcoma mediante el estudio histopatológico e histoquímico de la neoplasia.












 uBio
uBio