INTRODUCCIÓN
El acrosoma es una organela presente en la zona apical de la cabeza del espermatozoide que juega un papel fundamental en la fecundación. La reacción acrosomal permite el ingreso del espermatozoide al espacio perivitelino del ovocito mediante la fase de penetración de la zona pelúcida, permitiendo la posterior recombinación genética de ambos gametos y formación del embrión (Januskauskas et al., 2000). Ickowicz (2012) demostró que la reacción acrosomal es producida por una serie de cambios bioquímicos y fisiológicos como la elevación de calcio, la fosfoliración de la PI K, la hidrolización de PIP , la despolarización de la F-actina y finalmente la rección acrosómica. Las muestras seminales que presentan un gran porcentaje de espermatozoides con daño acrosomal tienen generalmente una fertilidad baja (Peña y Linde-Forsberg, 2000). Por ello, la capacidad fecundante de las muestras espermáticas puede estimarse a través de la evaluación de la integridad acrosomal y viabilidad.
La técnica de citometría de flujo ha ofrecido una mayor precisión al evaluar la calidad espermática (Hallap et al., 2005), debido a que permite evaluar un gran número de espermatozoides por muestra en un tiempo menor en comparación a otros métodos, además de analizar varios parámetros en un mismo espermatozoide (Graham et al., 1990). Utilizando la citometría de flujo se ha reportado la evaluación de viabilidad e integridad acrosomal como parámetro en especies tales como el ovino (Hernández et al., 2012a), equino (Hernández et al., 2012b), bovino (Januskauskas et al., 2000), además de espermatozoides de alpaca (Cheuquemán et al., 2013; Santiani et al., 2016; Ugarelli et al., 2017).
En la alpaca se reporta que la integridad acrosomal en espermatozoides frescos varía alrededor del 90%. Por otro lado, recientemente se ha demostrado que el proceso de criopreservación induce la pérdida de viabilidad espermática (Juárez y Santiani, 2019) y del potencial de membrana mitocondrial (Allauca et al., 2019); sin embargo, no existe información de la integridad acrosomal en los espermatozoides de alpaca que sobreviven al proceso de criopreser-vación. Por lo tanto, el objetivo de este estudio fue evaluar el efecto de la criopreservación sobre la integridad acrosomal de los espermatozoides viables de alpaca.
MATERIALES Y MÉTODOS
Lugar y Muestras
Se emplearon 52 testículos/epidídimos provenientes del camal municipal de Ninacaca, Pasco (Perú), los cuales fueron enviados al Laboratorio de Reproducción Animal de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima, para su procesamiento. En el laboratorio se seleccionaron 46 epidídimos de testículos con peso mayor o igual a 10 g, longitud testicular mayor o igual a 3 cm, concentración espermática mayor o igual a 50 x 106 espermatozoides/ml (recuento realizado mediante cámara de Neubauer) y motilidad mayor o igual a 30% (evaluada en forma subjetiva mediante microscopía). Seis testículos/ epidídimos fueron descartados por no cumplir con los criterios de inclusión.
Recuperación de Espermatozoides
Inmediatamente después del beneficio se colectaron ambos testículos y se colocaron en bolsas herméticas con NaCl 0.9% dentro de cajas de transporte a 4 ºC para ser trasladados a Lima en las próximas 20 horas. En el laboratorio, se realizó el lavado y separación de la cola del epidídimo, la cual fue lavada con PBS temperado (38 ºC) y colocada en una placa Petri. Se le adicionó 1.5 ml del dilutor a base de leche descremada, yema de huevo y fructosa, de acuerdo con lo descrito por Santiani et al. (2005). Posteriormente, con una hoja de bisturí se realizaron cortes seriados sobre la superficie de la cola para la recuperación de los espermatozoides.
Se utilizó 10 µl de la suspensión para la evaluación de la motilidad espermática y 10 µl para la evaluación de la concentración espermática. Así mismo, se separaron dos alícuotas de 500 µl, una para la evaluación en fresco y la otra luego del congelamiento.
Criopreservación y Descongelamiento
Las muestras diluidas fueron envasadas en pajillas de plástico de 0.25 ml y congeladas utilizando el programa #7 del sistema automático de congelamiento (Freeze Control(r), Cryologic, Australia). Brevemente, se inició con 18 ºC, descendiendo la temperatura hasta 5 °C en un periodo de 90 min, cuando se realizó una meseta de 5 ºC por 30 min, y finalmente se sumergieron en nitrógeno líquido (-196 °C), donde permanecieron hasta su evaluación.
La descongelación de las pajillas se realizó en baño maría (38 ºC) por 1 min (Morton et al., 2007). La viabilidad e integridad acrosomal se evaluaron en todas las muestras mediante citometría de flujo, antes y después del proceso de criopreservación. Del mismo modo, se evaluó la motilidad mediante microscopía (400x).
Viabilidad e Integridad Acrosomal
Para la evaluación espermática se empleó el fluorocromo ioduro de propidio (PI, L7011, Molecular-Probes) como indicador de espermatozoides no viables y el fluorocromo isotiocianato de fluoresceina conjugado con Pisum sativum (FITC-PSA, L0770, SigmaAldrich), como indicador de daño acrosomal. Antes de la incubación con estos fluorocromos, se retiró el dilutor de las muestras mediante dos lavados por centrifugación con 1 ml de PBS (600 G durante 8 min). Luego, los pellets obtenidos fueron resuspendidos con 100 µl de PBS a 38 °C. Posteriormente, a 100 µl de cada muestra se le agregó 2.5 µl de FITC-PSA (100 µg/ml) y 0.5 µl de PI (2.4 mM). Se incubaron las muestras a 38 ºC en oscuridad por 10 min.
Citometría de Flujo
Las muestras fueron evaluadas utilizando un citómetro de flujo con analizador de imágenes FlowSight (Amnis, Seattle, WA, USA) adquiriendo 10 000 eventos compatibles con espermatozoides mediante el programa INSPIRE v. 100.3.218.0 (Amnis, Seattle, WA, USA). Para la identificación de la población de espermatozoides se consideró el tamaño y la proporción largo/ancho de cada evento. Un láser de 488 nm con una potencia de 20 mW fue utilizado para excitar a FITC-PSA y PI. La fluorescencia emitida por FITC-PSA fue detectada en el canal 2 (Ch02: 505-560 nm) y la fluorescencia emitida por PI fue detectada en el canal 5 (Ch05: 642-740 nm). Se utilizó el software de análisis de datos IDEAS v. 6.2 (Amnis, Seattle, WA, USA) el cual permitió utilizar histogramas para PI y FITC-PSA.
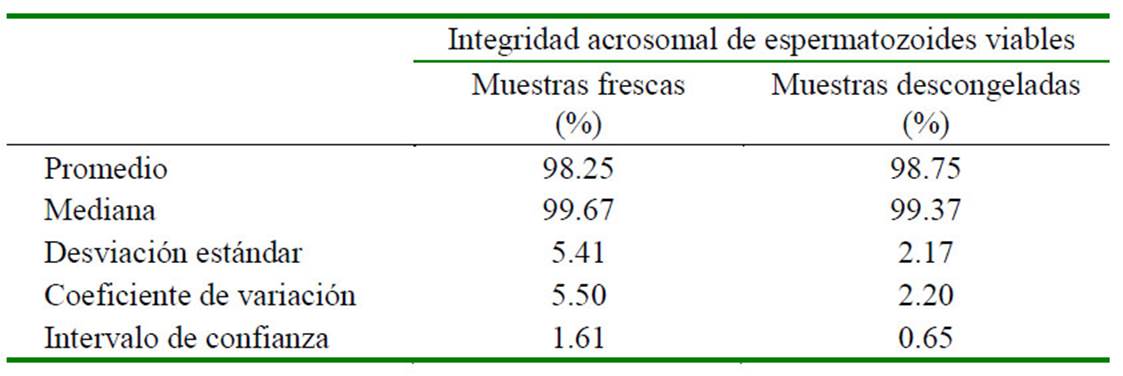
Cuadro 1 Espermatozoides epididimarios de alpacas, frescos y descongelados, analizados con los fluorocromos FITC-PSA y PI para evaluar integridad acrosomal de los espermatozoides viables (n=46 muestras)
Se consideraron espermatozoides vivos a aquellos que presentaron baja intensidad de fluorescencia en el canal 5 (PI), tal como se observa en la Figura 1 a. Luego, considerando únicamente a los espermatozoides viables, se realizó un histograma para detectar la intensidad de fluorescencia en canal 2 (FITCPSA). Se consideraron espermatozoides vivos con integridad acrosomal a los que no mostraron fluorescencia en el canal 2 (FITCPSA), tal como se observa en la Figura 1b.

Figura 1 Histogramas para seleccionar las poblaciones de espermatozoides viables (a) y de espermatozoides con acrosoma intacto (b). (a) Intensidad de fluorescencia en canal 5 (PI). La población de la izquierda tiene baja intensidad de fluorescencia en canal 5, considerándose espermatozoides viables; (b) Intensidad de fluorescencia en canal 2 (FITC-PSA). Se observa que la mayoría de los espermatozoides viables tienen baja intensidad de fluorescencia en canal 2, considerándose espermatozoides viables con acrosoma intacto
Análisis Estadístico
Los parámetros de integridad acrosomal en espermatozoides viables y de motilidad fueron evaluados mediante el test de Kolmogorov-Smirnov (K-S) para determinar si siguen la distribución normal. Para evaluar el efecto de la criopreservación sobre el porcentaje de integridad acrosomal en espermatozoides viables se utilizó la prueba de rangos y signos de Wilcoxon; mientras que para evaluar el efecto de la criopreservación sobre la motilidad se utilizó la prueba de tstudent pareada. Se empleó el paquete estadístico SPSS Statistics 22.0.
RESULTADOS
Se obtuvo una viabilidad en espermatozoides frescos de 75 y de 42% en espermatozoides congelados/descongelados. Los valores de la integridad acrosomal de los espermatozoides viables de las muestras frescas y congeladas/descongeladas se presentan en el Cuadro 1. La integridad acrosomal de las muestras frescas fue de 98.25 ± 5.40%, mientras que en las muestras congeladas/descongeladas fue de 98.75 ± 2.17%.
El efecto de la criopreservación sobre la integridad acrosomal de los espermatozoides viables no presentó diferencias significativas. Los resultados muestran valores similares de integridad acrosomal entre las muestras de espermatozoides frescos (98.25 ± 5.41%) y las muestras de espermatozoides descongelados (98.75 ± 2.17%) (Cuadro 2). Ejemplos de espermatozoides vivos con acrosoma intacto y espermatozoides muertos con reacción acrosomal se muestran en la Figura 2. Por otro lado, se observa que la motilidad disminuyó significativamente (p<0.05) por efecto de la criopreservación (46.63 ± 7.68% en muestras frescas vs. 23.74 ± 6.24% en muestras congeladas/descongeladas).
Cuadro 2 Evaluación de la integridad acrosomal de espermatozoides viables y de la motilidad en espermatozoides epididimarios de alpaca frescos y congelados/descongelados

a,b Letras diferentes en las filas indican diferencia estadística significativa p<0.05.

Figura 2 Espermatozoides epididimarios de alpaca evaluados mediante el sistema analizador de imagen del citómetro de flujo observados en campo claro (Ch01), canal 2 (Ch02), canal 5 (Ch05) y con una imagen compuesta de los canales 1, 2 y 5 (Composite). (a) Espermatozoide viable con integridad acrosomal (FITC-PSA negativo / PI negativo). (b) Espermatozoide muerto con daño acrosomal (FITC-PSA positivo / PI positivo)
El análisis de correlación entre la motilidad espermática y la integridad acrosomal de espermatozoides viables presentó una correlación positiva débil (r = 0.1528, pero no significativa (p=0.1458).
DISCUSIÓN
Este es el primer reporte que confirma que la integridad acrosomal de los espermatozoides viables no varía significativamente durante el proceso de criopreservación de espermatozoides epididimarios de alpacas analizados mediante el citómetro de flujo, utilizando los fluorocromos ioduro de propidio y FITC-PSA. La membrana acrosomal delimita el acrosoma, protegiendo las enzimas hidrolíticas que lo conforman; de allí la importancia de que se mantenga intacta la membrana acrosomal en los espermatozoides viables.
Se esperaba encontrar valores elevados de integridad acrosomal en los espermatozoides viables en muestras espermáticas frescas de alpaca. Santiani et al. (2013, Santiani. 2016) evaluaron eyaculados de alpaca obteniendo 46 y 61% de viabilidad con integridad acrosomal, mientras que Ugarelli et al. (2017) reportaron valores de 61%. No obstante, en el presente estudio se encontraron valores superiores de integridad acrosomal (98.25%), esto posiblemente debido a que en el estudio de Santiani et al. (2013) se utilizó la técnica de doble tinción con azul de tripán y Giemsa, la cual es una técnica subjetiva. Por otro lado, el 61% de integridad acrosomal reportado por Ugarelli et al. (2017) y Santiani et al. (2016) corresponde al total de esperma-tozoides evaluados, incluyendo la población de espermatozoides muertos, mientras que en este estudio solo se incluyeron espermatozoides viables.
La calidad espermática disminuyó significativamente por el proceso de criopreservación, disminuyendo asimismo la cantidad de espermatozoides viables; sin embargo, el porcentaje de integridad acrosomal dentro del grupo de espermatozoides viables se mantuvo alrededor del 98%. En el estudio de Santiani et al. (2013) se obtuvo 33% de espermatozoides viables con integridad acrosomal; es decir, una disminución del 13% tras la criopreservación. Ccalta et al. (2017), utilizando el método de tinción de Coomasie, obtuvo 45% de integridad acrosomal en espermatozoides descongelados de alpaca, lo que indicó una disminución de 32% de la integridad acrosomal; sin embargo, en dicho estudio no se especifica si se incluyeron espermatozoides viables y muertos, ya que se evaluó a la integridad acrosomal como variable independiente.
No se disponen de reportes adicionales sobre la integridad acrosomal en los espermatozoides viables de alpaca luego del proceso de criopreservación; sin embargo, Hernández et al. (2012a, Hernández et al 2012b) evaluaron eyaculados de ovinos y equinos, respectivamente, utilizando el fluorocromo FITC-PNA y PI, encontrando que los espermatozoides descongelados presentaron 27 y 43% de viabilidad e integridad acrosomal, lo cual indicaba una disminución de 49 y 22% de espermatozoides viables de ovinos y equinos, respectivamente con integridad acrosomal. En dichos estudios, no obstante, los resultados son expresados sobre el total de espermatozoides evaluados, no permitiendo determinar si la disminución de las poblaciones de viabilidad con integridad acrosomal fue debido a la muerte de los espermatozoides o a la reacción acrosomal.
La medición de la viabilidad en conjunto con la integridad acrosomal es un parámetro que indica la capacidad fecundante de la muestra espermática, por lo que es necesario conocer el porcentaje de espermatozoides vivos que mantienen la capacidad fecundante después del proceso de criopreservación. Este estudio demuestra que la integridad acrosomal se mantiene porcentualmente dentro del grupo de espermatozoides vivos, incluso después del proceso de criopreservación.
La motilidad en las muestras frescas fue de 46.33% y en muestras congeladas/descongeladas de 23.74% (p<0.05). En trabajos similares se encontraron diferencias análogas; así Valdivia et al. (1999) reportaron 98 y 20% de motilidad en muestras frescas y congeladas/descongeladas, mientras que Santiani et al. (2005, Santiani, 2013) reportaron 72 y 53% de motilidad en muestras frescas y 20 y 22% en muestras descongeladas.
Hasta el momento se desconocen los mecanismos específicos por lo que la criopreservación disminuye la calidad espermática, sin embargo en términos generales los espermatozoides son sometidos a diferentes condiciones físicas y químicas durante el proceso de congelación y descongelación, y es por estas variaciones que valores como motilidad y viabilidad disminuyen. Sin embargo este estudio demuestra que a pesar de ello dentro del grupo de espermatozoides viables, el porcentaje de integridad acrosomal se mantiene.
CONCLUSIONES
El porcentaje de integridad acrosomal de los espermatozoides viables en muestras espermáticas obtenidas de la cola del epidídimo se mantiene luego del proceso de criopreservación.
La integridad acrosomal mantiene una correlación débil y no significativa con la motilidad (r = 0.1528; p=0.1458)












 uBio
uBio 

