INTRODUCCIÓN
El desarrollo de nuevas biotecnologías para la obtención de líneas animales genéti- camente superiores se basa en las técnicas de fecundación in vitro y cultivo de embrio- nes. La producción de embriones in vitro es una herramienta valiosa para el desarrollo de la biotecnología, y los sistemas de co-cultivo son un complemento de esta tecnología, que se fundamenta en los procesos fisiológicos del desarrollo embrionario temprano que acon- tecen en los animales in vivo (Peláez, 2011).
La producción de embriones in vitro comprende tres pasos: la maduración de ovocitos in vitro obtenidos de la aspiración de folículos ováricos, la fecundación in vitro con gametos masculinos y, finalmente, el cul- tivo in vitro de embriones (Urrego et al., 2008). Cada uno de estos pasos involucran una serie de procesos fisiológicos relaciona- dos entre sí, donde juega un papel importante la interacción que existe entre el óvulo y las células del cumulus oophurus (CCs) (Ferré y Cattaneo, 2013), para lograr la mayor tasa de ovocitos fertilizados y embriones viables. Los parámetros que miden la eficacia de la producción de embriones in vitro son la can- tidad y calidad de los blastocistos que se lo- gran (Ahuja et al., 2009).
La tasa de producción de embriones in vitro no ha variado en muchos años y la cali- dad de estos embriones continúa siendo infe- rior a la de los producidos in vivo, por dife- rencias morfológicas, funcionales y metabólicas, por alteraciones en expresión génica y por una mayor incidencia de apoptosis o muerte celular (Hirayama et al., 2014; Valleh et al., 2014). Para mejorar la calidad de los embriones se debe imitar las condiciones de un sistema in vivo, utilizando células que provengan de órganos donde na- turalmente suceden estos eventos in vivo (Rexroad y Powell, 1988). El cumulus oophurus es un grupo de células que rodean al ovocito dentro del folículo ovárico y des- pués de la ovulación, y son responsables de desarrollo de competencia y maduración (Marei et al., 2012). Un sistema de co-cultivo con células del cumulus es capaz de me- jorar el medio de cultivo in vitro, permitiendo lograr estadios embrionarios avanzados como mórulas y blastocistos (Lorenzini, 1997).
Por ello, con el fin de mejorar los paráme- tros actuales de cantidad y calidad de em- briones, el estudio tuvo como propósito de- terminar la influencia de un sistema de co- cultivo con células del cumulus oophurus sobre la tasa y viabilidad de embriones bovi- nos producidos in vitro.
MATERIALES Y MÉTODOS
Todos los medios y reactivos utilizados fueron adquiridos de Sigma-Aldrich (St. Louis, USA), a menos que se especifique lo contrario.
Ubicación del Estudio
El estudio se llevó a cabo en el Labora- torio de Biotecnología Animal, Reproducción y Mejoramiento Genético de la Universidad Nacional Toribio Rodríguez de Mendoza de Amazonas, Perú. Los ovarios fueron colec- tados de hembras bovinas cruzadas (Bos taurus) sacrificadas en el Centro de Benefi- cio Municipal de Chachapoyas, región Ama- zonas, Perú, a una altitud de 2341 msnm.
Aspiración y Selección de Células del Cumulus (CC)
Los ovarios con presencia de cuerpo lúteo, cuerpo hemorrágico y presencia de fo- lículo dominante fueron transportados al labo- ratorio en un recipiente isotérmico con solu- ción salina de cloruro de sodio al 0.9% y 0.0625 mg/ml de estreptomicina, temperado a 38 °C. Luego de un lavado en solución NaCl 0.9%, se aspiraron los folículos de 2-6 mm de diámetro (Raghu et al., 2002), con una aguja 18G 11/2" y jeringa de 10 ml cargada con medio PBS-PVA (8 g de KCl, 0.2 g de NaCl, 2.9 g de Na HPO , 0.2 g de KH2 PO4, 1 g de PVA en 1 L de agua) suplementado con 0.01 mg/ml de gentamicina. La búsque- da y selección de los COCs se realizó en estereoscopio (Olympus, Japón) con el mis- mo medio de aspiración y temperado a 37 °C. Se seleccionaron COCs con ovocitos de más de cuatro capas de células del cúmulus y cito- plasma homogéneo (Categoría A), y con una a tres capas de células del cúmulus y cito- plasma homogéneo (categoría B) (Senatore et al., 2010).
Aislamiento y Cultivo de COCs
Las células del cumulus oophurus (CC) se obtuvieron al momento de la aspira- ción folicular, ya que estas se desprenden de los COC. Estas células fueron aisladas y cul- tivadas en una placa de 60 mm, dentro de gotas de 100 µl del medio de cultivo que con- tenían medio SOF base modificado (0.6294 g de NaCl, 0.0534 g de KCl, 0.0162 g de KH PO , 0.2106 g de NaHCO , 0.018 g de CaCl 2H O, 0.00996 g de MgCl2 6H O2, 3.3 g de Na-piruvato, 47 µl de Na-Lactato, 0.0146 g de L-glutamina, 0.0080 g de kanamicina, 0.0002 g de rojo fenol, 0.3 g de BSA y 100 ml de agua), suplementado con 1X de aminoácidos esenciales, 1X de aminoácidos no esenciales y 0.04 mg/ml de mioinositol. Las gotas se cubrieron de aceite mineral y se incubaron en atmosfera humidificada a 38.5 °C y con 6% de CO durante 42 horas (Kubo et al., 2015).
Maduración in vitro
Se obtuvieron 800 COCs, que fueron sometidos a maduración en medio TCM-199 suplementado con 0.5 mg/ml de piruvato de sodio, 12 µg/ml de EGF (Factor de Crecimien- to Epidermal), 0.05 UI/ml de FSH (Hormona Folículo Estimulante), 0.05 UI/ml de LH (Hor- mona Luteinizante), 0.004 UI/ml de HMG (Gonadotrofina Menopáusica Humana) y 10% de SFB (Suero Fetal Bovino), en placas de 35 mm (Nunc, USA) dentro de una incu- badora (ESCO, Singapur) con 6% de CO2 a 38.5 °C, durante 24 horas (Figura 1). Luego de la incubación, los ovocitos fueron clasifi- cados como maduros o en metafase II, por la presencia del corpúsculo polar, cromosomas condensados y ausencia de vesícula germinal. Para ello, 10% de ovocitos maduros selec- cionados al azar y denudados, fueron fijados en placas portaobjetos y sumergidos parcial- mente en solución de ácido acético-etanol (1:3, vol/vol). Luego de 72 horas como míni- mo, fueron teñidos con 1% de solución aceto- orceina (wt/vol) (Motlik y Fulka, 1976) y se evaluó la estructura nuclear en un microsco- pio binocular (Olympus, Japón) con objetivo de 40X.
Fecundación y Cultivo in vitro
Se utilizó semen congelado en pajillas de toros Angus con fertilidad comprobada. Se seleccionaron los espermatozoides de mayor motilidad mediante gradiente de Percoll (Parrish et al., 1995) en una centrifuga (BOECO, Alemania), y capacita- dos en medio SOF base modificado previa- mente descrito, suplementado con 0.24 µg/ml de heparina. Los COCs madurados y los espermatozoides capacitados se incubaron en gotas de 75 µl del medio SOF base modifica- do dentro de placas de 35 mm, en una atmós- fera humidificada a 38.5 °C con 6% CO2, durante 18 horas.
Los presuntos cigotos fueron denuda- dos y lavados en el medio SOF base modifi- cado suplementado con 1X de aminoácidos esenciales, 1X de aminoácidos no esenciales y 0.04 mg/ml de mioinositol. Luego, 310 cigotos confirmados con dos células como mínimo, fueron distribuidos a los dos grupos de cultivo in vitro. Los cigotos del grupo de cultivo con sistema de co-cultivo fueron cul- tivados en grupos de 25, dentro de gotas de 100 µl de medio, cubiertas con aceite mineral y en placas de 60 mm. Los cigotos del grupo control se cultivaron en grupos de 25, dentro de gotas de 75 µl de medio, cubiertas de acei- te mineral y en placas de 35 mm. Ambos gru- pos fueron sometidos a atmósfera humidificada a 38.5 °C con 6% de CO .
Viabilidad Embrionaria
Se estimó la calidad embrionaria a tra- vés de la tinción con yoduro de propidio (PI) y diacetato de fluoresceína (FDA), ya que esta combinación de fluorocromos indica el daño al ADN y la actividad enzimática, res- pectivamente. Para ello, los embriones en estadio de mórula y blastocisto fueron denu- dados manualmente con micropipeta de 200 µl, en medio de manipulación PBS-PVA su- plementado con 0.025 mg/ml de estrepto- micina. Luego, se colocaron en medio de tinción compuesto por PBS-PVA suplemen- tado con 0.1 mg/ml de PI y 0.0015 mg/ml de FDA e incubados por 10 minutos. Finalmen- te, los embriones fueron evaluados en micros- copio invertido con fluorescencia (Olympus, Japón), donde la coloración verde brillante indicó actividad enzimática y viabilidad, ver- de oscuro indicó daño celular y baja activi- dad enzimática, y coloración roja muerte ce- lular y daño en el ADN (Figura 2). La inten- sidad de la coloración fue medida con el pro- grama Adobe Photoshop CC 2014.
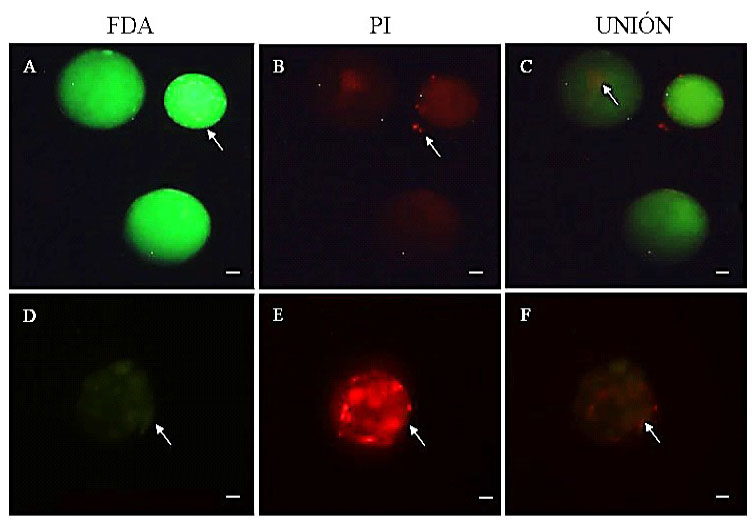
Figura 2 Viabilidad de embriones bovinos a los siete días de cultivo, mediante fluorescencia y tinción con yoduro de propidio (PI) y diacetato de fluoresceína (FDA). A: blastocisto viable (color verde brillante indica actividad enzimática-viabilidad), B: blastocisto con trazas de muerte celular (probablemente de células del cumulus), D: blastocisto no viable (color verde obscuro indica bajo nivel de actividad enzimática), E: blastocisto con muerte celular (color rojo brillante indica daño al ADN). La barra indica 50 µm
RESULTADOS Y DISCUSIÓN
Previa a la maduración in vitro, 30 ovocitos de las categorías A y B fueron teñi- dos con aceto-orceína, observándose que 86.7% de ovocitos se encontraban en esta- dio nuclear de vesícula germinal. Este por- centaje indica que la clasificación y selec- ción se realizó adecuadamente para un pro- ceso de maduración; sin embargo, 13.3% correspondió a ovocitos degenerados a pe- sar de que los COC fueron categorizados como A y B. Senatore et al. (2010) determi- naron que COCs de categorías A y B poseen mayor capacidad de maduración y fecunda- ción, pudiendo llegar a producir blastocistos, mientras que COC de categoría C y D no tienen la capacidad de maduración.
El 75% de los COCs alcanzó la metafase de la segunda división meiótica (metafase II) luego de 24 horas de incubación, mientras que el restante 25% de ovocitos degeneraron sin llegar a madurar (Cuadro 1). Sin embargo, cabe resaltar que según la evaluación de vesícula germinal previa a la maduración in vitro, un porcentaje de COC categorizados como A y B ya estarían degenerados, incluso antes de ingresar al proceso de maduración. Además, todos los ovocitos presentaron expansión de células de cumulus al final de la maduración in vitro, pero solo los que culmi- naron el periodo de maduración presentaron la extrusión del primer corpúsculo poblar. Esta tasa de maduración in vitro es superior al 61.4% reportado por Francisco et al. (2008) e inferior al 90% reportado por Soto-Martínez et al. (2019). Estas diferencias podrían atri- buirse al tamaño de los folículos ováricos as- pirados, al protocolo de maduración y a las características de los animales empleados en cada estudio. Van den Hurk y Zhao (2005) señalan que las células del cumulus son fun- damentales para el desarrollo embrionario, ya que conectadas al citoplasma del ovocito mediante uniones gap durante la maduración, transportan nutrientes, precursores metabólicos y hormonas esenciales para la maduración del ovocito.
Cuadro 1 Estadio nuclear de complejos ovocito-cumulus (COCs) a las 24 horas de maduración in vitro

1 MII: ovocito maduro en metafase II
Después de la fertilización in vitro, los 310 cigotos que fueron seleccionados exhi- bían extrusión de pronúcleos masculino y fe- menino, así como la primera división (dos células). Mucci et al. (2006) sostienen que solo el 80% de ovocitos podrá ser fecundado y continuar dividiéndose a 2 y 4 células. Lue- go de siete días de cultivo, la prueba de viabi- lidad con FDA evidenció diferencias signifi- cativas (p<0.05) y mayor actividad enzimática en embriones sometidos a un sistema con co- cultivo (51 ± 58), respecto a embriones sin co-cultivo (27 ± 26). Además, la tinción con PI evidenció menor daño a nivel del ADN en embriones del sistema con co-cultivo (Figura 2). Esta adición podría estar sincronizando la división nuclear y citoplasmática, así como previniendo el endurecimiento de la zona pelucida para facilitar la eclosión del blastocisto (Dey et al., 2012).
No se encontró diferencia significativa en el porcentaje de embriones viables entre ambos sistemas de cultivo in vitro, aunque aparentemente el sistema sin co-cultivo po- dría tener un proceso de desarrollo más ace- lerado que el sistema con co-cultivo. En el Cuadro 2 se aprecia el estadio embrionario alcanzado al séptimo día de cultivo in vitro, donde las tasas de mórula, blastocisto inicial, blastocisto propiamente dicho y blastocisto expandido, así como el porcentaje de dege- nerados, son similares entre ambos sistemas de cultivo y no existe asociación entre el sis- tema de co-cultivo y la cantidad de estructu- ras encontradas (p>0.05). Estos hallazgos discrepan del estudio de Cordova et al. (2014), quienes sostienen que el co-cultivo con células epiteliales mejora la tasa de desarrollo embrionario bovino, pero coincide en que se mejora su calidad.
Cuadro 2 Estadios de desarrollo in vitro de embriones bovinos hasta los siete días, según sistema de co-cultivo

a Letras iguales dentro de columnas indican diferencias no significativas (p>0.05) El co-cultivo se realizó con células del cumulus oophurus
Resultados inferiores han sido reporta- dos por Goovaerts et al. (2009), con 6.3% de blastocistos en un sistema de co-cultivo con células del cumulus y un ambiente con mez- cla de gases. No obstante, se debe conside- rar que en este estudio solo se usó CO , de modo que el sistema de cultivo en gotas, así como los medios y periodo de cultivo pudie- ron influir en el proceso. Sin embargo, aun- que en este estudio se observó que el siste- ma de co-cultivo con células del cúmulus po- dría estar retardando el desarrollo embriona- rio, pero a su vez podría influir en la sincroni- zación de los eventos durante el ciclo celular, mejorando la calidad de los embriones producidos (Senatore et al., 2010). Las células del cumulus cumplen funciones importantes para el soporte nutricional de los ovocitos, secretan hormonas esteroideas e inducen la reacción acrosomal de los espermatozoides (Canipari, 1994; Mattioli et al., 1998).
La producción de embriones in vitro genera bajas tasas de blastocistos (5-30%), consecuencia del bloqueo del desarrollo por la manipulación del óvulo o del embrión. Para evitar ello, se han empleado co-cultivos con células somáticas, células de cumulus, célu- las del epitelio oviductal, obteniendo resulta- dos controversiales (Reed et al., 1996; Bousquet et al., 1999; Soto-Martínez et al., 2019). Staigmiller y Moor (1984) y Kamishita et al. (1999) observaron que en co-cultivos con células del cumulus y células epiteliales, respectivamente, se incrementó la capacidad de desarrollo del embrión. Las células del cumulus parecen tener propiedades embriotróficas, las cuales en el medio de cul- tivo pueden ser responsables del efecto be- néfico del co-cultivo para los embriones (Mulheron y Schomberg, 1992; Vansteenbrugge et al., 1994). Sin embargo, en este estudio, el uso de co-cultivo no difirió del gru- po control (sin co-cultivo) respecto a la tasa de embriones producidos in vitro, probable- mente por el protocolo empleado o fuente de células somáticas.
CONCLUSIONES
Si bien la calidad de los ovocitos está determinada por el número de células de cumulus que componen el complejos ovocito-cumulus (COC), la morfología y el color, esta no es determinante para la competencia al momento de la madu- ración, ya que una proporción de COCs de categorías A y B podría encontrarse en proceso de degeneración.
Las tasas de mórulas y blastocistos bovinos producidos in vitro fueron estadísticamente similares entre los sis- temas de cultivo con y sin co-cultivo. Sin embargo, el uso de co-cultivos con célu- las de cumulus oophurus permitió me- jorar su viabilidad, evidenciada por ma- yor actividad enzimática y por lo tanto, una mejor calidad para continuar su de- sarrollo












 uBio
uBio