INTRODUCCIÓN
La ehrlichiosis es una enfermedad causada por una bacteria gram negativa del orden Rickettsiales, género Ehrlichia y se la describe como pleomórfica e intracelular obligada (CFSPH, 2013; Silva et al., 2014). En el género Ehrlichia hay cinco especies reconocidas: E. canis, E. chaffensis, E. ewingii, E. muris y E. ruminantium. De estas, E. canis causa la ehrlichiosis monocítica canina (CFSPH, 2013).
El principal vector para la transmisión de E. canis es la garrapata marrón del perro (Rhipicephalus sanguineus), la cual se infecta al ingerir sangre de un animal infectado (Chávez, 2014). Los perros infectados presentan una fase aguda, con una variedad de signos clínicos inespecíficos, tales como fiebre, letargia, anorexia, y signos gastrointestinales, respiratorios, oculares y neurológicos (Waner y Harrus, 2013). Algunos perros que poseen una inmunidad adecuada o con infecciones leves, pueden superar la fase aguda de la ehrlichiosis y llegar a eliminar a la bacteria sin tratamiento. Sin embargo, otros progresan a la fase subclínica, donde son asintomáticos o con signos clínicos leves, pero también pueden desarrollar la enfermedad crónica, con signos clínicos similares a los de la fase aguda, pero más severos, pudiendo afectar los tejidos hepático, renal y hematopoyético (Mylonakis et al., 2010).
La ehrlichiosis se diagnostica por métodos indirectos como la inmunofluorescencia indirecta (IFI), ELISA e inmunocromatografía (Brandao et al., 2015), o métodos directos como el frotis directo y la reacción en cadena de la polimerasa (PCR) (Cartagena, 2015). Los sistemas inmunocromatográficos se basan en la captura inmunológica de un coloide coloreado durante su paso a través de una membrana en la cual se ha inmovilizado un anticuerpo o antígeno (Acosta, 2003). La aparición de una línea rojo púrpura en la prueba indica la presencia de anticuerpos (Farrell, 2009).
La determinación serológica de anticuerpos contra E. canis no solo permite un mejor acercamiento diagnóstico (ya que confirman que el canino ha estado expuesto a la enfermedad); sino que, permite realizar la serovigilancia del estado epidemiológico de la enfermedad. Los kits inmunocromatográficos para la detección de anticuerpos contra E. canis poseen una alta sensibilidad y especificidad en comparación con la prueba de IFI, que es considerada como la prueba de oro.
En el Perú, la ehrlichiosis canina fue detectada en caninos a partir de 1982, y desde ahí se ha incrementado el número de casos reportados (Huerto y Dámaso, 2015). Varios autores han estudiado la enfermedad y su epidemiología, así Carpio (2008) y Aguirre reportaron prevalencias de 70% en caninos de Máncora y Chosica, respectivamente, Velásquez (2008) encontró 21% en perros de la Reserva Nacional de Paracas, Jara (2014) halló 23% de perros infectados en clínicas veterinarias de Chimbote, y Huerto y Dámaso (2015) reportaron 51.3% positivos en Huánuco. Por otro lado, en Lima Metropolitana se han reportado seroprevalencias entre 9 y 20%, dependiendo del distrito (Adrianzen et al., 2003).
Se tiene evidencia que al menos el 30% de la población canina en los distritos de la zona de Lima Norte presentan garrapatas (Estares et al., 2000). Además de ello, la población canina ha ido en aumento, lo que se demuestra en estudios realizados por Arauco et al. (2014) y Soriano et al. (2017) que determinaron 82 794 de canes con dueño en el distrito de San Martin de Porres y 85 934 canes para el distrito de Comas. A esto se suma la alta cantidad de perros deambulantes (Ochoa et al., 2013).
El objetivo de este estudio fue determinar la frecuencia serológica de E. canis a partir de resultados de un kit inmunocromatográfico en muestras de pacientes caninos remitidas a un laboratorio de la zona norte de Lima en el periodo 2014-2016. Asimismo, evaluar la asociación entre las variables sexo, edad y raza con la seropositividad y la asociación entre los resultados serológicos y los hallazgos hematológicos.
MATERIALES Y MÉTODOS
El estudio se realizó en el laboratorio de análisis clínico veterinario Vet Support, que recibe muestras remitidas por clínicas veterinarias de los distritos de Carabayllo, Los Olivos, Comas, San Martin de Porres, Independencia y Puente Piedra de Lima Norte.
El estudio fue de tipo observacional y analítico. La población objetivo fueron los registros completos de pacientes entre 2014 y 2016, en los cuales se realizó serología de anticuerpos contra E. canis, utilizando el kit comercial Anigen Rapid E.canis Ab Test Kit (Bionote). El kit presenta una alta sensibilidad (97.6%) y especificidad (99%) en comparación con la prueba de IFI (Bélanger et al., 2002). Además, se recopiló la información de los análisis hematológicos realizados y se utilizaron los valores de referencia del laboratorio, tanto para el grupo de perros adultos (mayores de cinco meses) como de cachorros (hasta cinco meses).
Se determinó la frecuencia de resultados positivos en base al total de muestras analizadas para cada año. Se elaboraron tablas de estadística descriptiva y se utilizó la prueba de Chi cuadrado para determinar asociación entre el resultado de la prueba y las variables raza y sexo. Para analizar la variable edad se usó prueba de Chi cuadrado y de t de Student. Para los registros que tuvieron análisis hematológicos anexos se elaboró una tabla de resumen descriptivo según resultado a la prueba inmunocromatográfica (positivo y negativo), en la que se indican los valores mínimos, máximo, media y desviación estándar para la serie roja, blanca y plaquetaria. La distribución normal de los datos de las variables cuantitativas continuas se evaluó mediante la prueba de Kolmogorov Smirnov de una muestra. Los datos que siguieron la distribución normal fueron evaluados mediante la prueba de t de Student y para los demás se utilizó la prueba de U de Mann Whitney.
El estudio fue aprobado por el Comité Institucional de Ética para el Uso de Animales (CIEA) de la Universidad Peruana Cayetano Heredia (UPCH). Solo tuvieron acceso a la información generada durante el trabajo el investigador principal, el asesor y los revisores.
RESULTADOS
Se obtuvieron 1216 registros con orden de serología para investigación de la presencia de anticuerpos para E. canis. De estos, 768 registros incluyeron los datos del hemograma. Se hallaron 68 muestras de cachorros y 557 de adultos; asimismo, 143 no tenían información sobre la edad, por lo que se excluyeron para el análisis de las variables hematológicas.
La frecuencia de casos con serología positiva a E. canis fue de 59.4% (723/1216) (Cuadro 1). Se encontró asociación estadística mediante la prueba de Chi cuadrado entre la presencia de anticuerpos contra E. canis y la edad en perros mayores a dos años (p<0.05). Los perros positivos tienen una media de edad de 3.5 ± 3.2 y los negativos 3.0 ± 3.0, diferencia estadísticamente significativa (p<0.05). La prueba de Chi cuadrado indicó una asociación significativa entre raza y la seropositividad (p<0.05), pero no con el sexo de los animales (Cuadro 2).
Cuadro 1 Resultado a la prueba serológica para detectar Ehrichia canis en perros de Lima Norte, según edad
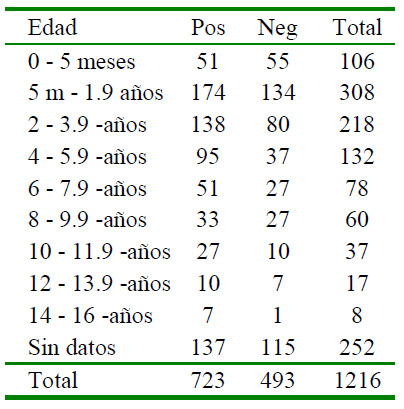
Cuadro 2 Resultados serológicos de la prueba de inmunocromatografía para la detección de Ehrlichia canis en perros de Lima Norte (2014-2016), según raza y sexo
a,b Diferentes letras dentro de las variables raza y sexo son significativamente diferentes (p<0.05)
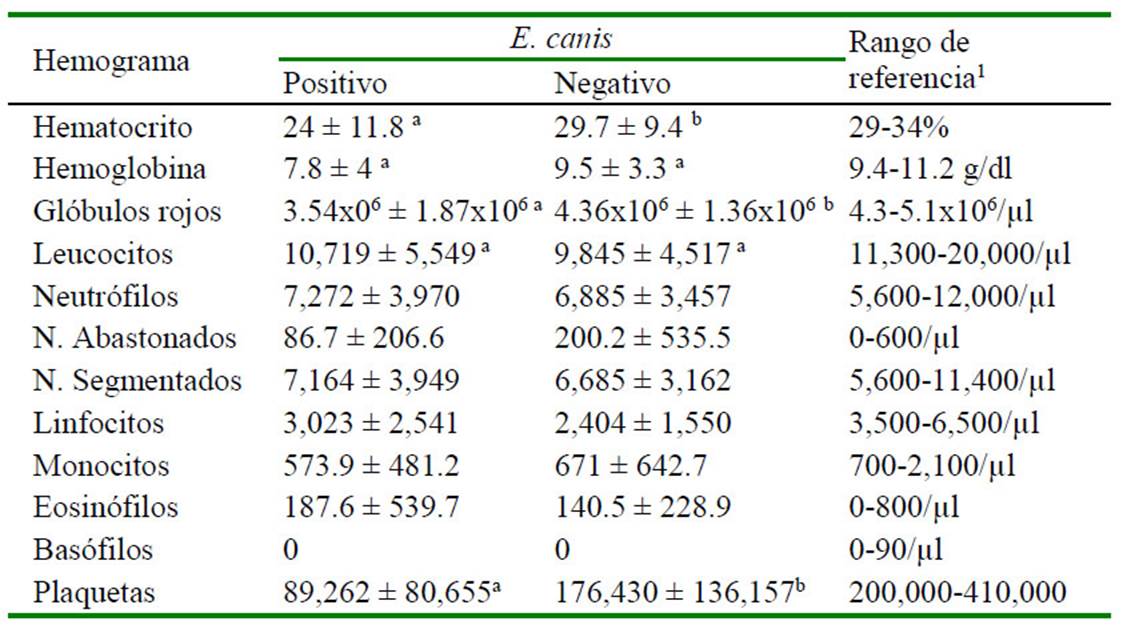
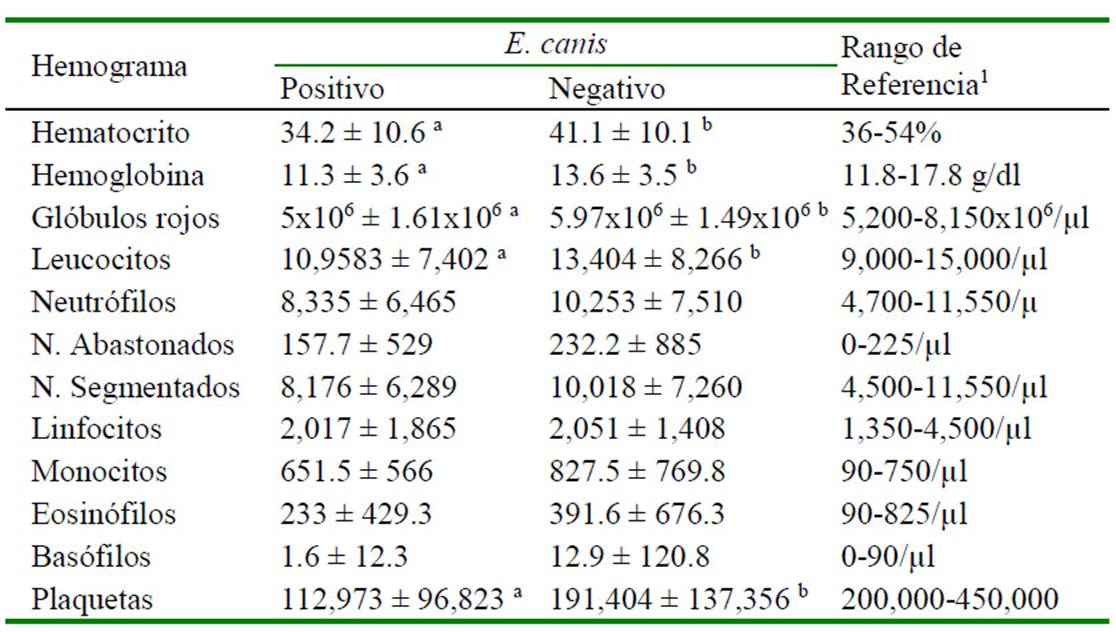
De los registros con hemogramas (n= 768), 68 corresponden a cachorros. En el Cuadro 3 se describe los resultados obtenidos para los valores hematológicos con respecto al resultado del kit para anticuerpos de E. canis en cachorros. Se encontró diferencia significativa entre positivos y negativos a E. canis para los valores de hematocrito, glóbulos rojos y plaquetas (p<0.05), mientras que para las variables hemoglobina y glóbulos blancos no hubo diferencia estadística significativa. Por otro lado, en perros adultos se encontró diferencia significativa en los valores de hematocrito, hemoglobina, glóbulos rojos, glóbulos blancos y plaquetas (p<0.05) entre positivos y negativos a E. canis (Cuadro 4).
Cuadro 3 Valores hematológicos de 68 perros cachorros (hasta cinco meses) con serología para Ehrlichia canis en la zona de Lima Norte (2014-2016)
a,b Diferentes letras dentro de los parámetros hematológicos son significativamente diferentes (p<0.05)
1 Clínica de Animales de Compañía, Universidad Peruana Cayetano Heredia, Lima, Perú
Cuadro 4 Valores hematológicos de 557 perros adultos (más de cinco meses) con serología para Ehrlichia canis en la zona de Lima Norte (2014-2016)
a,b Diferentes letras dentro de los parámetros hematológicos son significativamente diferentes (p<0.05)
1 Clínica de Animales de Compañía, Universidad Peruana Cayetano Heredia, Lima, Perú
DISCUSIÓN
Si bien se halló que el 59.4% de las muestras resultaron positivos a E. canis, es posible que este valor sea muy diferente si se incluyen los perros con dueños que no son llevados a veterinarias y perros vagabundos que pueden portar la enfermedad. Se debe considerar, además, que el resultado corresponde a muestras analizadas provenientes de clínicas veterinarias cuyos pacientes tenían sospecha o diagnóstico presuntivo de ehrlichiosis.
Se debe tener en cuenta que los anticuerpos son producto de la inmunidad adquirida de tipo humoral, producidos por las células plasmáticas después de la estimulación del linfocito B (Vega, 2008). Los perros positivos no necesariamente desarrollan la enfermedad, pero han sido expuestos a la enfermedad (McBride et al., 2003). Por lo tanto, una alta frecuencia de anticuerpos contra E. canis significa una alta frecuencia de exposición al agente patógeno en los perros llevados a veterinarias en Lima norte.
La frecuencia encontrada puede deberse a la gran cantidad de perros vagabundos en los distritos de Lima Norte (Arauco et al., 2014; Soriano et al., 2017). Estos animales representan una fuente importante del vector ya que, al estar en contacto con otros perros en ambientes comunes tales como jardines y parques, aumentan el riesgo de contagio por el vector (Huerto y Dámaso, 2015).
El estudio demostró una mayor presencia de anticuerpos contra E. canis en perros mayores de dos años. En este sentido, se ha reportado una mayor frecuencia de ehrlichiosis canina en perros mayores de un año (Asgarali et al., 2012), mayores de 2-4 años (Contreras, 2006) y mayores de 4 años (Jara, 2014) Estos resultados pueden ser explicados debido a que los perros a partir de edad mediana tienen mayor probabilidad de exposición a garrapatas que los cachorros, por la costumbre de los dueños de pasear a sus canes una vez completadas las vacunas (Huerto y Dámaso, 2015).
La asociación significativa entre grupo racial y seropositividad a E. canis estuvo de acuerdo con el trabajo de Cartagena et al. (2015), quienes encontraron una mayor prevalencia en perros mestizos; no obstante, Huerto y Dámaso (2015) no encontraron diferencias significativas entre razas. Por otro lado, no se encontró asociación significativa entre la presencia de anticuerpos contra E. canis y el sexo de los caninos, habiendo resultados contradictorios en la literatura; así, Adrianzen et al. (2003) reportan una mayor prevalencia en hembras, mientras que Asgarali et al. (2012), Contreras (2006) y Cartagena et al. (2015) no encontraron diferencias significativas entre estas variables.
Se ha descrito un comportamiento fisiológico diferente entre perros jóvenes y adultos para los valores eritrocitarios y leucocitarios (Harper et al., 2003; Lawler et al., 2007; Brenten et al., 2016), de allí que en este estudio se analizaron por separado. En el análisis de las variables hematológicas en cachorros, en la serie roja se obtuvo una media más baja de hemoglobina y glóbulos rojos en perros positivos a la enfermedad con respecto a los negativos, sin embargo, al analizar la hemoglobina no se encontró diferencia estadística significativa. Hay que tener en cuenta que la significancia para la hemoglobina fue muy cercana a 0.05 (p= 0.058).
No se encontró estudios similares que comparen la frecuencia o prevalencia de la enfermedad y las variables hematológicas en cachorros. Sin embargo, en los adultos, la serie roja, blanca y plaquetaria presentaron valores promedio más bajos en perros positivos a ehrlichiosis con respecto a los negativos, lo cual concuerda con el estudio de Elitok y Ungur (2016) y Fonseca et al. (2017), aunque Aguirre (2008) no encontró tales diferencias. La trombocitopenia en diferentes grados es el hallazgo hematológico característico en las fases de la enfermedad producida por E. canis (Straube, 2010; Waner y Harrus, 2013). La bacteria se multiplica en las células mononucleares y la trombocitopenia se debería a un mayor consumo, secuestro y destrucción de las plaquetas (López et al., 1999).
Hay que tener en cuenta que, en exposiciones agudas, la presencia de anticuerpos no siempre está presente en el animal infectado (Munhoz et al., 2012). En esta fase de la enfermedad, la trombocitopenia es el hallazgo hematológico más común (Rodríguez-Vivaz et al., 2005). Esto puede explicar los casos de perros negativos a la prueba de anticuerpos contra E. canis, que acudieron a consulta al presentar sintomatología compatible y que presentaron trombocitopenia.
CONCLUSIONES
Se confirmó la exposición a Ehrlichia canis en el 54.8% de perros, cuyas muestras fueron llevadas a un laboratorio de Lima Norte.
Los animales adultos tienen una mayor probabilidad de haberse expuesto a la enfermedad.
Los perros diagnosticados como positivos tienen valores hematológicos menores a los negativos.
El estudio sugiere una alta prevalencia de E. canis en Lima Norte












 uBio
uBio 

