INTRODUCCIÓN
La diversidad morfológica, fisiológica, ciclos de vida y crecimiento de las plantas se relacionan con la disponibilidad de agua, luz, temperatura y nutrientes (Mordecai, 2012; Stewart y Verma, 2012). La variación de la textura del suelo causa la diversidad en la composición florística, a través de la regulación hídrica y la disponibilidad de nutrientes (Hogg, 1997; Anderson y Talbot, 2006; Weng y Luo, 2008).
Las precipitaciones en los trópicos (temperaturas >20 °C) mantienen la humedad del suelo, promoviendo el crecimiento de la vegetación. La disponibilidad de nutrientes en suelos tropicales se da por su biota y actividad del complejo de cambio (Zaller y Arnone, 1999; Cheng et al., 2002; Laporte et al., 2002; Xu et al., 2004; Wang et al., 2006; Bell et al., 2009).
La fenología de gramíneas se vincula a la disponibilidad de agua, delimitando su espacio y tiempo de ocupación (George et al., 1985). El cambio climático promueve sequias episódicas, disminuyendo la cobertura (atributo ecológico) que mantiene la humedad y controla la erosión (Raich y Tufekcioglu, 2000; Hendrickson y Berdahl, 2007; Harrington y Jun, 2008; Kudernatsch et al., 2008; Deutsch et al., 2010).
Los tipos de vegetación altoandina, a lo largo de las eras geológicas modificaron su comportamiento y estructura funcional. Muchas gramíneas altoandinas tuvieron ancestros tropicales, por lo que su actividad fotosintética debería ser C4; sin embargo, las C3 se adaptaron mejor a la altitud y al frío (Lambers et al., 2008; Anthelme y Peyre, 2019).
La capacidad fotosintética depende del área foliar y volumen de mata, en tanto, la absorción de nutrientes del suelo de la relación raíz/tallo (Lemaire et al., 2000), mientras que la tasa de transpiración se vincula al coste energético estructural, siendo clave en la demanda de carbono (Frank, 2003). El intercambio de O2 y CO2 está sujeto al área foliar debido a los estomas (Lambers et al., 2008). La Festuca dolichophylla (Presl, 1830) y Festuca humilior (Nees & Meyen, 1841) retienen importantes cantidades de carbono en pajonales altoandinos, de acuerdo con su biomasa aérea y radicular. El CO es un gas de efecto invernadero que puede ser mitigado con la preservación de pajonales altoandinos (Quispe et al., 2015).
El estudio comparativo de la historia de vida y fisiología de especies indicadoras de pajonales puede facilitar la comprensión de su importancia ecológica. Por lo tanto, el objetivo del presente estudio fue comparar el crecimiento, acumulación de biomasa, dinámica de macollamiento y comportamiento hídrico de Festuca dolichophylla (Presl, 1830) y Festuca humilior (Nees & Meyen, 1841).
MATERIALES Y MÉTODOS
El estudio se realizó en áreas revegetadas en el distrito de Canchayllo, provincia de Jauja, departamento de Junín, Perú (Figura 1), a una altitud de 4186 msnm. El área experimental fue de 2500 m2, cercada con 0.4 km de malla ganadera para proteger del ingreso de animales. Antes del experimento, la pradera estuvo pastoreada por vacunos en un sistema de pastoreo rotacional, teniendo seis meses de descanso. Durante el experimento no se permitió el ingreso de animales, equipos, maquinarias o personas ajenas al experimento. Como se revegetó el área, se permitió que acontecieran los procesos de crecimiento y desarrollo, así como la competencia natural con otras especies vegetales, sin intervención antrópica.
Para la instalación se dividió el área en dos parcelas de 1250 m2 cada una, asignando una parcela para cada especie vegetal. Los esquejes de F. dolichophylla y F. humilior provinieron de matas de buen vigor de la zona circundante. Las dimensiones de los esquejes fueron de 5 cm de diámetro basal y 20 cm de largo, con una densidad de siembra de uno por metro cuadrado, realizado en diciembre de 2015.
Para el muestreo las parcelas se dividieron en 25 subparcelas de 40 m2, dejando el resto del área como efecto borde. De cada subparcela se señalaron cinco matas al azar, haciéndoles un seguimiento durante 17 meses. Las mediciones de las matas se realizaron mensualmente desde enero hasta diciembre de 2016, y se hizo una medición final de monitoreo en mayo de 2017, haciendo un total de 13 mediciones.
La pendiente del terreno fue de 15°, con paisaje circundante de colinas y montañas. La zona de vida fue la tundra alpina tropical muy húmeda. La temperatura máxima (17 ºC) se presentó en enero y febrero, mientras la temperatura mínima (-1 ºC) fue en junio y julio. La precipitación máxima fue de 130 mm en febrero y la mínima de 5 mm en julio.
Las propiedades físicas del suelo fueron: textura franco-arenosa con 63.0, 29.3 y 7.7% de arena, limo y arcilla, respectivamente; densidad aparente de 1.1 g cm-3 con 60.2% de porosidad y resistencia mecánica de 2.38 kg cm-2; indicando una buena estructura física. Las propiedades químicas fueron: materia orgánica: 9.3% (alto), pH: 5.3 (fuertemente ácido), conductividad eléctrica 0.2 ds m-1 (no salino), capacidad de intercambio catiónico de 34.7 meq 100 g-1 (medio), suma de cationes 17.2 meq 100 g-1, suma de bases 17.1 meq 100 g-1 y porcentaje de saturación de bases de 49.3%; valores que indican una aceptable retención de nutrientes.
La capacidad de campo fue 25.12 ±1.92%, típica de un suelo franco-arenoso con alto contenido de materia orgánica. Se aproximó al punto de marchitez en 14.50%, por lo que el suelo evidencia un buen volumen de agua disponible. Las características botánicas de Festuca dolichophylla (Presl, 1830) y Festuca humilior (Nees & Meyen, 1841) se muestran en el Cuadro 1.
Cuadro 1 Características botánicas de las especies utilizadas en revegetación

Fuente: Tovar y Oscanoa (2002)
El volumen de las matas se estimó de la altura a la canopia, radio de la canopia y radio de la corona, tomada con una regla milimétrica en centímetros. La fórmula de volumen utilizada fue del cono truncado [Ecuación 1: V = (h*π)/3(R2+r2+[R*r]), donde V: Volumen de la mata, h: Altura de la canopia, R: Radio de la canopia, r: Radio de la corona. Los macollos vivos, muertos y las inflorescencias se contaron manualmente; estimándose el porcentaje de macollos muertos [Ecuación 2: % macollos muertos = (n° macollos muertos/n° macollos basales)*100] y florales macollos [Ecuación 3: % macollos florales = (n° inflorescencias/(n° macollos basales)*100].
La tasa de transpiración se midió en mmol m2s-1 (milimoles por metro cuadrado por segundo) utilizando un porómetro (Decagon Devices), cuyo rango de conductancia fue 0 a 1000 mmol m2s-1 y una precisión 10% de la media. El equipo es de tipo estacionario, midiendo la presión de vapor y el flujo de vapor sobre la superficie de la hoja. El porómetro se calibró a las condiciones ambientales antes de hacer las mediciones en dos hojas por mata entre las 08:00 y 10:00 horas.
La humedad volumétrica del suelo (%) se estimó utilizando un Reflectómetro de Dominio Temporal (TDR) Fieldscout TDR350 con una precisión de ±3.0% de contenido volumétrico de agua con conductividad eléctrica <2 mS cm-1. Los datos recogidos fueron registrados y guardados en campo, luego fueron descargados a un computador para ser analizados.
El análisis estadístico fue longitudinal polinomial de grado dos. Se utilizó un modelo con efectos fijos: especie y mes, y un efecto aleatorio: edad pos-plantación. Las unidades observacionales fueron 125 matas de Festuca humilior (Nees & Meyen, 1841) y 125 matas de Festuca dolichophylla (Presl, 1830). El análisis estadístico se realizó mediante la prueba de t Student, usando el software estadístico R(r) v.3.4 con las librerías lm y lsmeans (http://topepo.github.io/caret/preprocessing.html).
RESULTADOS
Crecimiento y Acumulación de Biomasa
F. dolichophylla evidenció una mayor altura a la hoja bandera y volumen de la mata promedio de los meses evaluados (29.66 ±0.56 cm y 993.88 ± 44.34 cm-3, respectivamente) (Cuadro 2), siendo el comportamiento de crecimiento similar en ambas especies durante todo el periodo de evaluación, a pesar de las diferencias marcadas en volumen de mata y altura a la hoja bandera (Figura 2).
Cuadro 2 Indicadores de crecimiento de Festuca dolichophylla (Presl, 1830) y Festuca humilior (Nees & Meyen, 1841)

a,b Letras diferentes dentro de columnas indican diferencia significativa (p<0.05)
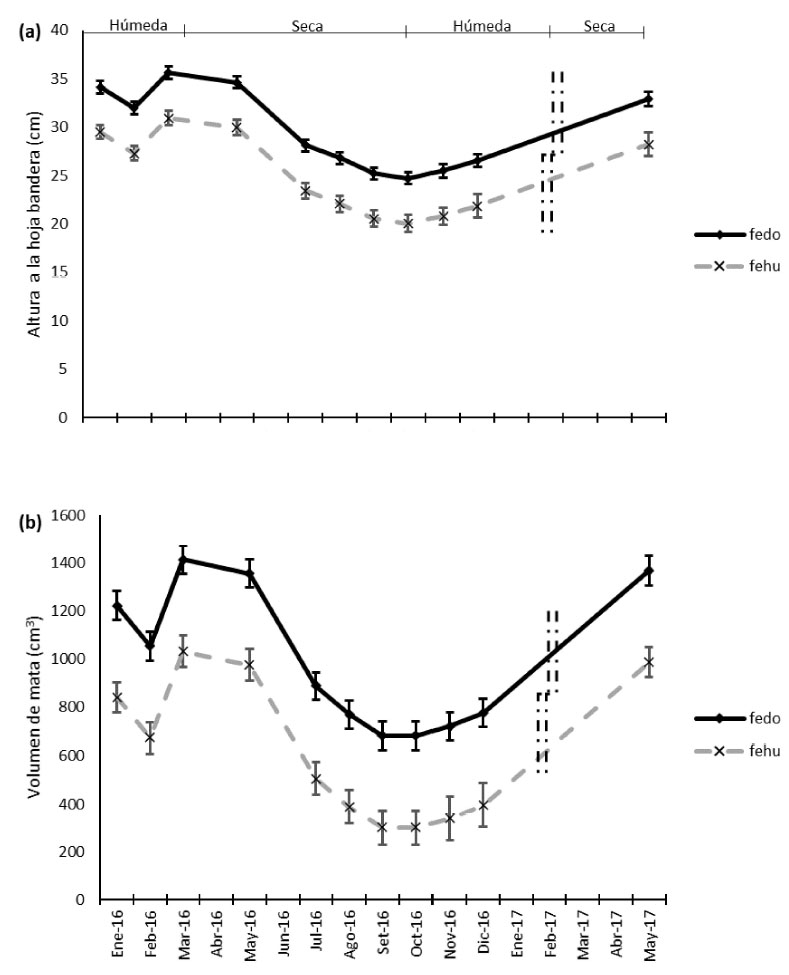
Figura 2 (a) Dinámica de la altura a la hoja bandera (cm) y (b) Volumen de mata (cm3) de Festuca dolichophylla (Presl, 1830) (fedo) y Festuca humilior (Nees & Meyen, 1841) (fehu) en la sierra peruana. (Barras verticales: meses no evaluados)
F. dolichophylla presentó el mayor crecimiento en marzo de 2016 con una altura a la hoja bandera de 35.63 ± 0.60 cm y volumen de mata de 1413.39 ± 58.85 cm-3, mientras que el menor crecimiento se presentó en octubre con una altura a la hoja bandera de 24.73 ± 0.63 cm y volumen de mata de 681.74± 57.76 cm-3 (Figura 2). En el caso de F. humilior el mayor crecimiento fue similarmente en marzo de 2016 con una altura a la hoja bandera de 30.95 ± 0.79 cm y volumen de mata de 974.94 ± 66.08 cm-3, y el menor crecimiento en octubre con una altura a la hoja bandera de 20.04 ± 0.89 cm y volumen de mata de 300.86 ± 72.21 cm-3 (Figura 2).
Dinámica del Macollamiento
F. dolichophylla y F. humilior tuvieron similar número de macollos basales, mientras que F. humilior tuvo un mayor porcentaje de macollos florales promedio de los meses evaluados (Cuadro 3). La floración siempre fue mayor en F. humilior durante el establecimiento y crecimiento de las matas (Figura 3).
Cuadro 3 Indicadores de macollamiento de Festuca dolichophylla (Presl, 1830) y Festuca humilior (Nees & Meyen, 1841)
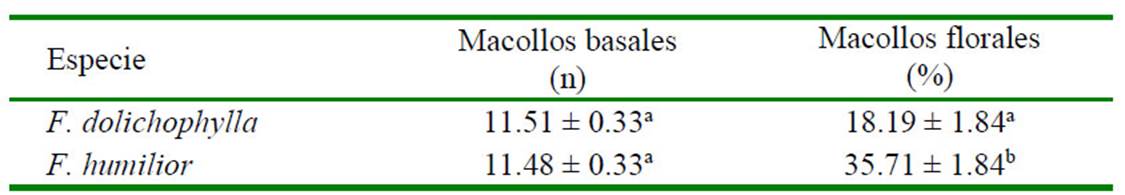
a,b Letras diferentes dentro de columnas indican diferencia significativa (p<0.05)
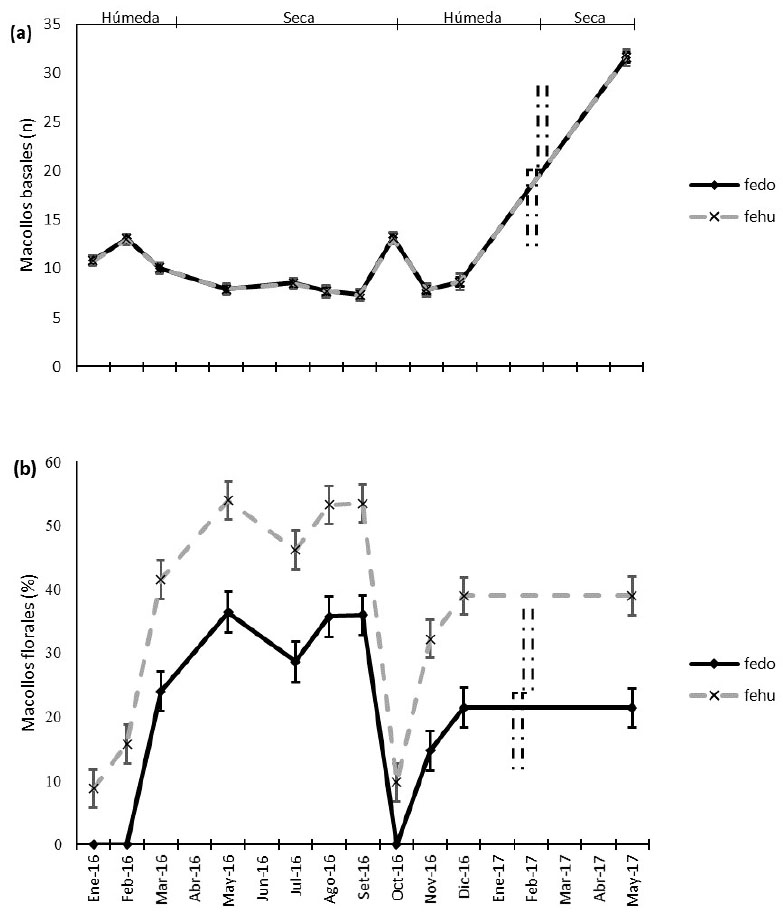
Figura 3 (a) Dinámica número de macollos basales (n) y (b) Porcentaje de macollos florales de Festuca dolichophylla (Presl, 1830) (fedo) y Festuca humilior (Nees & Meyen, 1841) (fehu) en la sierra peruana. (barras verticales: meses no evaluados)
El mayor número de macollos se presentó en mayo de 2017 con 31.60 ± 0.51 y 31.51 ± 0.85 en F. dolichophylla y F. humilior, mientras el porcentaje de macollos florales fue de 36.40 ± 3.16 y 53.20 ± 3.01% en F. dolichophylla y F. humilior, respectivamente (Figura 3). Por otro lado, el menor número de macollos fue observado en octubre con 7.86 ± 0.49 y 7.82 ± 0.64 en F. dolichophylla y F. humilior, respectivamente, mientras que el porcentaje de macollos florales fue de 9.79 ± 2.98 en F. humilior, en tanto que F. dolichophylla no llegó a florear.
El inicio de floración fue inmediato en F. humilior, en tanto que F. dolichophylla floreció a los tres meses de haberse plantado los esquejes (Figura 3).
Comportamiento Hídrico
La tasa de transpiración fue similar en ambas especies (Cuadro 4), indicando que el mayor volumen de mata no influye significativamente en la transpiración en gramíneas altoandinas.
Cuadro 4 Tasa de transpiración de Festuca dolichophylla (Presl, 1830) fedo y Festuca humilior (Nees & Meyen, 1841) fehu

a,b Letras diferentes dentro de columnas indican diferencia significativa (p<0.05)
La humedad volumétrica superficial (7.5 cm) fue de 72.59 ± 1.09% y superior a la humedad volumétrica profunda (20 cm) que fue de 57.37 ± 0.78% en marzo de 2016. Esta tendencia de humedad volumétrica superficial superior se mantuvo hasta julio del mismo año. La humedad superficial de agosto y setiembre fue de 4.39 ± 1.01 y 5.59 ± 1.01%, respectivamente, muy por debajo del punto de marchitez (14.5%) (Figura 4).
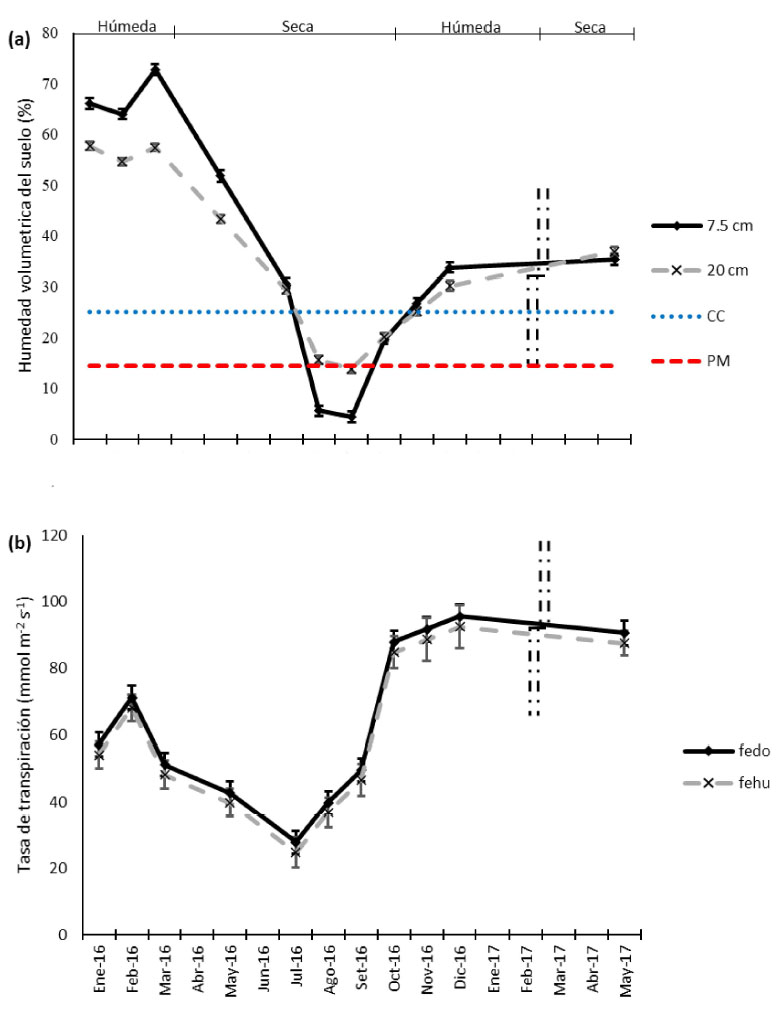
Figura 4 Humedad volumétrica del suelo y tasa de transpiración de Festuca dolichophylla (Presl, 1830) (fedo) y Festuca humilior (Nees & Meyen, 1841) (fehu) en la sierra peruana. (Barras verticales: meses no evaluados; CC: Capacidad de campo; PM: Punto de marchitez)
La mayor tasa de traspiración fue observada en diciembre con 95.45 ± 3.59 y 92.38 ± 6.53 mmol m-2 s-1 en F. dolichophylla y F. humilior, respectivamente, mientras que la menor tasa de transpiración fue en julio con 27.77 ± 3.39 y 24.71 ± 4.31 mmol m-2 s-1, respectivamente (Figura 4).
DISCUSIÓN
Las mediciones se obtuvieron de áreas revegetadas, evaluándose desde el primer mes pos-plantación de los esquejes. Las gramíneas altoandinas tienen una correlación de 0.7-0.8 de la altura y el volumen con la biomasa (Oliveras et al., 2014), siendo un buen indicador de crecimiento.
En F. humilior, Tácuna et al. (2015) encontraron un volumen promedio de mata de 20 595.3 cm3, mientras que García (2018) reportó valores entre 12 800 y 21 329 cm3 y en altura a la hoja bandera entre 23.48 y 29.42 cm en áreas revegetadas sin y con fertilización, respectivamente. Los resultados del presente estudio coinciden con la altura a la hoja bandera, mas no con el volumen de mata. Posiblemente, el diámetro de canopia y corona fue mayor, indicando una mayor edad posinstalación.
Medina (2013) reportó para F. dolichophylla una altura a la hoja bandera de 48.25 cm, en tanto que Tovar (1993) encontró una altura a la hoja bandera de 50-70 cm, y Flores (2017) menciona una altura variable de 40 a 80 cm dependiendo del estado fenológico. Por otro lado, Lima et al. (2020) reporta 41.0 y 46.8 cm de altura y 13 717 y 23 060 cm3 de volumen de mata en áreas sin y con fósforo, respectivamente. La diferencia con el estudio se deba probablemente a la edad, ecotipo y/o adición de fertilizantes.
En gramíneas de pajonales semiáridos, Pugnaire y Haase (1996) encontraron una altura a la hoja bandera en Lygeum spartum de 73.80±6.50 cm y en Stipa tenacissima de 80.40±2.30 cm, mientras Rojo et al. (2017) en Festuca crysophylla fue de 42.45 cm. Teniendo en cuenta que las áreas del presente estudio fueron revegetadas, los valores obtenidos para las dos especies fueron menores.
Festuca orthophylla tiene un número de macollos basales de 3167 ± 1696 con emergencia intravaginal, dando como resultado canopias densas, de allí que el 80% de hojas verdes recibe menos del 50% de luz (Monteiro et al., 2011), en tanto que García (2018) menciona de 2 a 18 macollos en F. humilior en áreas revegetadas. Los valores reportados en el presente estudio son superiores a los de García (2018), pero inferiores a los de Monteiro et al. (2011), quienes evaluaron una especie distinta y completamente establecida.
García (2018) encontró entre 72.08 y 79.92% de macollos florales en F. humilior en áreas revegetadas, en tanto que Castro (2019) encontró una pureza de semilla de 2518% y 28-34% en F. dolichophylla y F. humilior, respectivamente. La floración reportada en este estudio estuvo por debajo, aunque F. humilior evidenció mayor porcentaje de floración, respaldado con una mayor pureza de semilla.
Las gramíneas nativas inician su crecimiento, floración y maduración dependiendo de la humedad del suelo, mostrando paisajes heterogéneos en pastizales (James et al., 2003; Anderson y Talbot, 2006; Gerakis et al., 2006; Shinoda et al., 2007). En este estudio, F. humilior inició una floración inmediata a diferencia de F. dolichophylla, demostrando la diferencia en sus patrones fenológicos.
Las gramíneas del género Stipa tienen un crecimiento oportunista, con área específica de la hoja menor y una conductancia estomática de agua muy baja (Pugnaire y Haase, 1996). La transpiración de 13.4 a 372.7 mmol m-2 s-1 en F. dolichophylla disminuye en la época seca y aumenta conforme se acerca la época húmeda (Volk et al., 2000). En pajonales semiáridos de 350 mm de precipitación prosperan especies como Chionochloa rigida con tasas de transpiración de 140-290 mmol m-2 s-1 (Campbell, 1989), en tanto que Stipa tenacissima L tiene una tasa de 38.9-166.7 mmol m2 s-1 (Ramírez et al., 2006). Es así que el comportamiento de regulación hídrica de las dos especies evaluadas coincidió con los estudios hechos en gramíneas semiáridas [valores de 92-95 mmol m-2 s-1], demostrando que los pajonales evolucionaron y se adaptaron a ambientes áridos, debido a que cuentan con un buen control de la pérdida de agua.
La evapotranspiración en pajonales sudamericanos del páramo varía entre 6 y 635 mm por año, contribuyendo a la dinámica y flujo de CO (Carrillo-Rojas et al., 2019). Los resultados de la tasa transpiración contribuyeron a identificar que ambas especies en estudio son fundamentales para mantener los servicios ecosistémicos de pajonales altoandinos.
CONCLUSIONES
Los mayores indicadores de crecimiento se evidenciaron en Festuca dolichophylla (Presl, 1830), posiblemente debido a que su estrategia adaptativa sea la ocupación del espacio, dándole oportunidad a una mayor actividad fotosintética frente a otras especies.
El macollamiento basal fue similar en ambas especies, sin embargo, Festuca humilior (Nees & Meyen, 1841) tuvo un mayor porcentaje de macollos florales, incluso en la época seca, por lo que su estrategia adaptativa posiblemente sea una floración persistente.
El buen control de la pérdida de agua evidenciado en las bajas tasas de transpiración encontradas en F. dolichophylla y F. humilior, demuestra que esta es una estrategia adaptativa rigurosa en pajonales altoandinos












 uBio
uBio