INTRODUCCIÓN
Los probióticos son suplementos de microorganismos vivos que al ser adminis- trados en dosis adecuadas benefician al hos- pedero animal al facilitar el balance de la po- blación microbiana del tracto gastrointestinal. Estos microorganismos compiten por lugares de adhesión con sus pares enteropatógenos (Fuller, 1989, Reid et al, 2003; ONU-FAO, 2006; Tiwari et al., 2012), lo cual se comple- menta con la secreción de bacteriocinas por los probióticos y por los movimientos peristálticos del intestino (Isolauri et al., 2001; Monteagudo-Mera et al., 2019).
Estudios detallados sobre la diversidad de la microbiota natural en el tracto gastrointestinal de cuyes son limitados, sin embargo, se estima la presencia entre 320 y 376 géneros bacterianos en condiciones de equilibrio con el hospedero (Hildebrand et al., 2012). La presencia de esta microbiota es necesaria y beneficiosa para el animal (Turner, 2018; Adedokun y Olojede, 2019), y cual- quier desequilibrio favorece la proliferación de bacterias dañinas, afectando la salud y el desempeño animal (Chaucheyras-Durand y Durand, 2010; Young, 2012; Wen y Duffy, 2017; Alayande et al., 2020).
Tanto las bacterias de la microbiota in- testinal, como las suministradas en los probióticos, producen bacteriocinas, ácidos orgánicos y peróxido de hidrógeno, los cua- les tienen acción bactericida sobre los enteropatógenos (Umu et al., 2016; Garcia-Gutierrez et al., 2019; Alayande et al., 2020). Algunas bacterias de la flora intestinal nor- mal secretan enzimas como beta- glucuronidasas e hidrolasas de sales biliares, las cuales liberan ácidos biliares con acción inhibidora sobre las bacterias indeseables (Ferkert, 1993; Ridlon et al., 2016), mientras que otras producen enzimas digestivas y metabolitos capaces de neutralizar las toxi- nas bacterianas, aumentando la inmunidad de la mucosa intestinal (Ferkert, 1993; Coppola y Turner, 2004; Garcia-Gutierrez et al., 2019).
Alayande et al. (2020) señalan que los principales microorganismos utilizados como probióticos en producción animal pertenecen a los géneros Lactobacillus, Streptococcus, Lactococcus y Bifidobacterium. Se ha se- ñalado que los requisitos para que un micro- organismo sea considerado como probiótico son: (i) ser parte normal de la microbiota gastrointestinal del hospedero; (ii) no ser tóxi- co ni patógeno; (iii) ser capaz de adherirse al epitelio intestinal del hospedero; (iv) ser cul- tivable a escala industrial; (v) ser estable en la preparación comercial; (vi) sobrevivir a la acción de las enzimas digestivas y colonizar rápidamente el intestino del hospedero; y (vii) tener acción antagónica sobre los microorganismos patógenos (ONU-FAO, 2006; Yerlikaya, 2014; Ahasan et al., 2015; De Montijo, 2017).
Los probióticos se han utilizado en po- llos (Park et al., 2016), cerdos y lechones (Kenny et al., 2011; Dlamini et al., 2017), conejos (Bhatt et al., 2017), vacas (Uyeno et al., 2015) y equinos (Schoster, 2014). Diver- sos estudios afirman que los probióticos par- ticipan activamente en la mejora del creci- miento y el índice de conversión de cerdos y aves, similares a los obtenidos con los antibióticos promotores del crecimiento (Figueiredo et al., 2010; Mehdi et al., 2018), al participar activamente en el control de los microorganismos patógenos y no patógenos (Londoño, 2013). Sin embargo, su efecto de- pende de la especie animal, edad, estado sa- nitario y condiciones de explotación, además de la naturaleza del compuesto probiótico y de la dosis (Musa et al., 2009; Markowiak y Œli¿ewska, 2018).
Parámetros morfológicos del epitelio intestinal como longitud y ancho de las vellosidades, profundidad de la cripta, y la relación longitud de la vellosidad/profundidad de la cripta se han utilizado para investigar los efectos de los probióticos sobre la morfo- logía intestinal y proliferación celular y su re- lación con los parámetros productivos de los animales (Sen et al., 2011; Oso et al., 2013; Bhatt et al., 2017; Chao et al., 2018; Joysowal et al., 2018).
Considerando que los resultados de la suplementación de probióticos en cuyes en el Perú son aún limitados e inconsistentes (Torres et al., 2013; Cano et al., 2016; Valdizán et al., 2019), el presente estudio tuvo como objetivo evaluar el efecto de la inclusión de diferentes niveles de probiótico en cuyes so- bre los parámetros productivos y morfología intestinal.
MATERIALES Y MÉTODOS
Lugar del Estudio
El ensayo se llevó a cabo entre enero y marzo de 2016 (época de lluvias), en el gal- pón de investigación de cuyes de la Estación Experimental El Mantaro, del Centro de In- vestigaciones IVITA, ubicada en la provin- cia de Jauja, departamento de Junín (Perú), a una altitud de 3320 msnm. La evaluación histológica se desarrolló en el Laboratorio de Histología, Embriología y PatologíaAnimal de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Mar- cos, Lima.
Arreglo Experimental
Se utilizaron 50 crías machos de la línea Cuyes Reproductores Geniales, obtenidos por cruzamiento de madres seleccionadas por calidad prolífica-lechera y machos seleccio- nados por índice de conversión alimenticia obtenidos en el Centro de Investigación IVITA-El Mantaro (Jiménez y Huamán, 2010). Las madres fueron distribuidas al azar en cinco tratamientos siete días antes de la fecha probable del parto: T0: 0 ml de probiótico, T1:1 ml de probiótico, T2: 2 ml de probiótico, T3: 3 ml de probiótico y T4: 300 ppm antibiótico promotor del crecimiento (zinc bacitracina), con 10 madres por tratamiento. Las hembras fueron alojadas individualmente en pozas de maternidad de 1.0x1.14x0.72 m.
Al destete de las crías (14 días del par- to), se seleccionó aleatoriamente una cría macho de cada camada para formar 5 gru- pos de 10 cuyes por tratamiento. Los ma- chos seleccionados se acondicionaron en po- zas experimentales de 0.6x0.7x0.4 m, con piso de cemento y paredes de madera y malla. La metodología de selección y acondicionamiento de los machos fueron las mismas que se uti- lizaron en las investigaciones realizadas por Puente (2019) y Valdizán (2019).
La alimentación consistió en una dieta control, la cual consistió en afrecho de trigo y forraje [mezcla de alfalfa (Medicago sativa), ray grass italiano (Lolium multiflorum) y tré- bol rojo (Trifolium pratense)]. El forraje se ofreció diariamente en una proporción equi- valente al 50% de su peso vivo. El peso fresco ofrecido del forraje fue registrado al inicio de cada semana. El afrecho de trigo fue ofrecido 2 veces al día a una razón del 10% del peso vivo. El análisis proximal del forraje y del afrecho de trigo se presenta en el Cuadro 1. El agua fue ofrecida ad libitum en bebe- deros de arcilla, reemplazándose el conteni- do diariamente. El efecto de los tratamientos sobre los parámetros productivos y morfolo- gía intestinal fue evaluado desde el destete hasta los 70 días de edad de los cuyes.
Probiótico y Antibiótico Promotor de Crecimiento (APC)
Los microorganismos utilizados en el probiótico fueron Enterococcus hirae, Lactobacillus reuteri, L. frumenti, L. johnsonii, Streptococcus thoraltensis y Bacillus pumilus, y corresponden al mismo consorcio empleado en los estudios de Torres et al. (2013) y Puente et al. (2019). Las especies bacterianas fueron aisladas de la mucosa de yeyuno e íleon de cuyes neonatos y de adultos, cultivadas en medios enriqueci- dos y medios diferenciales (Porturas, 2011) e identificadas por biología molecular (Castillo, 2006). El consorcio es elaborado por Reinmark SRL (Perú) y comercializado bajo el nombre de "Biomodulador de Cuyes".
La metodología de aplicación del probiótico en este experimento fue la misma utilizada por Valdizán et al. (2019): las crías recibieron la suplementación pertinente a los tratamientos que fueron asignadas las ma- dres al tercer día de nacidas y por cuatro días consecutivos. Al destete se reinició la aplicación de los tratamientos T1, T2 y T3 por cua- tro días consecutivos y en las mismas dosis aplicadas previamente. La suplementación se repitió a partir del día 42 del nacimiento por cinco días consecutivos. Este programa de aplicación persigue (i) una siembra inicial de bacterias benéficas en el intestino del recién nacido para evitar la colonización de bacte- rias patógenas; (ii) una resiembra en el des- tete, momento que ocurren cambios en la dieta y de gran estrés en el animal, desplazando a las bacterias patógenas que pueden aprove- char estos cambios; y (iii) propiciar una me- jor salud intestinal en el inicio del desarrollo y engorde del animal. En los tratamientos T1, T2 y T3, la suspensión probiótica fue admi- nistrada vía oral con una jeringa de 1 ml. En T0 y T5 la suspensión fue reemplazada con agua destilada. El APC empleado fue zinc bacitracina (Promozimb 10%, Laboratorios CUSA). Se usaron 3 kg de Promozimb por cada tonelada de afrecho de trigo.
Parámetros Productivos
Se avaluó la ganancia de peso (GP = Peso final - Peso inicial), consumo total de materia seca (CTMS = Materia seca ofreci- da - Materia seca residual) y conversión ali- menticia (ICA = CTMS/GP).
Morfología Intestinal
El sacrificio de los cuyes se realizó a los 56 días del destete mediante desnucado y degüello. Los cuyes se evisceraron y del intestino delgado se tomaron segmentos de 1 cm de largo del duodeno (a 3 cm del píloro), del yeyuno (sección media de la medición total de las asas yeyunales) y del íleon (a 3 cm de la unión ileocecal). Los segmentos fueron fi- jados por 24 horas en formol tamponado 10%, se redujeron en secciones de 4-5 mm de lar- go, y se lavaron y deshidrataron con alcohol etílico 70%. Luego, fueron aclaradas en xilol y se les incluyó en parafina para obtener cor- tes transversales de la mucosa intestinal de 5 mm de espesor. Las láminas resultantes fue- ron teñidas con hematoxilina-eosina (Luna, 1968).
Los parámetros de morfología intesti- nal evaluados microscópicamente fueron: lon- gitud (LV) y ancho (AV) de la vellosidad in- testinal, profundidad de la cripta de Lieberkühn (PC) y la relación longitud/pro- fundidad (LV/PC). Se utilizó el protocolo empleado por Vallejos (2014) y Zhang et al. (2005) para realizar las mediciones, las cua- les fueron expresadas en milímetros. En cada corte transversal se eligieron de 7 a 10 cam- pos a un aumento de 100X, procurando que en cada campo se observe toda la circunfe- rencia del corte intestinal. En cada campo se procuró tener entre 10 y 20 vellosidades con sus respectivas criptas. Solo se midieron las vellosidades y las criptas que estaban inte- gras. El largo de la vellosidad fue medido desde su ápice hasta la entrada de la cripta de Lieberkühn. El ancho de la vellosidad fue medido como una línea perpendicular a la sección media de la vellosidad. La profundi- dad de cripta de Lieberkühn fue medida des- de la entrada de la cripta hasta la zona basal de esta misma (Vallejos, 2014). Para las me- diciones microscópicas se empleó el micros- copio de luz Leica DM500 conectado a una computadora con el programa LAS EZ Softwareã (Leica Mycrosystems). Se calcu- ló la media de todas las mediciones por seg- mento por animal.
Análisis Estadístico
El efecto global de los niveles del probiótico y del APC sobre los parámetros productivos (GP, CTMS, ICA) y sobre los parámetros de morfología intestinal (LV, AV, PC, LV/PC) fue evaluado a través de un aná- lisis de varianza para un diseño completamen- te aleatorio con 5 tratamientos y 10 repeti- ciones, previa verificación de la normalidad de los residuos mediante la prueba de Kolmogorov-Smirnov y la homogeneidad de varianzas mediante las pruebas de Bartlett y Levene. Además, se estimó el efecto del APC a través de la prueba comparativa de Tuckey, y los patrones de respuesta lineales y cuadráticos a los niveles crecientes del probiótico a través de contrastes ortogonales (Steel et al., 1997). Los cálculos estadísticos fueron ejecutados con la ayuda del paquete Minitabâ 18.1.0 (ã2017 Minitab Inc.). El nivel de significación fue de 0.05.
RESULTADOS Y DISCUSIÓN
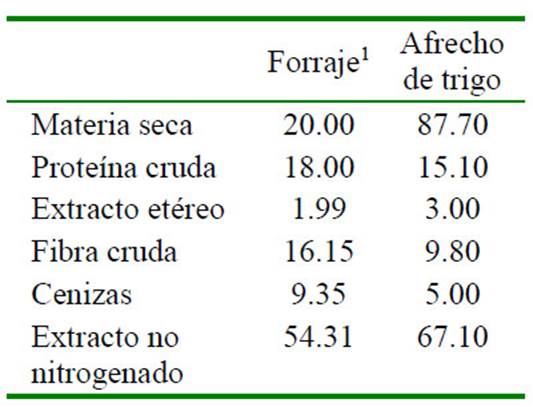
El Cuadro 2 resume las respuestas en GP, CTMS e ICA a los niveles crecientes del probiótico y al suministro del APC. Solo el ICA mostró una reducción lineal significativa como producto de los niveles crecientes del probiótico (p=0.496), sugiriendo una influen- cia positiva en el aprovechamiento de la die- ta. Los resultados son similares a los obteni- dos por Torres et al. (2013) usando el mismo probiótico en cuyes, pero con diferentes dilu- ciones. En dicho estudio se observó que el ICA se redujo significativamente en un pa- trón cuadrático de respuesta por efecto de niveles crecientes del probiótico, pero no ob- servaron respuestas significativas en térmi- nos de GP ni de CTMS.
Cuadro 2 Patrones de respuesta lineal y cuadrática en ganancia de peso (GP), consumo total de materia seca (CTMS) y conversión alimenticia (ICA) de cuyes a niveles crecientes de probiótico y al suministro de antibiótico promotor del crecimiento (APC)
1 Enterococcus hirae, Lactobacillus reuteri, L. frumenti, L. johnsonii, Streptococcus thoraltensis y Bacillus pumilus (Reinmark SRL, Lima)
Otros estudios han mostrado ausencia de respuesta o resultados inconsistentes como producto de la suplementación con probióticos en cuyes. Tapie (2013) evaluó dosis de Lactobacillus spp y Saccharomyces spp como aditivos nutricionales, sin obtener respuesta significativa para las variables peso final, consumo de alimento y conversión ali- menticia. Por otro lado, Molina (2008) en- contró que el uso de Lactobacillus acidophilus y Bacillus subtilis afecta posi- tivamente los parámetros productivos en los cuyes que recibieron el tratamiento con rela- ción al grupo control.
En pollos se han obtenido respuestas positivas a los probióticos; así, Ramírez et al. (2005) obtuvieron efectos benéficos en la GP y ICA durante los primeros 42 días de creci- miento de pollas de reemplazo al usar un probiótico a base de Lactobacillus spp. Por su lado, Arce et al. (2005) obtuvieron mejo- res pesos corporales y conversión alimenti- cia con la adición de Saccharomyces cerevisiae en la dieta de pollos parrilleros.
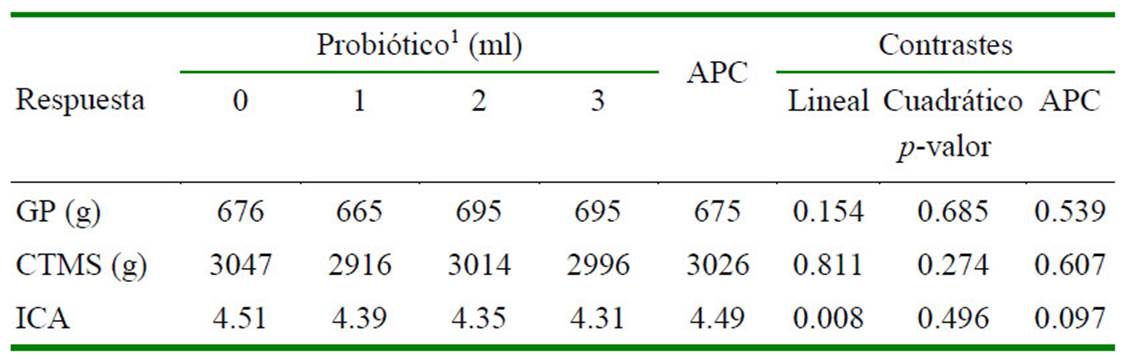
Las respuestas lineales y cuadráticas a los niveles crecientes del probiótico y a la adición del APC en términos de la morfolo- gía intestinal se resumen en el Cuadro 3 para los tres segmentos intestinales (duodeno, yeyuno e íleon). No se encontraron efectos significativos de los niveles del probiótico ni de la adición de APC sobre los parámetros de la morfología intestinal, a excepción del íleon donde los niveles crecientes del probiótico incrementaron linealmente la rela- ción LV/PC y el APC incrementó significativamente la PC.
Cuadro 3 Respuestas lineales y cuadráticas a niveles crecientes del probiótico y efecto de suministro de antibiótico promotor del crecimiento (APC) en términos de la longitud y ancho de las vellosidades intestinales y profundidad de la cripta de Lieberkühn, y de la relación longitud/profundidad (L/P) para tres secciones del intestino de cuyes de engorde
1 Enterococcus hirae, Lactobacillus reuteri, L. frumenti, L. johnsonii, Streptococcus thoraltensis y Bacillus pumilus (Reinmark SRL. Lima)
Un efecto positivo de los niveles de probiótico sobre la longitud y el ancho de las vellosidades intestinales puede estar asocia- do al estímulo de la proliferación celular por metabolitos producidos por los probióticos (Fuller, 1989; Ichikawa et al., 1999; Yan et al., 2006; Delgado et al., 2020), o a que los probióticos previenen la apoptosis por infla- mación ocasionada por patógenos a nivel de las células intestinales (Yan y Brent, 2002; Yan y Polk, 2012). Cual fuera el mecanismo, el incremento en el tamaño de las vellosidades intestinales debería traducirse en una mayor área de absorción de nutrientes (Asml et al., 2015, Wu et al., 2019) y en una preservación de la función de barrera intestinal (Yan et al., 2006; Lutful, 2009; Hemarajata y Versalovic, 2013), siendo el impacto final una mayor ga- nancia de peso y mejor conversión alimenti- cia; sin embargo, tal escenario no fue observado en este estudio, por lo menos en el duode- no y yeyuno.
En el íleon, la relación LV/PC se incrementó linealmente al aumentarse las dosis del probiótico de 0 a 3 ml y fue superior en el tratamiento con APC comparada con el control (0 ml). Un incremento en LV/PC pue- de deberse a variaciones tanto en LV como en PC. En el presente estudio, es posible que se deba a un incremento no significativo de LV y una reducción no significativa de PC. El incremento en LV/PC es favorable ya que implica una mayor capacidad de absorción, combinada con una baja tasa de renovación de enterocitos y, consecuentemente, un bajo requerimiento de mantenimiento (Van Nevel et al., 2005; Laudadio et al., 2012). Esta con- dición, sin embargo, no se reflejó en un incre- mento de la respuesta productiva de los cuyes. No existe mecanismo aparente para explicar la diferencia en respuesta en LV/PC al probiótico en el íleon con respecto a los otros segmentos intestinales. Sen et al. (2011) en- contraron que la suplementación con un probiótico (Bacillus subtilis LS 1-2) incrementaron la LV y la LV/PC en el duo- deno e íleon, pero no tuvieron efecto alguno en la PC del duodeno de pollos parrilleros. Por otro lado, Awad et al. (2009), también en pollos parrilleros, mostraron un incremento significativo de la LV y la LV/PC, tanto en el duodeno como en el íleon, como producto de la suplementación con un probiótico a base de Lactobacillus.
Al igual que en las respuestas en el com- portamiento productivo, también se encuen- tra inconsistencia en la literatura sobre las respuestas en morfología intestinal a los probióticos. Ramos et al. (2011) encontraron que la inclusión de un probiótico a base de Lactobacillus plantarum, L. bulgaricus, L. acidophilus, L. rhamnosus, Bifidobac- terium bifidum, Streptococcus thermophilus y Enterococcus faecium en la dieta de po- llos de engorde incrementaron ligeramente la LV en el duodeno, pero no tuvieron efecto sobre el AV, PC, ni en la LV/PC de yeyuno e íleon, ni en el comportamiento productivo de las aves. En lechones lactantes, no se obser- varon efectos de la inclusión de un suplemento lácteo con Lactobacillus brevis 1E1 sobre la LV, área de las vellosidades, PC y LV/PC del duodeno, yeyuno e íleon ni en la ganancia de peso de los lechones (Gebert et al., 2011). Por otra parte, De Souza et al. (2018) en- contraron que la suplementación con un probiótico a base de Lactobacillus acidop- hilus, Bacillus subtilis, Bifidobacterium bifidum y Enterococcus faecium redujo la PC en el duodeno de pollos parrilleros hasta los 42 días de crecimiento, pero no tuvo efecto alguno sobre la LV, AV, ni AV/PC, ni mejoró el comportamiento productivo de los pollos.
Se han encontrado algunas respuestas positivas en la morfología intestinal a la suplementación con probióticos. Periæ et al. (2010) encontraron que la mezcla probiótica de Lactobacillus reuteri, L. salivarius, Enteococcus faecium, Bifidobacterium animalis y Pediococcus acidilactici aisla- dos del tracto digestivo de pollos incrementó significativamente la LV y las áreas de las vellosidades en el yeyuno de pollos parrilleros, así como una mejora en el peso vivo a las 6 semanas de edad. Por su lado, Joysowal et al. (2018) ensayaron dos probióticos, uno a base de Lactobacillus acidophilus NCDC15 y el otro a base de Pediococcus acidilactici FT28, los cuales incrementaron significativamente la LV y la PC del yeyuno y la ganancia de peso de lechones a los 90 días de edad.
Finalmente, en una de las pocas revi- siones sistemáticas del efecto de probióticos en la morfología intestinal, Heak et al. (2017) realizaron un metaanálisis de 296 compara- ciones en 25 estudios controlados en pollos, publicados entre 2005 y 2016. En general, la suplementación con probióticos estuvo aso- ciada con un incremento en la LV (p<0.0001, 113 comparaciones) y con un incremento en la LV/PC (p<0.0001, 87 comparaciones). Se evidenció que la respuesta a los probióticos estuvo significativamente afectada por la raza, tipo de probiótico (comerciales vs no comer- ciales), especies probióticas, duración del tra- tamiento y ruta de aplicación).
CONCLUSIONES
A excepción de una reducción en la con- versión alimenticia, no parece haber un efecto general del probiótico "Biomodu- lador de cuyes" sobre el comportamien- to productivo de los cuyes de engorde en El Mantaro.
No se encontró evidencia concluyente del efecto del probiótico sobre la morfo- logía intestinal de cuyes de engorde. El probiótico solo tuvo efecto en el incre- mento de la relación longitud (LV) de la vellosidad intestinal y la profundidad de la cripta de Lieberkühn del segmento ileal del intestino, que debería permitir una mayor capacidad de absorción de nutrientes y un menor requerimiento de mantenimiento; sin embargo, tal condi- ción no se vio reflejada en la ganancia de peso de los animales












 uBio
uBio