INTRODUCCIÓN
La fasciolosis es una enfermedad dentro de las tres zoonosis más importantes afectan al hígado (Marcos et al.,2007), perjudicando la crianza extensiva de bovinos, caprinos y ovinos, pues causa pérdidas económicas por merma en el crecimiento de los animales, reducción en la producción de leche, lana y carne y por decomiso de vísceras (principalmente hígado) (Acha y Szyfres, 2003), implicando además gastos en tratamientos antihelmínticos (Cordero et al., 2002).
En el Perú, es una enfermedad de carácter endémico, con marcada estacionalidad, que se distribuye principalmente en valles interandinos con una prevalencia de 79.7% y en Cajamarca con una prevalencia de 84.7% (SENASA, 2019). La fasciolosis en esta región constituye un serio problema de salud pública con reportes importantes en humanos (Albán et al., 2002), sobre todo en niños observándose una prevalencia de 5.1% en el distrito de Condebamba obtenida a partir de muestras fecales (Rodríguez-Ulloa et al., 2018) y hasta 10.9% en niños positivos a la prueba de ELISA en las provincias de San Marcos, Cajabamba y Celendín (Orfanos et al., 2015).
Tras la ingestión de vegetales conteniendo larvas infectivas, el parásito atraviesa la pared intestinal para alcanzar la cápsula y el parénquima hepático, y luego de 1 a 3 meses alcanza la madurez y se ubica en los conductos biliares (Kradin, 2010). F. hepatica no solo causa daños en el hígado, sino que también puede asumir un comportamiento errático (Beltrán et al., 2004). En bovinos, a nivel de pulmón pueden ocasionar focos nodulares y cavitaciones (Maxie, 2015; Lee et al., 2016) y, ocasionalmente, neumonía granulomatosa (Zachary y McGavin, 2016).
El objetivo de este estudio fue evaluar la frecuencia de Fasciola hepatica ectópica en pulmón de bovinos sacrificados en el Centro de Beneficio Municipal de Cajamarca, Perú, y determinar las características morfológicas del parásito.
MATERIALES Y MÉTODOS
El estudio se realizó en las instalaciones del Centro de Beneficio Municipal de Cajamarca, Perú, entre julio y agosto de 2018. La zona de estudio se encuentra a 2536 msnm, presenta un clima templado-seco, con una temperatura media anual de 15.2 °C (8.5 -21.8 °C) y una precipitación pluvial promedio anual de 768 mm (SENAMHI, 2018). Se trabajó con un total de 2066 bovinos beneficiados.
Después de la inspección pulmonar practicada por la autoridad competente, se realizó una evaluación macroscópica de las lesiones en ese órgano (coágulos focales y nódulos pulmonares encapsulados y fibrosados). Posteriormente, se recolectaron los ápices y las zonas lesionadas de los pulmones, para realizar cortes transversales con el bisturí. Las muestras fueron lavadas con agua, tras lo cual se constató la presencia o ausencia de F. hepatica ectópica. Se contabilizó la cantidad de trematodos encontrados por cada animal.
Las muestras de F. hepatica ectópica fueron trasladadas al Laboratorio de Parasitología Veterinaria de la Facultad de Ciencias Veterinarias de la Universidad Nacional de Cajamarca para la caracterización morfométrica. Esto incluyó las mediciones de largo, ancho, y determinaciones de color y forma. Las medidas fueron tomadas utilizando una regla convencional con una precisión de ± 1 mm.
Fasciola en sitios ectópicos puede o no madurar a su forma adulta; por ello, para comprobar el estadio de los parásitos hallados en pulmón se empleó el protocolo de ovoposición de Dinnik y Dinnik (1954) para la determinación de la presencia o ausencia de huevos. Para ello, se emplearon 10 especímenes de 10 mm de largo en promedio, que fueron colocados en tubos con suero fisiológico e incubados a 38 °C durante 24 horas. Los resultados obtenidos fueron analizados mediante estadística descriptiva.
RESULTADOS
La frecuencia de F. hepatica ectópica en pulmón de bovinos fue de 3.68% (76/2066) con un intervalo de confianza de ± 0.8 (Figura 1). La caracterización morfométrica indicó que la Fasciola hepatica ectópica asume diferentes tamaños (Cuadro 1; Figura 2), pero con la peculiaridad de no producir huevos.
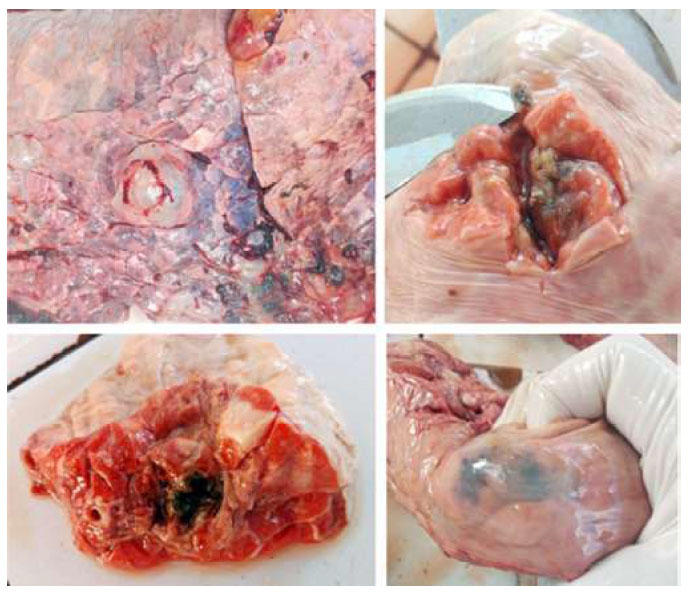
Figura 1 Lesiones macroscópicas observadas en pulmón de bovino con Fasciola hepática (Centro de Beneficio Municipal de Cajamarca, Perú, 2018)
Cuadro 1 Características morfométricas (mm) de Fasciola hepatica ectópica (n=104) hallada en pulmón de bovinos (Cajamarca, Perú, 2018)

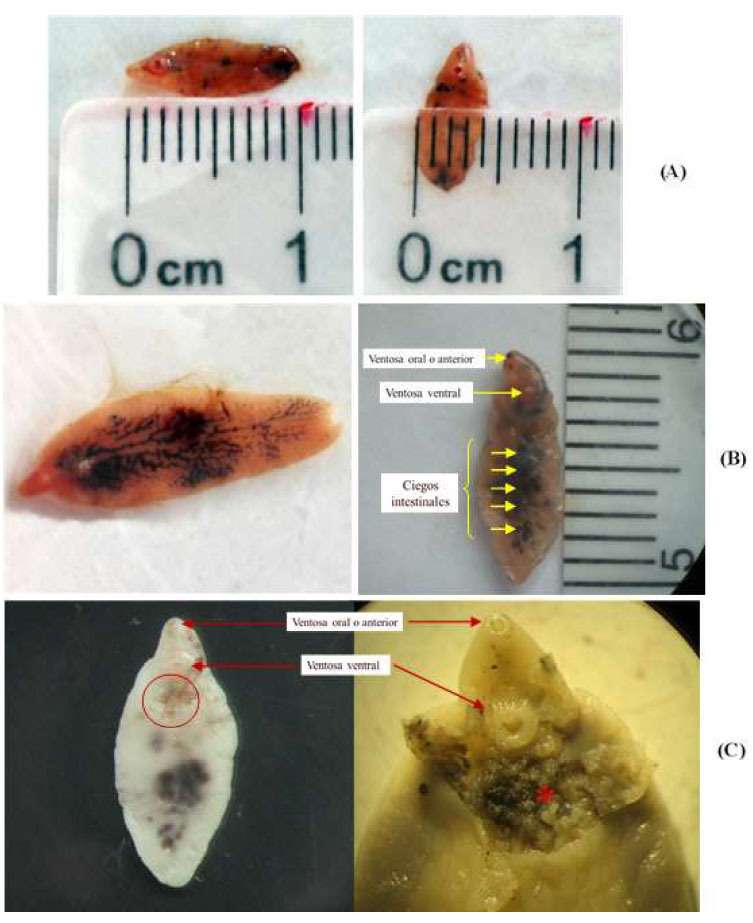
Figura 2 Fasciola hepatica en pulmón de bovino (Centro de Beneficio Municipal de Cajamarca, Perú, 2018). A. Características morfométricas (largo, ancho); B. Fasciola hepatica ectópica en pulmón de bovino. La coloración gris-marrón indica una forma adulta; C: Huevos de F. hepatica. (a) Ausencia de huevos bajo el tegumento en F. hepatica ectópica en pulmón (círculo), (b) F. hepatica procedente de conductos biliares donde se observa una masa de huevos (asterisco) bajo el tegumento.
DISCUSIÓN
La fasciolosis ectópica hace referencia a los casos en los que, durante la migración por la cavidad peritoneal, las larvas o formas inmaduras se desvían de la ruta hepática normal hacia otros órganos (Mas-Coma et al., 2014), localizándose en distintas partes del organismo, como pulmón, pleura, pericardio, meninges, ganglios linfáticos, tejido subcutáneo o útero, para el caso de humanos (Beltrán et al., 2004; Carrada-Bravo, 2007). En animales, particularmente en bovinos, la ubicación predilecta en casos de fasciolasis ectópica es el pulmón (Constable et al., 2017). En este estudio se determinó una frecuencia de F. hepatica ectópica de 3.68% en pulmón de bovinos procedentes del centro de beneficio municipal de Cajamarca; cifra mayor al 1.1% reportado por Flores (2001) en la zona del estudio.
En rumiantes existen algunos reportes de fasciolosis ectópica: F. gigantica en pulmón de caprinos (Hashemnia et al., 2015); Fascioloides magna en pulmón de bovinos (Wobeser y Schumann, 2014; Lee et al., 2016), F. hepatica en pulmón de bovinos (Adrien et al., 2013). Sin embargo, en el humano se reportan más casos de migración errática por F. hepatica; no obstante, F. gigantica produciría lesiones ectópicas con mayor frecuencia (Mas-Coma et al., 2014).
Las migraciones aberrantes de F. hepatica ocurren con mayor frecuencia en el ganado, pudiendo encontrarse parásitos encapsulados a nivel pulmonar (Ballweber, 2019). Las lesiones pulmonares generadas observadas en el presente estudio no repercutieron de manera significativa en la salud de los animales evaluados; además, el hecho de que los parásitos están encapsulados restringiría el daño tisular que estas puedan ocasionar a ese nivel. Sin embargo, se han reportado lesiones graves en otros tipos de fasciolosis ectópicas, como las embolias pulmonares causadas por Fascioloides magna en bovinos (Wobeser y Schumann, 2014; Lee et al., 2016), con resultados fatales.
Generalmente, se detectan casos humanos de fasciolosis en su fase aguda, ya que generan sintomatología clínica evidente con graves complicaciones a la salud (Espinoza et al., 2010). A diferencia de los casos humanos, en el ganado adulto generalmente esta parasitosis toma primero un curso subclínico y luego uno crónico (Rana et al., 2014), siendo muy raros los casos de infección aguda (Boray, 2007). La mayoría de las lesiones generadas por la parasitosis son de naturaleza fibrótica (López-Villacís et al., 2017), de allí que las dosificaciones antiparasitarias no tienen efecto sobre ellas, tal como se evidencia en los animales de este estudio.
En cuanto a la caracterización morfométrica, las dimensiones calculadas para F. hepatica ectópica en pulmón (10.36 x 4.31 mm) fueron numéricamente menores a las reportadas para F. hepatica en hígado (2040 x 10-15 mm) (Herenda, 2000; Acha y Szyfres, 2003), lo cual coincide con lo descrito para estas formas migrantes, pues se trata de parásitos que no alcanzaron un estado de madurez (Mas-Coma et al., 2014). El color y forma encontrados también coincide con lo descrito para F. hepatica en hígado (Quiroz, 2011; Acha y Szyfres, 2003). Por otro lado, la ausencia de huevos observada en el presente estudio se debería a que se trató de formas inmaduras, que no alcanzaron el estado de madurez necesario para la oviposición (Mas-Coma et al., 2014).
CONCLUSIONES
La frecuencia de la fasciolosis ectópica en pulmón de bovinos sacrificados en el Centro de Beneficio Municipal de Cajamarca, Perú, fue de 3.68 ± 0.8%.
Las muestras de Fasciola hepática ectópica hallada en pulmón bovino presentaron forma foliácea, con 10.36 ± 3.44 mm de largo por 4.31 ± 0.97 mm de ancho, y una coloración entre rosa pálido a marrón-grisáceo.
No se observó presencia de huevos en Fasciola hepatica ectópica en pulmón












 uBio
uBio 

