INTRODUCCIÓN
Criptococosis es una enfermedad infecciosa de distribución mundial, producida por el hongo Cryptococcus, una levadura encapsulada (Galnares-Olalde et al., 2014). Se reconocen dos especies de Cryptococcus que comúnmente causan enfermedades en el humano: C. neoformans y C. gattii (Menezes et al., 2011; Maziarz y Perfect, 2016). Esta levadura se transmite por vía respiratoria a partir de la inhalación de excretas de aves, principalmente palomas, en áreas urbanas densamente pobladas, afectando animales y personas (Acha y Szyfres, 2001; Galnares-Olalde et al., 2014; May et al., 2015).
Esta enfermedad presenta retos en aspectos como la epidemiologia, diagnóstico y terapéutica. Se han identificado múltiples mecanismos de virulencia que permiten a los criptococos infectar, diseminar y finalmente producir la muerte al humano (May et al., 2015). Sin embargo, la criptococosis humana solo se reconoció como una amenaza importante con el inicio de la pandemia del SIDA en la década del 80, cuando estas infecciones fúngicas se convirtieron en una enfermedad común en pacientes con procesos de inmunosupresión o inmunocomprometidos (Galnares-Oalde, 2014; Firacative et al., 2018).
De manera inicial, se identificaron cuatro serotipos (A, B, C, D), un híbrido AD y ocho subtipos moleculares (May et al., 2015; Maziarz y Perfect, 2016). Posteriormente, debido a las diferencias entre serotipos, se clasificaron como Cryptococcus neoformans var. neoformans, C. neoformans var. Grubii (Maziarz y Perfect, 2016) y C. gattii (Kwon-Chung et al., 2002). Se le encuentra comúnmente como una levadura encapsulada y redonda en muestras de aire, suelo y heces, aunque también como basidiosporas (Lin y Heitman, 2006).
El hongo no causa enfermedad en humanos inmunológicamente competentes, pero en individuos con compromiso del sistema inmune puede causar neumonía y meningoencefalitis (Kronstad et al., 2011; Galnares-Olalde et al., 2014). La presencia de heces de aves en el suelo incrementa la posibilidad de inhalar partículas aéreas del hongo (Criseo et al., 1995; Kuroki et al., 2004). C. neoformans ha sido aislada en muchos países (Curo, 2005; Cermeño et al., 2006; Lin y Heitman, 2006; Firacative et al., 2018). El presente trabajo tuvo como objetivo el aislamiento de Cryptococcus neoformans en heces de palomas mensajeras y de Castilla (Columba livia) en la ciudad de Lima.
MATERIALES Y MÉTODOS
Localización
El estudio se llevó a cabo entre setiembre de 2015 y enero de 2016 en lugares públicos de la ciudad de Lima, Perú, con abundancia de palomas domésticas (Columba livia), tanto de vida libre (palomas de Castilla) como palomas mensajeras. La ciudad se encuentra a una altitud de 150 msnm, en promedio, con temperatura mínima y máxima promedio de 13 y 30 °C, respectivamente y humedad relativa de 88%.
Se ubicaron espacios públicos con abundancia de palomas de Castilla para la colección de heces, que fueron denominados Iglesia 1, 2, 3 y 4, y una granja interactiva "Lugar público 1". Asimismo, las muestras de heces de palomas mensajeras se colectaron en palomares especializados de la Asociación Peruana de Colombófilos (APCO), a los cuales se les denominó como como Palomar 1, 2, 3 y 4.
Muestras y Análisis de Laboratorio
Las muestras de heces secas fueron tomadas del suelo y de los nidos de palomas entre octubre de 2015 y enero de 2016. Se tomaron 130 muestras de palomas mensajeras y 180 de palomas domésticas asilvestradas (palomas de Castilla). Se optó por colectar heces secas, considerando que el hongo desarrolla mejor en esas condiciones (Kamari et al., 2017). El número de muestras por espacio público fue calculado por amplitud de área del muestreo: 30, 40, 12 y 30 para la Iglesia 1, 2 3 y 4, respectivamente, y 68 para Lugar público 1. Para las palomas mensajeras (población finita) fue de 90, 10, 15 y 15 muestras para el Palomar 1, 2, 3 y 4, respectivamente.
Las heces secas (20-100 g) fueron colectadas en bolsas de cierre hermético y transportadas a temperatura ambiente al Laboratorio de Microbiología de la Universidad Científica del Sur, Lima, donde fueron procesadas con las medidas de bioseguridad respectivas, según la técnica descrita por Cermeño (2006). Para esto, se tomó 1 g de heces por muestra que fue disuelta en 10 ml de solución salina estéril al 0.85%, pasadas por un agitador eléctrico por 5 min y dejadas en reposo por 30 min. Se tomó 0.1 ml del sobrenadante y se sembró en tubos Falcon de 50 ml con Agar Sabouraud Dextrosa (ASD) con cloranfenicol en posición de pico de flauta. El cultivo se hizo por 2-10 días a 37 °C (Canelo y Casquero, 2000; Perfect et al., 2010). Las colonias sospechosas fueron seleccionadas por sus características típicas, como ser ligeramente redondeadas o planas, de consistencia mucoide, lisas, con olor agradable y de color crema (INS, 2007). Se utilizaron para realizar las pruebas microscópicas y bioquímicas correspondientes.
Estas fueron:
Observación de la cápsula en tinta china. En el examen directo con tinta china se visualizó la cápsula de polisacárido de C. neoformans como un halo claro y nítido alrededor del hongo (INS, 2007).
Prueba de ureasa. Las colonias sospechosas fueron inoculadas en medio Christensen e incubadas a 37 °C por 6 h (INS, 2007). Las muestras que presentaron color rojo grosella fueron consideradas como positivas.
Prueba de asimilación de carbohidratos. Las muestras que resultaron positivas a las pruebas previas fueron incubadas en agar hierro-triple azúcar a 37 °C por 18 h. Los resultados de las muestras deberían ser positivas a glucosa y sacarosa, y negativas a lactosa.
Prueba de reducción de nitratos. Se evaluó la reducción de nitratos en nitritos. Para ello, se inoculó el medio con nitrato y se incubó a 45ºC por 10 min. Se agregó al tubo dos gotas de alfa-naftilamina (reactivo A) y dos gotas de ácido sulfanílico (reactivo B). El resultado positivo a la prueba de reducción de nitratos se evidencia por un cambio de color a rojo (INS, 2007).
Prueba de la enzima fenoloxidasa. Se colocó una ansada de las colonias sospechosas sobre un papel Whatman esterilizado (2 cm2). Se añadieron 2-3 gotas de la solución L-DOPA (3.0 mg/ml) citrato férrico y se incubó a 28 ºC por un tiempo máximo de 18 h (Menezes et al., 2011). Se consideraron como positivas las muestras que produjeron una tinción marrón oscura.
Siembra en Agar CGB. Las muestras fueron sembradas en el medio canavanina glicina azul de bromotimol sódico (CGB) (Hardy Diagnostics(r)) e incubadas a 28 °C por 5 días con el fin de diferenciar C. neoformans de C. gattii (Kwon-Chung et al., 2002). El resultado positivo se evidencia por el crecimiento en el agar y un cambio de color a azul verdoso.
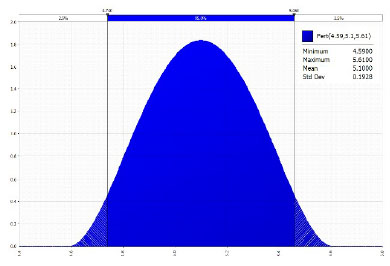
Para el análisis estadístico se establecieron tablas de frecuencias e intervalos de confianza al 95%. Se determinó la curva de distribución Beta Pert para la proporción de Cryptococcus neoformans mediante el programa de análisis de riesgo @Risk 5.5 (r) con 1000 interacciones.
RESULTADOS
Se encontró una frecuencia de 5.16% (16/310), IC95% de 2.7-7.6% de muestras positivas a C. neoformans (Cuadro 1). En la distribución estocástica para análisis de riesgo se determinó una frecuencia de 4.595.61% al 95% (Figura 1) de muestras positivas a C. neoformans en el caso de las palomas de Castilla, mientras que no se encontraron muestras positivas para las palomas mensajeras.
Cuadro 1 Frecuencia de Cryptococcus neoformans según el lugar de muestreo y tipo paloma en la ciudad de Lima (n=310)
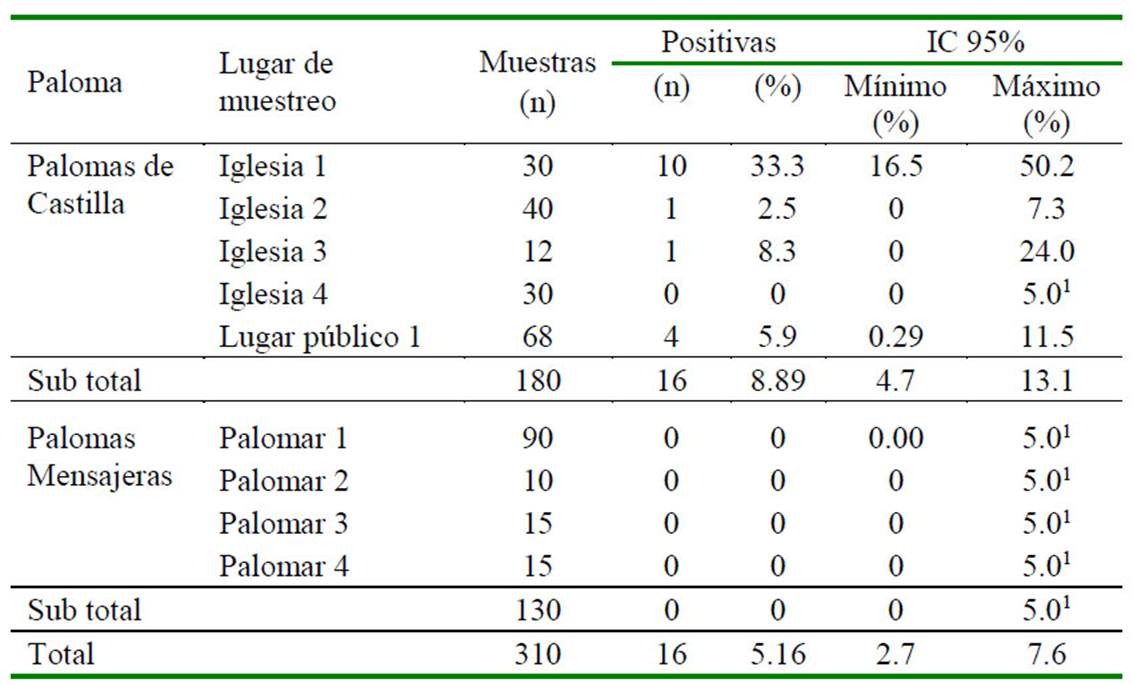
1 Debido al margen de error de muestreo establecido, se considera un 5% como valor máximo
DISCUSIÓN
Cryptococcus neoformans es un hongo común en las heces de aves y otros ambientes (Kamari et al., 2017). El presente estudio determinó una proporción de 5.16% (16/310) de muestras de heces de palomas positivas a C. neoformans en la ciudad de Lima; corroborando la presencia de este patógeno en Lima (Huamán et al., 2018). Las frecuencias de muestras positivas en heces de palomas en otros países varían desde 1.4% hasta valores tan altos como 34% (Curo, 2005; Cermeño et al., 2006; Zarrini et al., 2010; Soltani et al., 2013; Huamán et al., 2018), así como en heces de canarios y gallinas (Criseo et al., 1995; Kuroki et al., 2004; Cafarchia et al., 2006). Esto evidencia su importancia como patógeno y el riesgo que representa para la salud pública (Kuroki et al., 2004; Messina et al., 2014; Firacative et al., 2018), afectando el pulmón y el sistema nervioso central, aunque puede afectar también otros órganos como el riñón, próstata, y huesos (Galnares-Olalde et al., 2014). Por otro lado, se evidencia la asociación que hay entre este hongo y las heces de las palomas (Lin y Heitman, 2006; Acha et al., 2001; Zarrini et al., 2010; Soltani et al., 2013).
La ausencia de C. neoformans en las muestras de heces de las palomas mensajeras criadas en cautiverio en los cuatro palomares del estudio se debería posiblemente al manejo de los ambientes de crianza y a las actividades periódicas de desinfección que se realizan calendarizados, limpieza de excretas del suelo y de los nidales (Krangvichain et al., 2016; Huamán et al., 2018).
La temperatura ambiental promedio en la ciudad Lima varía entre 18 y 30 °C y se conoce que los hongos del género Cryptococcus tienen la habilidad de crecer en un rango variado de temperatura, En el trabajo de Cermeño et al. (2006) se tuvieron temperaturas entre 23.8 y 28.2°C, en el de Zarrini et al. (2010) entre 19 y 32 °C. Por otro lado, solo C. neoformans y C. gattii tienen la capacidad de crecer a temperaturas mayores de 35 °C, de allí que se utiliza 37 °C como temperatura estándar para su desarrollo en el laboratorio y como una de las primeras pruebas diferenciales (Perfect et al., 2010).
El reporte de Cryptococcus neoformans en Lima es de importancia epidemiológica, debido a su relevancia para la salud pública, reconocida como la principal causa de meningitis micótica en el mundo (Firacative et al., 2018); relacionada a infecciones por el virus del VIH, donde se identifica su rol oportunista (Messina et al., 2014).












 uBio
uBio