INTRODUCCIÓN
Dentro de los múltiples factores que pueden afectar la sanidad en los equinos, el parasitismo gastrointestinal ocupa un lugar destacado (Godéski et al., 2017). Sus efectos se traducen en pérdidas económicas derivadas de la disminución en la tasa de crecimiento y su desempeño, así como de los costos de los tratamientos antihelmínticos (Martínez-Valladares et al., 2015). La literatura reporta que las especies de helmintos de mayor importancia en la industria equina son Parascaris spp y los grandes y pequeños Strongylus (Fischer et al., 2015; Anziani y Arduso, 2017; Sallé et al., 2017).
En general, el control de parásitos intestinales en equinos se realiza bajo esquemas prefijados o en forma esporádica, siendo poco utilizados los análisis coprológicos como criterio base para la terapéutica (Anziani y Ardusso, 2017). A esto se suma la administración rutinaria de antihelmínticos de amplio espectro, siendo esta práctica considerada como el factor determinante para el desarrollo de resistencias (Scott et al., 2015; Scheuerle et al., 2016; Tzelos y Matthews, 2016; Godéski et al., 2017), y el motivo por el que actualmente una gran parte de los principios antihelmínticos disponibles son poco eficaces; situación que se agrava debido a las pocas posibilidades de que nuevos productos estén disponibles en un futuro cercano (Scott et al., 2015; Beasley et al., 2017).
La resistencia a los antihelmínticos se genera a partir de una presión de selección sobre los parásitos, modificando dinámicas genéticas que se produce lentamente en el tiempo, luego de las cuales los parásitos sobrevivientes al tratamiento trasmiten alelos que confieren un fenotipo resistente a su progenie (Vidyashankar et al., 2012; Anziani y Fiel, 2015; Anziani y Ardusso, 2017). El fenómeno de resistencia antihelmíntica se ha convertido en un problema creciente en muchos países (Fischer et al., 2015), siendo agravado por el movimiento frecuente de equinos a nivel nacional e internacional (Beasley et al., 2017).
Se han descrito múltiples técnicas para evaluar el estado de la resistencia a antiparasitarios en poblaciones animales. Los métodos in vivo son actualmente considerados como de referencia para la determinación de la resistencia en los equinos. La prueba de reducción de recuento de huevos fecales (FECRT, por sus siglas en inglés) es el más utilizado a nivel mundial, calculando el diferencial del conteo de huevos por gramo (HPG) de materia fecal antes y después de la administración de un principioantihelmíntico determinado, incluso en condiciones de campo (Vidyashankar et al., 2012; Von Samson-Himmelstjerna, 2012;Anziani yArdusso, 2017; Beasley et al., 2017). Para llevarlo a cabo se debe realizar un análisis coprológico previo a la desparasitación, seguido de un segundo análisis a los 7, 10 o 14 días después del tratamiento (de acuerdo con el principio activo y el ciclo de vida del parásito de interés). Una reducción de menos del 90-95% en el conteo de HPG indica resistencia al principio activo administrado (Tzelos y Matthews, 2016).
Se ha reportado resistencia de diversas especies de parásitos a los benzimidazoles (BZD), tetrahidropirimidinas, y lactonas macrocíticas (MLs) a nivel mundial (Felippelli et al., 2015; Nielsen, 2016; Tzelos & Matthews, 2016; Sallé et al., 2017). Sin embargo, son pocos los estudios en Colombia que han explorado la efectividad antihelmíntica en caballos de diversos compuestos. Así, Prada y Romero (2011) reportaron una sensibilidad superior al 92.8% a la IVM para pequeños Strongylus en cuatro municipios de Casanare, mientras que Herrera et al. (2015) reportaron una sensibilidad del 99% de diversas especies de parásitos a la doramectina en Córdoba. El presente estudio tuvo como objetivo determinar la efectividad de tres principios antihelmínticos usados comúnmente en el control de nematodos gastrointestinales en caballos del Valle de Aburrá del Departamento de Antioquia (Colombia) mediante el método FECRT.
MATERIALES Y MÉTODOS
Aspectos Éticos
El estudio fue aprobado por el Comité de Ética de la Facultad de Medicina Veterinaria de la Corporación Universitaria Remington (Ley N.° 001 de febrero de 2015). Todos los procedimientos fueron realizados teniendo en cuenta las normas técnicas para el manejo y sujeción de animales, enmarcados en el cumplimiento de la declaración universal de los derechos de los animales, y de los principios éticos internacionales para la investigación biomédica con los animales del Consejo de Organizaciones Internacionales de Ciencias Médicas (CIOMS), establecida por la Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura (UNESCO) y la Organización Mundial de la Salud (OMS) en 1949 y de la Ley 84 de octubre 27 de 1989 (Osorio, 2006), así como la ley 1774 de 2016 del Gobierno de Colombia.
Área de Estudio
Se realizó un estudio transversal de enero a diciembre de 2015 en el área metropolitana del Valle de Aburrá (Antioquia, Colombia). El Valle está formado por 10 municipios: Barbosa, Girardota, Copacabana, Bello, Medellín, Itagüí, Envigado, La Estrella, Sabaneta y Caldas. Se encuentran a una altitud promedio de 1538 msnm, con una temperatura promedio anual de 24 °C (Correa et al., 2009).
Animales y Tratamientos
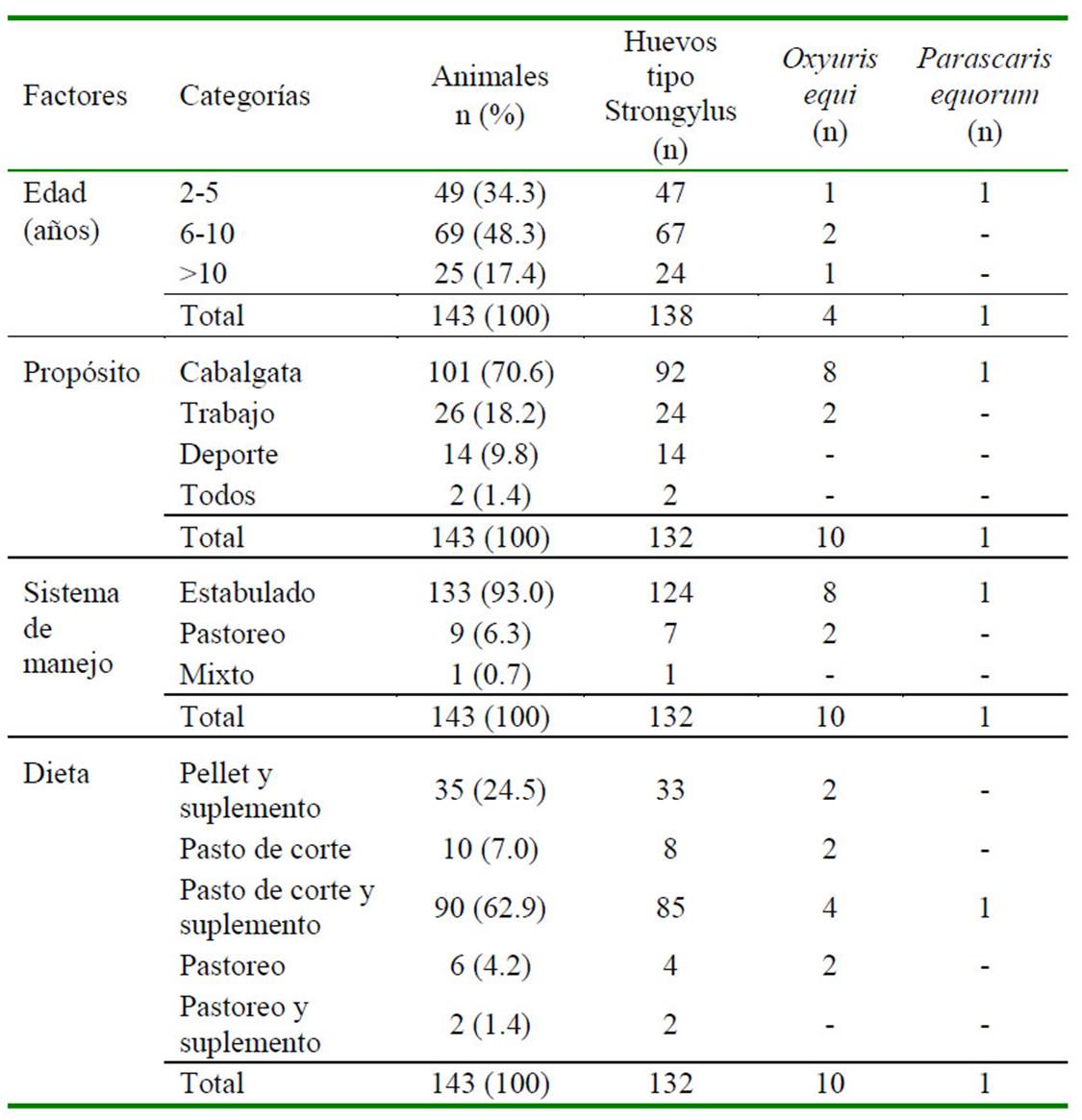
Se trabajó en primera instancia con una muestra no probabilística y a conveniencia de 289 caballos, los cuales fueron clasificados por edad (según la cronología dentaria), propósito, sistema de alojamiento y dieta. De estos, solo 143 cumplieron los criterios de inclusión, que eran ser animales mayores de dos años, que hubieran registrado su última desparasitación en un tiempo no menor de 60 días previo al estudio, y que tuvieran recuentos fecales >100 HPG (independientemente del parásito identificado). El peso de cada animal se registró utilizando una cinta métrica comercial específica para equinos (Hoffmann et al., 2013).
Los animales se asignaron de manera aleatoria a tres grupos de tratamiento (fenbendazol [FEN], ivermectina [IVM] o pamoato de pirantel [PYR]). Inmediatamente después de la colección de la primera muestra de materia fecal se realizó la administración oral de los principios activos correspondientes. La IVM se administró a 200 µg/kg (Equide(r), Genfar, Colombia), la FEN a 7.5 mg/kg (Retyfen(r), Mercavet, Colombia) y el PYR a 6.6 mg/kg (Equintel(r), Servinsumos, Colombia).
Muestras y Análisis de Heces
Las muestras de materia fecal fueron colectadas antes del tratamiento (día 0) y al día 60 pos-tratamiento. En todos los casos, las muestras para el análisis coprológico se recolectaron directamente del recto de cada animal, se colocaron en recipientes estériles de 100 ml, se almacenaron a 4-6 °C y se enviaron a un laboratorio clínico de referencia en la ciudad de Medellín antes de 12 horas. Para el análisis cuantitativo de HPG se utilizó la técnica de McMaster. Los parásitos se identificaron mediante la observación directa de los huevos y sus características diferenciales de acuerdo con pautas publicadas anteriormente (Thienpont et al., 2003; Molento et al., 2012). Así mismo, se registró la edad (según la cronología dentaria), propósito zootécnico, sistema de alojamiento, producto de la última desparasitación y la dieta de cada caballo.
Reducción de Recuento de Huevos Fecales (FECRT)
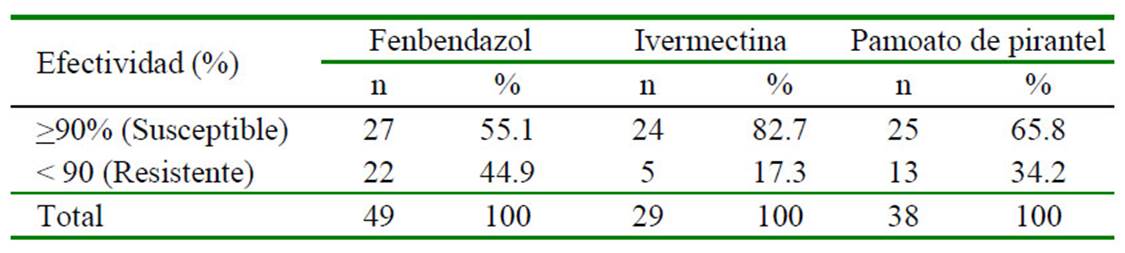
Los resultados de FECRT se calcularon en analogía con las recomendaciones de la Asociación Mundial para el Avance de la Parasitología Veterinaria (WAAVP) y en línea con estudios de resistencia antihelmíntica equina (Lester et al., 2013; Relf et al., 2014). Considerando que cada caballo es su propio control, la efectividad del medicamento se define como el cambio relativo en el conteo de huevos después del tratamiento, según la fórmula siguiente: Efectividad = [HPG en pretratamiento hph en pos-tratamiento / hpg en pre-tratamiento] * 100. Los resultados porcentuales para efectividad fueron considerados como "resistente" (<90%) y "susceptible" (>90%).
Análisis de los Datos
La información generada se ingresó en las hojas de cálculo de Excel (Microsoft Corp) y luego se exportó a STATA 15.0 (StataCorp, USA) para el análisis estadístico. Se calcularon estadísticas descriptivas para todas las variables de interés, en función del número total de resultados del recuento de huevos fecales de helmintos.
RESULTADOS
Si bien, inicialmente se tuvo una distribución homogénea del número de individuos asignados a cada uno de los principios activos de interés; sin embargo, la distribución de animales no fue la esperada al final del estudio (FEN: 63 caballos; IVM: 42 caballos; PYR: 38 caballos), debido a que no todos cumplieron con el conteo mínimo de HPG en el análisis coprológico, y a que algunos otros fueron comercializados o trasladados hacia otras pesebreras sin previo aviso.
Según la información recopilada acerca del principio activo utilizado en la última desparasitación, se encontró que la mayoría de los encargados de los animales y quienes respondieron al cuestionario no recordaban el producto utilizado (27.9%; 40/143). No obstante, los demás indicaron que el producto utilizado fue IVM (25.2%; 36/143), FEN (23.1%; 33/143), IVM + praziquantel (11.9%;17/143), metrifonato (6.3%; 9/143), mebendazol (2.8%; 4/143), oxibendazol (1.4%; 2/143) y combinaciones de prazicuantel + IVM + FEN (1.4%; 2/143).
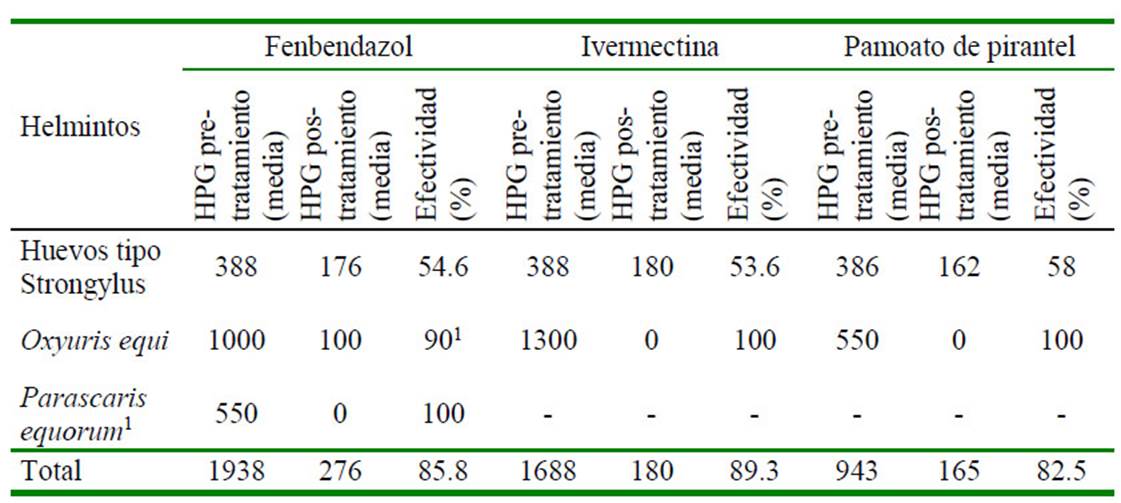
Los datos descriptivos para la población de estudio según los hallazgos coprológicos se muestran en el Cuadro 1. La mayor parte de la población se encontraba en el rango de 6 a 10 años, y eran mantenidos bajo estabulación y utilizados para cabalgata (monta recreativa). Los promedios de HPG pre y postratamiento y la distribución general de la efectividad de los tres principios antihelmínticos se muestran en los Cuadro 2 y Cuadro 3, respectivamente.
Cuadro 1 Hallazgos descriptivos de nematodos gastrointestinales en 143 caballos del Valle de Aburrá, departamento de Antioquia (Colombia)
Cuadro 2 Media de HPG pre y pos-tratamiento con tres principios antihelmínticos usados en 143 caballos del Valle de Aburrá (Antioquia, Colombia)
1 Un solo dato disponible
DISCUSIÓN
Es importante considerar que, en la actualidad, la diseminación geográfica de los genes de resistencia puede darse fácilmente entre diversas poblaciones, ya que en Colombia, así como en otros países, es común el trasporte de equinos a nivel nacional e internacional para distintos fines, pudiendo este factor tener un efecto más significativo sobre el fenómeno de resistencia que la intensidad de tratamiento que se tenga en una región o predio específico (Beasley et al., 2017).
En el presente estudio se evidenció que el control de parásitos gastrointestinales se realiza mediante prácticas de desparasitación frecuente, sin un criterio técnico-científico para su ejecución, pues el 72.1% de los propietarios de los animales reportaron una desparasitación reciente (inferior a 3 meses). En ningún caso se contó con análisis de HPG como fundamento para la desparasitación.
Adicionalmente, el 27.9% de los encuestados no recordaban el producto utilizado en la desparasitación. Matthews (2014) indica que muchos caballos siguen siendo sometidos a tratamientos antihelmínticos regulares sin prestar atención a su efectividad.
En el Reino Unido, Alemania e Italia se ha reportado alta resistencia a los antihelmínticos BZD, IVM, moxidectina, tetrahidropirimidina, PYR y MLs (Von SamsonHimmelstjerna, 2012; Fischer et al., 2015), mientras que en Argentina se reportó resistencia de los ciatostomideos a los bencimidazoles (Cerutti et al., 2012). Por otro lado, Martínez-Valladares et al. (2015) reportaron que los diversos medicamentos utilizados en establecimientos de caballos en España se confirmaron como eficaces contra Strongylus, en tanto que en Brasil se determinó que la IVM, moxidectina, abamectina tuvieron una adecuada efectividad (Godéski et al., 2017),
En el presente estudio, la IVM fue el principio activo con la mayor efectividad en la población de estudio (82.7%), seguido del PYR (65.8%). Adicionalmente, ninguno de los principios activos evaluados mostró ser efectivo contra parásitos que producen huevos tipo Strongylus (e.g. ciathostomideos, Strongylus spp, Trichostrongylus spp), mientras que la IVM y el PYR mostraron ser efectivos para el control de Oxyuris equi. Esto permite indicar el desarrollo de resistencia en nematodos gastrointestinales que afectan los caballos del área de estudio.
El control de parásitos gastrointestinales a nivel mundial en equinos se basa únicamente en tres grupos de antihelmínticos: BZD como el fenbendazol y el oxibendazol, las MLs como la IVM, y la moxidectina y las tetrahidropirimidinas como el PYR. Hasta ahora, estos fármacos se han considerado altamente eficaces contra nematodos (BZD y ML) y cestodos (tetrahidropirimidinas) y han sido usados con frecuencia (Matthews, 2014; Peregrine et al., 2014; Gokbulut y McKellar, 2018). Sin embargo, los reportes de resistencia a BZD, PYR y, más recientemente, a MLs no son infrecuentes, haciendo de este un problema cada vez mayor. Se hace necesario, entonces, adoptar estrategias que equilibren el uso de antihelmínticos para el control de parásitos, limitando la presión de selección en las poblaciones parasitarias (Prada y Romero, 2011; Reinemeyer, 2012; Matthews, 2014; Cernea et al., 2015; Tzelos y Matthews, 2016; Godéski et al., 2017; Bellaw et al., 2018).
En Colombia se ha reportado el uso de IVM, moxidectina y doramectina como tratamiento antiparasitario en equinos. Los dos primeros principios activos se encuentran disponibles en una formulación oral, mientras que la doramectina solo se encuentra disponible en formulación inyectable (Herrera Benavides et al., 2015). Sin embargo, en el presente estudio los principios activos que se reportaron con mayor frecuencia fueron IVM, FEN y la combinación IVM-praziquantel. Por otro lado, llama la atención el uso de metrifonato (Neguvon(r)), el cual no se ha encontrado reportado en la literatura como método de control habitual en equinos.
Los métodos in vivo para la determinación de resistencia antihelmíntica son actualmente considerados como gold standard para la especie equina. En estos, se incluye la prueba de efectividad controlada, en la cual se determina mediante necropsia el número de parásitos adultos que sobreviven al tratamiento (Bellaw et al., 2018; Felippelli et al., 2015), y el FECRT, en el cual se compara el HPG antes y después del tratamiento, no requiriéndose el sacrificio de los animales evaluados. Este último es el más difundido, ya que puede usarse bajo condiciones de campo, no requiere modificar el manejo habitual del establecimiento y actúa como prueba tamiz de efectividad luego del tratamiento antihelmíntico (Vidyashankar et al., 2012; Von Samson-Himmelstjerna, 2012; Anziani y Ardusso, 2017).
En muchos países se ha utilizado el recuento de huevos en heces (FEC, por sus siglas en inglés) como parámetro para iniciar un tratamiento antihelmíntico, evitando el uso de los antiparasitarios en momentos inadecuados para disminuir la posibilidad de generación de resistencia (Scheuerle et al., 2016). Se han propuesto valores de corte para el uso de los tratamientos antihelmínticos en el rango de 100-500 HPG (Nielsen et al., 2014). Sin embargo, algunos estudios han reportado que incluso los caballos con un HPG por debajo de 100 pueden albergar más de 100 000 nematodos adultos, debido a que existen estadios de parásitos no luminales tales como las larvas de los grandes Strongylus y los ascaridios o las larvas enquistadas de ciatostomideos. Estos estados tienen un potencial patogénico considerable y no producen huevos (Nielsen et al., 2010). Debido a esto, no se puede realizar una correlación directa entre el conteo de huevos y el conteo de parásitos adultos, por lo que no puede derivarse una información diagnóstica o pronóstica sólida del nivel de recuento de huevos (Nielsen et al., 2010).
Algunas desventajas del FECRT incluyen que el FEC no refleja la carga parasitaria real y que solo muestra la producción parasitaria de huevos en el momento del muestreo, por lo que solo permite hacer una estimación de la efectividad del antihelmíntico utilizado en la prueba (Kaplan, 2002). Adicionalmente, los datos de FECRT generalmente no siguen una distribución gaussiana y los métodos de determinación de HPG presentan una gran variabilidad intrínseca; por lo que, generalmente, los métodos estándar para calcular los intervalos de confianza no son válidos debido a su gran variabilidad, especialmente si se trabajan grupos pequeños de animales (Vidyashankar et al., 2012). Esta variabilidad de los datos de FECRT, incluidas las frecuentes observaciones de cero huevos, fenómeno observado también para el presente estudio, presentan un desafío para los métodos estadísticos estándar, lo que lleva a una variedad de recomendaciones para los métodos apropiados. Se requiere de una actitud conservadora antes de establecer el estatus de resistencia bajo condiciones de campo y no hay un acuerdo universal sobre el método para calcular el FECRT, reportándose el uso de diferentes ecuaciones, con o sin la inclusión de un grupo de control (Vidyashankar et al., 2012; Fischer et al., 2015; Anziani y Ardusso, 2017).
Buscando identificar la presencia de resistencias en la etapa más temprana posible, y en ausencia de ensayos moleculares o in vitro viables, se podría utilizar la medición del periodo de reaparición de huevos (ERP, por sus siglas en inglés), la cual podría resultar altamente beneficiosa, pese a lo laborioso y costosa que puede resultar el definir los umbrales de ERP para determinar el estado de resistencia. El acortamiento de los ERP es una advertencia de resistencia inminente (Beasley et al., 2017). En este estudio no se evaluó el ERP, sin embargo, se recomendaría realizar futuras investigaciones que determinen este periodo para cada uno de los antihelmínticos usados comúnmente en condiciones de campo












 uBio
uBio