INTRODUCCIÓN
Los camélidos sudamericanos (CSA) representan un recurso pecuario y genético de gran importancia social, económica, cultural y científica para los países de la Región Andina (Fernández-Baca, 1991; FAO, 2005). Los CSA han ido adquiriendo una capacidad notoria de adaptación a las condiciones adversas medioambientales del altiplano andino. Su hábitat está ubicado entre los 3800 y 5000 msnm, alimentándose de pasturas de baja calidad nutricional existentes en la zona; no obstante, estos animales son capaces de convertir la vegetación nativa en fibra de alta calidad y carne con alto contenido proteico (Fernández-Baca, 1991; Aba, 2014).
Pese a la resistencia y rusticidad, su productividad se ha visto disminuida por la baja eficiencia reproductiva, especialmente por la elevada mortalidad embrionaria, que puede alcanzar hasta el 50% en los primeros 30 días de gestación (Fernández-Baca et al., 1970, Ratto et al., 2011). Para revertir esta situación, se ha ampliado el conocimiento sobre su fisiología reproductiva y el desarrollo de nuevas tecnologías (Aba, 2014). La actividad ovárica en los CSA se presenta en ciclos de desarrollo folicular semejante a lo evidenciado en otros mamíferos, pero sin la presencia de un cuerpo lúteo. El desarrollo folicular ha sido clasificado en tres estadios: crecimiento, estática y regresión (Vaughan et al., 2004).
El estudio del fluido folicular es fundamental, puesto que proporciona el microentorno para el desarrollo de los ovocitos, pudiendo tener un rol importante en la determinación de la calidad de los ovocitos y el potencial para lograr el desarrollo embrionario (Albohomsen et al., 2011, Wallace et al., 2012). En alpacas existe limitada información sobre la composición del fluido folicular, por ello el estudio de los componentes bioquímicos del fluido folicular durante el desarrollo folicular permitirá conocer los cambios que ocurren en el entorno del ovocito durante el desarrollo del folículo. Esta información podría utilizarse como un parámetro de evaluación de la calidad de los ovocitos, que estaría a su vez, directamente relacionado con la fertilidad (Matoba et al., 2014). Es así que el objetivo del presente estudio fue determinar la concentración de glucosa, proteínas totales, colesterol y triglicéridos en los estadios de crecimiento, estática y regresión del folículo ovárico de la alpaca.
MATERIALES Y MÉTODOS
Lugar de Estudio
Las muestras del fluido folicular se obtuvieron durante los meses de febrero y abril de 2016 en el CIP-Chuquibambilla de la Universidad Nacional del Altiplano, localizado en la provincia de Melgar, región de Puno, Perú. El análisis bioquímico se realizó en el Laboratorio de Fisiología de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima.
Animales
Se utilizaron 27 alpacas hembra adultas Suri, de 4-7 años, vacías. Estos animales fueron mantenidos fuera del contacto con los machos, pero recibieron las mismas condiciones de manejo y alimentación a base de pasturas naturales que el resto del rebaño. Las hembras fueron seleccionadas con base a la presencia de un folículo >7 mm de tamaño, determinado a través de un ecógrafo ALOKA SSD 500 equipado con un transductor lineal de 7.5 MHz.
Sincronización de la Onda Folicular
Con el propósito de obtener un crecimiento folicular uniforme y disponer de los folículos dominantes en los diferentes estadios de desarrollo folicular en estudio, se procedió a la sincronización de la onda folicular mediante la administración de 1 ml de un análogo de GnRH (0.0042 mg de acetato de buserelina - Conceptase(r) - Agrovet Market). La ovulación se verifica por ecografía a las 48 horas de la aplicación hormonal mediante la desaparición del folículo dominante. Este procedimiento permitió la emergencia de una nueva onda folicular y la posterior formación del folículo dominante en los estadios en estudio.
Identificación Ecográfica
Se realizaron evaluaciones ecográficas cada dos días para identificar el estadio de desarrollo del folículo dominante. A partir del día 9 de la sincronización se distribuyeron los animales en tres grupos: G1 (n=9): animales con folículos >7 mm en estadio de crecimiento (con incremento de tamaño en dos observaciones; G2 (n=9): animales con folículos >7 en estadio estático (sin variación en el tamaño en al menos dos observaciones); G3 (n=9): animales con folículos >7 en estadio de regresión (con disminución de tamaño en dos observaciones).
Obtención del Fluido Folicular
La aspiración del fluido folicular se hizo con una aguja N.° 19 acoplada en un transductor transvaginal de 5.0 MHz y con un ecógrafo ALOKA SSD500. El procedimiento consiste en ubicar el transductor en el fondo de la vagina, y una mano en el recto. Se fija el ovario contra la punta del transductor permitiendo visualizar tanto el ovario como el folículo dominante en la pantalla del equipo de ultrasonografía, se impulsa la aguja suavemente para que penetre la pared vaginal y el folículo. El contenido folicular aspirado es recolectado en un tubo Falcón de 15 ml y mantenido a una temperatura de 37 °C en baño maría. Para la aspiración del fluido folicular se utilizó un medio compuesto de 10 000 UI/L de heparina y 50 µg/l de gentamicina.
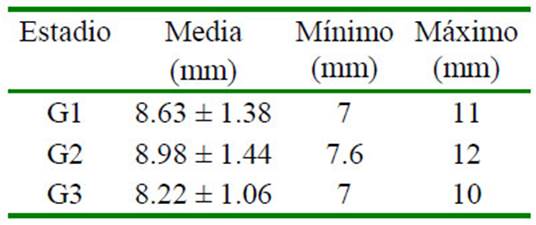
Cuadro 1 Diámetro folicular en el día 9 de la sincronización folicular con un análogo de GnRH en alpaca según el estadio de desarrollo folicular (9 alpacas por grupo)
El líquido folicular fue centrifugado a 700 g por 20 min para separar los contenidos celulares. El sobrenadante fue colocado en viales de 2 ml y almacenados en nitrógeno líquido hasta su análisis.
Análisis Bioquímico
Se determinaron los niveles de glucosa, proteína, albumina, triglicéridos y colesterol del líquido folicular a través de kits comerciales (FAR Diagnostics, Italia) específicos para cada uno de ellos, siguiendo las especificaciones del fabricante, utilizándose 500 µl del reactivo y 5 µl de la muestra del fluido folicular. Los análisis fueron realizados con un analizador bioquímico semiautomático (SINOWA, China).
Análisis Estadístico
El análisis se realizó mediante el programa estadístico SPSS 25. Se verificó que los valores presenten una distribución normal antes de realizar el análisis de varianza para comparar las medias de los diferentes estadios (G1, G2, G3) de cada componente bioquímico. Las diferencias entre medias fueron evaluadas mediante la prueba de Tukey, considerado una significancia de p<0.05.
RESULTADOS
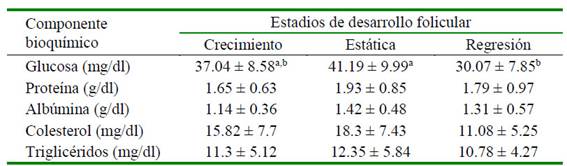
El diámetro folicular al momento de la aspiración fue similar en los tres estadios (Cuadro 1). No hubo diferencias significativas entre estadios de desarrollo folicular para los niveles de proteína, albúmina, triglicéridos y colesterol del líquido folicular. Sin embargo, los niveles de glucosa fueron menores en el estadio de regresión en comparación con el estadio de estática (p<0.05; Cuadro 2).
DISCUSIÓN
Los componentes bioquímicos del fluido folicular son esenciales para la maduración y fertilización del ovocito, por lo que cambios en su concentración pueden afectar el crecimiento y la calidad del ovocito (Leroy et al., 2004; Gode et al., 2011).
Glucosa
La glucosa cumple un rol fundamental en el metabolismo ovárico como fuente de energía. Las diferencias encontradas entre el estadio de estática y regresión podrían sugerir un agotamiento de los contenidos de glucosa en el estadio de regresión folicular. Según por Bravo et al. (1990), el periodo de crecimiento y estática se presenta a los 4.8 ± 1.5 días y 5.0 ± 1.6 días, respectivamente, en tanto que el periodo de regresión ocurre a partir de 10-11 días en adelante, lo que implicaría un tiempo suficiente para que los niveles de glucosa disminuyan debido al catabolismo local de los carbohidratos (Ali et al., 2008). Este hallazgo coincide con lo reportado por Gérard et al. (2002) en yeguas, donde los contenidos de glucosa tendieron a disminuir al pasar de la etapa dominante temprana (20-22 mm) a la etapa dominante tardía (30-32 mm). No obstante, los resultados difieren de lo reportado por Pacheco et al. (2019), quienes utilizan ovarios de animales procedentes de centros de sacrificio y que pueden afectar los niveles a nivel folicular.
La glucosa se origina a partir de la glucólisis dentro de las células de granulosa mural (Leese y Lenton, 1990, Collins et al., 1997) y por la afluencia de algunas moléculas del plasma sanguíneo a los folículos (Leese y Lenton, 1990); de allí que una menor permeabilidad de la barrera folicular en el estadio de regresión podría disminuir la afluencia de glucosa a partir de plasma sanguíneo. Los cambios en la permeabilidad son factibles debido a que las propiedades metabólicas de la barrera del folículo cambian significativamente durante el crecimiento folicular (Gosden et al., 1983).
En otras especies se ha observado un comportamiento similar de disminución en la concentración de glucosa en el fluido folicular, pero relacionado al tamaño folicular. Ali et al. (2008) encontraron que el contenido de glucosa en el fluido folicular e los dromedarios disminuyó a medida que los folículos aumentaron de 5-9 mm (136 ± 4.05 mg/dl) a 10-20 mm (77.09 ± 4.31 mg/dl), atribuyendo el cambio a un efecto de dilución, ya que comparativamente habría más fluido presente en los folículos grandes que en los pequeños. Por el contrario, en vacas lecheras se ha evidenciado que la concentración de glucosa fue directamente proporcional al tamaño folicular (Leroy et al., 2004).
Proteína total
Se encontró un ligero incremento, no significativo, de los niveles de proteína del estadio de crecimiento al estadio de estática. En este sentido, Vencato et al. (2014) evaluaron en llamas el perfil electroforético de proteínas del fluido folicular en las tres etapas del desarrollo del folículo, encontrando un aumento en proteínas de 250 kDa al pasar de la fase de crecimiento a la fase de estática, lo que coincidiría con el comportamiento observado en el presente estudio. Por otro lado, Leroy et al (2004) indicaron que el contenido de la proteína total en vacas lecheras no difiere significativamente durante el crecimiento folicular. Pacheco et al. (2019) reporta valores diferentes, posiblemente debido a la técnica de determinación y a que es este estudio se utilizaron animales vivos, no indicándose el tamaño promedio de los folículos incluidos en la categoría de grandes.
Albúmina
Los niveles de albúmina no presentaron diferencia significativa entre los estadios, por lo que no habría asociación entre el estadio de desarrollo folicular y los niveles de albúmina. Pacheco et al (2007) reportaron valores superiores de albúmina (5.29 g/dl) con relación a los resultados obtenido en el presente estudio; no obstante, el fluido también fue recuperado de folículos >7 mm de ovarios procedentes de camal, por lo que se podrían haber generado cambios en la composición regular in vivo de la albúmina.
La albúmina constituye más de la mitad de la proteína total, lo cual también fue observado en otros estudios en CSA (Vencato et al., 2014; Huanca et al., 2017).
Colesterol
El colesterol folicular se origina a partir de las células de granulosa y del suero sanguíneo mediante la captación de lipoproteínas plasmáticas (Endresen et al., 1990). En el presente trabajo se evidenció una ligera y no significativa disminución en la concentración del colesterol al pasar del estadio de estática a regresión. En este sentido, Gérard et al. (2002) observaron en yeguas que el contenido de lipoproteínas disminuyó significativamente al pasar de la etapa dominante temprana (20-22 mm) a la etapa dominante tardía (30-32 mm), comportamiento similar a este estudio.
Triglicéridos
Los niveles de triglicéridos fueron similares en los tres estadios de desarrollo folicular. En estudios similares, Huanca et al. (2017) reportaron valores de 3.94 y 3.16 mg/dl para folículos >7 mm utilizando como inductor de ovulación al PS y GnRH, respectivamente, sin encontrar diferencias significativas. Por otro lado, Leroy et al. (2004) observaron que la concentración de este metabolito aumentó en un 43% en el líquido folicular a medida que el tamaño del folículo aumentó de pequeño (<4 mm) a grande (>10 mm) en vacas lecheras.
CONCLUSIONES
Se observó una mayor concentración de glucosa en el líquido folicular durante el estadio de estática con respecto al estadio de regresión folicular en las alpacas.
No hubo diferencias significativas en las concentraciones de niveles proteína, albúmina, triglicéridos y colesterol del líquido folicular entre los tres estadios de desarrollo folicular en las alpacas.












 uBio
uBio