INTRODUCCIÓN
La chosna (Potos flavus) es un mamífero que pertenece al orden Carnivora y a la familia Procyonidae. Se les encuentra en Centro y Sudamérica incluyendo Perú (Rodríguez et al., 1995; Wozencraft, 2005). Su estado de conservación es de preocupación menor; sin embargo, factores como: la contaminación ambiental, la fragmentación de los bosques y la cacería son las principales causas del decline de sus poblaciones (Arias et al., 2016).Además, son susceptibles al tráfico ilegal de fauna silvestre para mantenerlos como «mascotas», siendo decomisados y albergados en centros de custodia como zoológicos. En la ciudad de Lima, el zoológico «Buen Pastor» mantiene una población importante de esta especie y ha recibido individuos con un estado de salud muy deteriorado, los cuales en algunas ocasiones han requerido de una evaluación clínica completa.
La ecografía es un método diagnóstico por imágenes que permite una maniobra no invasiva al observar en el interior del animal en tiempo real. En animales silvestres, esta técnica ofrece nuevas oportunidades relacionadas con el manejo de los animales en cautiverio. Para esto, el ecografista debe estar familiarizado con la anatomía de cada especie para reconocer y diferenciar variaciones normales de alteraciones causadas por enfermedades (Quaggio, 2001, 2007), de allí que es necesario contar con parámetros ecográficos normales para cada especie.
Se han realizado algunos estudios ultrasonográficos, principalmente en el orden Primate y pocos en el orden Carnivora como el coati (Nasua nasua), el lobo de crin (Chrysocyon brachyurus), el gato tigre chico (Leopardus guttulus) y el margay (Leopardus wiedii) (Ribeiro et al., 2013; Guimarães et al., 2013; Grandez et al., 2019; Muller et al., 2017). En la bibliografía encontrada no existen estudios sobre las características ultrasonográficas normales de los órganos abdominales de la chosna (P. flavus).
Debido a la utilidad diagnóstica de la ultrasonografía y a la falta de información en algunas especies de carnívoros, el objetivo de esta investigación fue realizar un estudio ultrasonográfico de los órganos abdominales de la chosna (Potos flavus) en el zoológico a fin de contar con información referencial para posteriores estudios diagnósticos y tratamientos más certeros, favoreciendo la salud de los individuos mantenidos en cautiverio.
MATERIALES Y MÉTODOS
El estudio se llevó a cabo en el zoológico «Buen Pastor» ubicado en el distrito de Los Olivos, ciudad y departamento Lima, Perú. El examen ultrasonográfico se llevó a cabo durante el control sanitario anual, programado en el mes de abril de 2019. El tamaño de la muestra correspondió al total de los ejemplares de chosnas (P. flavus) albergados en el zoológico, que correspondió a siete individuos adultos (5 hembras y 2 machos), los cuales se encontraron en el rango de 10 a 19 años. Los individuos se observaron en buen estado de salud al examen físico y no presentaron reportes de enfermedades previas durante los últimos seis meses.
Para el estudio se contó con la autorización del zoológico y del Servicio Nacional Forestal y de Fauna Silvestre (SERFOR) (RDG N.º 0034-2019-SERFOR/DGGSPFFSDGSPFS). Para la contención física el operario se aproximó lentamente al animal, sin hacer movimientos bruscos y colocó la red sobre el animal sin aprisionar extremidades para evitar posibles lesiones. Luego se procedió a la contención química con clorhidrato de ketamina (10 mg/kg) IM (Ket-A-100®, Agrovet Market), clorhidrato de xilacina (2 mg/kg) IM (Dormi-Xyl®, Agrovet Market) y midazolam (0.5 mg/kg) IM (Midazolam Richmond Vet Pharma®, Richmond Vet Pharma) (Lescano et al., 2016). El proceso de anestesia se monitoreó utilizando un oxímetro veterinario portátil (Edan VEH100B) para determinar la saturación de oxígeno, un estetoscopio para medir la frecuencia cardiaca y respiratoria, y un termómetro digital (Incoterm Termo Med 1.0) para medir la temperatura.
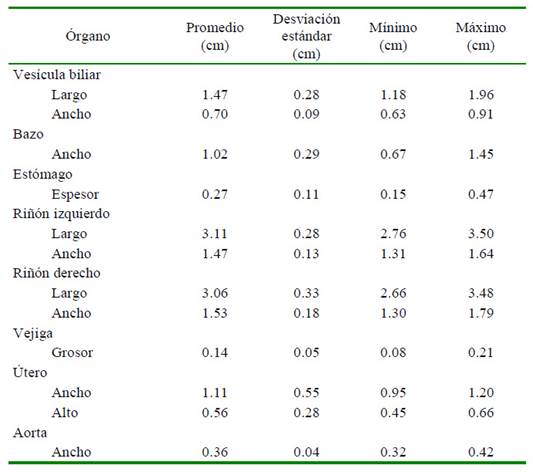
Para la evaluación ultrasonografía se utilizó un equipo modelo My Lab One Vet®, Esaote, con transductor convexo SC3123 (49 MHz) con el animal en posición de decúbito dorsal. Para fines prácticos y una mejor descripción topográfica de los órganos abdominales se dividió el abdomen en nueve regiones, según lo descrito por Howard y De Lahunta (1991): en el abdomen craneal, epigastrio, se encuentra el hipocondrio derecho, región xifoidea e hipocondrio izquierdo; (2) el abdomen medio, mesogastrio, abarca el flanco derecho, región umbilical y flanco izquierdo; y (3) el abdomen caudal, hipogastrio, conformado por la región inguinal derecha, región púbica y región inguinal izquierda (Figura 1).
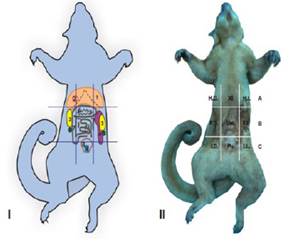
Figura 1 Gráfico de las zonas, regiones y topografía de los órganos abdominales de la chosna (Potos flavus). I) 1. Hígado. 2. Vesícula Biliar. 3. Riñón. 4. Bazo. 5. Ovarios. 6. Estómago. 7. Duodeno. 8. Vejiga. 9. Útero. II) HD = Hipocondrio derecho. Xi = Xifoidea. HI = Hipocondrio izquierdo. FD = Flanco derecho. Um = Umbilical. FI = Flanco Izquierdo. ID = Inguinal derecho. Pu = Púbica. II = Inguinal izquierda. A. Epigastrio. B. Mesogastrio. C. Hipogastrio
Se registró la topografía, morfología, dimensiones, ecogenecidad y ecotextura de los órganos hallados durante el examen. Se realizó un análisis de tipo descriptivo de cada órgano estudiado; además, se determinó el valor promedio, desviación estándar, mínimo y máximo para cada órgano abdominal (hígado, bazo, estómago, duodeno, riñón, vejiga, útero y aorta).Al término del procedimiento se aplicó clorhidrato de yohimbina (0.12 mg/kg) IM (Yohimbina Vet Up/ Richmond Vet Pharma®) (Lescano et al., 2016).
RESULTADOS
La topografía, forma, márgenes, ecotextura, contenido y ecogenicidad del hígado, bazo, tracto gastrointestinal, tracto urinario, tracto reproductor y aorta se presentan en los cuadros 1 y 2, y en la Figura 2. En el Cuadro 3 se presentan las medidas ecográficas (cm) de los órganos abdominales.
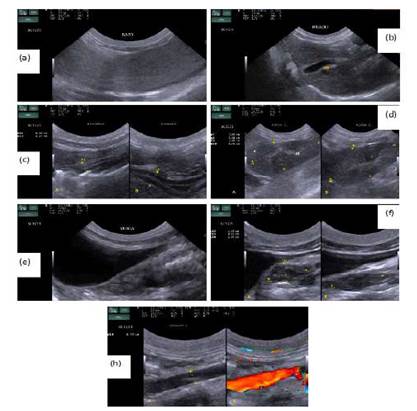
Figura 2 Imagen ecográfica de los órganos abdominales de la chosna (Potos flavus). a) Hígado y vesícula biliar (VB). b) Corte longitudinal del cuerpo del bazo. c) Estómago (A) y duodeno (B). d)A. Corte longitudinal del riñón izquierdo. Se visualiza la corteza renal (c) y la médula renal (m). B. Corte longitudinal del riñón derecho. e) Corte transversal del cuerpo de la vejiga urinaria. f)A. Corte transversal del cuerpo del útero. B. Corte longitudinal del cuerpo del útero. g) Corte longitudinal de la aorta, mostrándose como una estructura tubular con contenido anecoico. B. Doppler color de la aorta
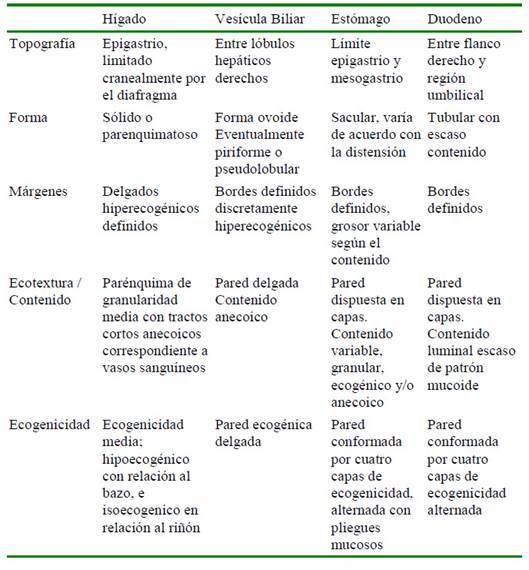
Cuadro 1 Características ecográficas: topografía, forma, márgenes, ecotextura, contenido y ecogenecidad del hígado, vesícula biliar, estómago y duodeno en siete ejemplares de chosna (Potos flavus) en cautiverio (Lima, Perú)
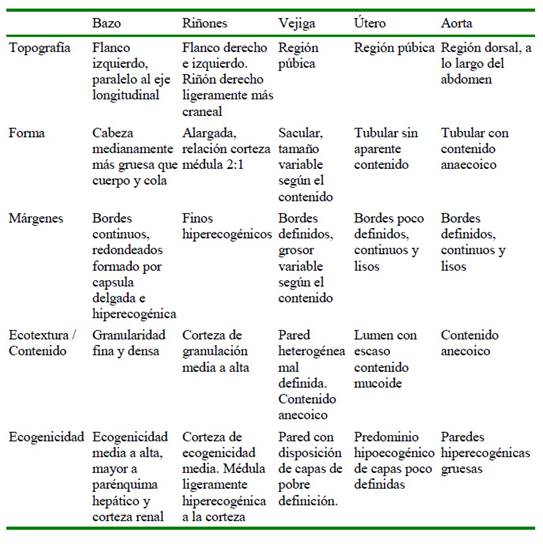
Cuadro 2 Características ecográficas: topografía, forma, márgenes, ecotextura, contenido y ecogenecidad del bazo, riñón, vejiga, útero y aorta en siete ejemplares de chosna (Potos flavus) en cautiverio (Lima, Perú)
DISCUSIÓN
El presente estudio es el primero en describir las características ecográficas del abdomen de la chosna (P. flavus). Los órganos reproductivos se contrastaron con un estudio realizado en el coatí (Nasua nasua)y los órganos abdominales con especies del orden Carnivora, como el gato doméstico (Felis silvestris catus), margay (Leopardus wiedii), gato tigre chico (Leopardus guttulus) y coatí (N. nasua).
El hígado se encontró ubicado en el epigastrio limitado cranealmente por el diafragma, topografía similar a la descrita en felinos (F. s. catus, L. wiedii y L. guttulus), lobo de crin (C. brachyurus) y en el coatí (N. nasua) (Ribeiro et al., 2013; Guimarães, 2013; Domínguez, 2015; Novellas, 2015; Muller et al., 2017). La relación de la ecotextura y ecogenicidad del hígado comparado con el bazo y el riñón es similar a lo mencionado en animales domésticos (Nyland et al., 2006).
La vesícula biliar presentó forma ovoide con contenido anecoico y un tamaño variable; además, uno de los ejemplares presentó una vesícula biliar pseudo bilobular. Este órgano presentó características ecográficas similares a lo mencionado en gatos domésticos a pesar de no tener dietas similares. Hay que considerar que la bilis tiene como función la digestión y absorción de los lípidos (triglicéridos, colesterol, fosfolípidos), y vitaminas liposolubles (A, D, E y K) de la dieta tanto de origen animal como vegetal (d’Anjou, 2010; Herdt y Sayegh, 2014); lo que explicaría la similitud observada.
El bazo presentó una cabeza medianamente más gruesa que el cuerpo y cola, contrastando con la forma triangular descrita en felinos (F. s. catus, L. wiedii y L. guttuls), lobo de crin (C. brachyurus) y coatí (N. nasua) (Ribeiro et al., 2013; Guimarães, 2013; Domínguez, 2015; Muller et al., 2017; Grandez et al., 2019). El bazo puede presentar aumento de tamaño o cambios en su arquitectura interna cuando es afectado por enfermedades sistémicas o localizadas (Domínguez, 2015); sin embargo, la población de chosnas evaluadas se encontraron clínicamente sanas. Respecto a su ubicación, se halló en el flanco izquierdo paralelo al eje longitudinal, ubicación similar descrita en el margay (L. wiedii) (Grandez et al., 2019); por lo que habría similitud entre estas especies del mismo orden taxonómico, Carnivora.
Al comparar la pared del estómago y del duodeno de la chosna con el del gato doméstico se encontró similitud en el número de capas y en la ecogenicidad, así como en el grosor de sus paredes (Winter et al., 2014). Los individuos estudiados se encontraban en ayuno, por lo que no se observó alimento en el estómago; sin embargo, la presencia de gas era de leve a moderada.
Los riñones se encontraron ubicados en cada flanco, siendo el derecho ligeramente más craneal; ubicación que difiere con el gato doméstico, pero que comparte con el perro doméstico y el coatí (N. nasua) (Nyland et al., 2006; Ribeiro et al., 2013). Los riñones presentaron una corteza de ecogenicidad media y una médula estrecha ligeramente hiperecogénica en relación con la corteza; sin embargo, uno de los ejemplares presentó aumento de la ecogenicidad de la zona medular, correspondiente al signo de banda medular.
Esto puede observarse en gatos y perros sanos, así como en animales enfermos compatibles con mineralización, necrosis y/o hemorragia. Para poder llegar a un diagnóstico definitivo se requiere realizar una biopsia renal (Biller et al., 1992). El largo de los riñones fue similar a lo descrito en felinos; sin embargo, difiere en el ancho (Nyland et al., 2006).
La vejiga urinaria con forma sacular se encontró ubicada en el abdomen caudal y en la región púbica. El grosor de la pared vesical (0.08 a 0.21 cm) varía según el grado de llenado de la vejiga, y estas medidas difieren del grosor descrito en el gato (F. s. catus) (0.13 a 0.17 cm) y del coatí (N. nasua) (0.11 a 0.17 cm) (Finn Bodner, 1995; Ribeiro et al., 2013).
Los ovarios se encontraron caudal a los riñones, ubicados en la región de los flancos y presentaron una forma ovoide. En algunas hembras no se pudo visualizar los ovarios, posiblemente debido a su pequeño tamaño, a la presencia de tejido adiposo y al artefacto de reverberación producido por el aire intestinal (Jarreta, 2004). Presentaron una ecogenicidad fina y densa con una zona medular ligeramente más ecogénica, sin evidencias de estructuras compatibles con folículos o cuerpos lúteos. Respecto a su tamaño, los de P. flavus (derecho 1.64 x 0.68 cm e izquierdo 1.61 x 0.87 cm) fueron de mayor tamaño a los descritos en N. nasua (derecho 0.75 x 0.49 cm e izquierdo 0.80 x 0.45 cm) (Mayor et al., 2013). Para la evaluación ecográfica de los ovarios se debe considerar el estadio del ciclo estral, el cual se desconoce en P. flavus, pero se sabe que es estacional, lo que explicaría las diferencias descritas (Nowak, 1999; Nyland y Mattoon, 2006).
No se visualizaron los cuernos uterinos en ninguno de los ejemplares. El cuerpo uterino (1.71 x 0.65 cm) tuvo un diámetro similar a lo estudiado en N. nasua (1.11 x 0.56 cm) (Mayor et al., 2013). Al igual que en ovarios, la presencia de aire intestinal y de tejido adiposo dificultó la identificación de los cuernos uterinos ingrávidos (Jarreta, 2004).
Los dos ejemplares machos del grupo fueron castrados años atrás para evitar la sobrepoblación, por lo cual no se describen los testículos en este estudio. El escroto se encontró ubicado entre la región perianal e inguinal, información que coincide con otros carnívoros domésticos (Ellenport, 1986).Tampoco se llegó a observar la próstata. Los perros castrados presentan una próstata muy pequeña difícilmente de observar (Hecht, 2010), lo cual también pudo ocurrir en P. flavus.
CONCLUSIONES
Las características ecográficas de los órganos abdominales del Potos flavus como hígado, vesícula biliar, vejiga y estómago presentan similitud con lo descrito en felinos (Felis silvestris catus, Leopardus wiedii y Leopardus guttulus) y en el coatí (Nasua nasua).
Los riñones presentan forma alargada, con una relación corteza médula 2:1, y una médula ligeramente hiperecogénica en relación con la corteza, siendo una característica particular de esta especie.
La forma del bazo es alargada con una cabeza más gruesa que cuerpo y cola, característica propia de esta especie.
Las características ecográficas del útero presentaron semejanza con las descritas en el coatí (N. nasua).












 uBio
uBio