INTRODUCCIÓN
Los camélidos sudamericanos tienen características seminales particulares, tales como semen filante y viscoso, escaso volumen, baja concentración espermática y ausencia de movilidad progresiva (Miragaya et al., 2008). Por otro lado, las características de calidad habituales evaluadas en el semen, como volumen, concentración, movilidad, vitalidad, morfología y funcionalidad de la membrana plasmática no necesariamente reflejan la calidad del ADN espermático (Carretero et al., 2012a, 2017), ni revelan alteraciones a nivel de la estructura de la cromatina en el ADN espermático (Cortés-Gutiérrez et al., 2007); de allí la importancia de considerar la evaluación del ADN espermático dentro de las valoraciones seminales de rutina (Tomsu et al., 2002; Agarwal y Allamaneni, 2004).
La integridad del ADN espermático se le considera como un factor importante en la fertilidad del macho, pues es determinante tanto para el éxito en la fecundación, como para el desarrollo normal del embrión y del feto (Berenguer et al., 2008; Gonsálvez et al., 2008; Sakkas y Alvarez, 2010). Las anormalidades en el material genético pueden expresarse por defectos en la maduración o condensación nuclear, rupturas del ADN y anormalidades cromosómicas (Carretero et al., 2017).
Se conocen algunos factores que pueden causar daño irreversible en el ADN del gameto, ya sea de origen intrínseco o extrínseco, que ocurren durante el proceso de espermatogénesis o en el transporte a través del tracto reproductivo. Entre estas se encuentran la apoptosis durante el proceso de espermatogénesis, empaquetamiento anormal de la cromatina, deficiencias en la recombinación del material genético, fragmentación de ADN pos-testicular, episodios de fiebre alta, enfermedades inflamatorias, y daños inducido por radioterapias, quimioterapias o agentes tóxi cos (Cortés-Guti érrez et al., 2007; Sakkas y Alvarez, 2010).
La defensa de los espermatozoides contra el daño de su material genético se sostiene básicamente por la sustitución de histonas por protaminas que producen una súper condensación de la cromatina y estabilizan el ADN covalentemente por enlaces intra e intermoleculares de disulfuro (Mukhopadhyay et al., 2011). En el semen de bovino se ha indicado que la inmadurez en los espermatozoides los hace más propensos a la degradación del ADN por la criopreservación (Mukhopadhyay et al., 2011). Así, el objetivo de este estudio fue determinar y comparar el índice de fragmentación del ADN espermático de alpacas (Vicugna pacos) colectados por tres métodos (electroeyaculación, desviación del conducto deferente y poscópula), utilizando la técnica de la dispersión de la cromatina.
MATERIALES Y MÉTODOS
Lugar de Estudio y Animales
El estudio fue realizado en el Centro de Investigación en Camélidos Sudamericanos (CICAS) La Raya, de la Facultad de Ciencias Agrarias, de la Universidad Nacional de San Antonio Abad del Cusco. La zona se encuentra a 4133 msnm. Se utilizaron nueve alpacas macho adultos de 6-8 años, con peso inicial de 69.1 ± 9.8 kg, criados sobre praderas naturales.
Colección de Semen
Se utilizaron tres animales por método de colecta y se realizaron tres colectas por cada animal entre enero y abril. Para la recuperación de los espermatozoides de los conductos deferentes (DCD), se utilizó 0.3 ml de base Tris (Souza, 2009) en viales de 2 ml, siguiendo el procedimiento descrito por Meza et al. (2018). La colección de semen mediante electroeyaculación (EE) fue de acuerdo a la técnica descrita por Director et al. (2007) y modificada para este especie, utilizando anestesia general. La colección de semen por el método de poscópula (PC) fue según la técnica descrita por García et al. (2017). En todos los casos, las muestras fueron inmediatamente conservadas a 37 °C. Los eyaculados con concentraciones de espermatozoides menores a 25 x 106/ml, con presencia de orina, o de eyaculación parcial fueron excluidos del estudio.
Evaluación de Semen
La movilidad total (móviles progresivos y móviles no progresivos), y la concentración se evaluaron en el ISAS® (Proiser R+D, Paterna, España), que incluye un microscopio de contraste de fase UOP - UB200i, con un objetivo de contraste de fase negativo de 10x (Meza et al., 2018), y una video cámara (Ximea MQ003MG-CM; Ximea, Alemania).
La vitalidad se determinó mediante fluorescencia, usando el kit VitalTest® (Halotech, España) siguiendo las especificaciones del fabricante, capturando no menos de 200 espermatozoides por muestra. La funcionalidad de la membrana espermática se evaluó mediante la prueba hipoosmótica (50 mOsm/kg), contándose no menos de 200 espermatozoides por muestra. En estas dos últimas pruebas, se empleó el objetivo 40X del sistema ISAS®.
Índice de Fragmentación de ADN Espermático
La fragmentación del ADN espermático se analizó con el test de la dispersión de la cromatina espermática SCD (Fernández et al., 2003), empleando el kit Halomax ® ram (Halotech, España) (Gonsálvez et al., 2008). Publicaciones sobre la técnica se han descrito tanto para el caso de humanos como para animales (Fernández et al., 2005; Enciso et al., 2006; Cortes-Gutiérrez et al., 2008).
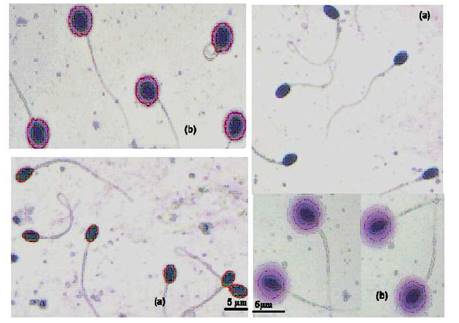
Los portaobjetos con las muestras fueron teñidos con Diff Quik (6 min con Diff Quik I [Eosina] y 6 min con Diff Quik II [azul de metileno]), y 6 min con la tinción Wrigth. Luego fueron lavados con agua destilada, dejándose a secar a temperatura ambiente. El daño del ADN se determinó utilizando un microscopio de campo claro con objetivo de 40X, en el módulo de fragmentación de ADN del ISAS®. Se tomaron fotogramas de no menos de 300 espermatozoides por muestra (Figura 1). Los espermatozoides con ADN fragmentado presentan un gran halo de difusión de los fragmentos de cromatina, mientras que aquellos que no están afectados no presentan halo de bucles de cromatina, o este es de tamaño muy reducido y compacto (Posado, 2014; Carretero et al., 2012a; Gonsálvez et al., 2008). El control positivo para SCD se obtuvo exponiendo espermatozoides de alpaca a una temperatura de 80 °C por 5 minutos, consiguiendo 86% de espermatozoides fragmentados o dañados.
Análisis Estadístico
Se obtuvo estadística descriptiva del volumen, movilidad, vitalidad, concentración y funcionalidad de la membrana espermática. El índice de fragmentación de ADN espermático se analizó con un diseño de bloques al azar, previo análisis de normalidad (test de Kolmogorov-Smirnov) y de homogeneidad de varianzas (test de Levene). Para los cálculos estadísticos se utilizó el SAS v. 8.2.
RESULTADOS
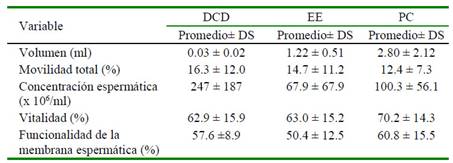
Los resultados de las evaluaciones de las nueve muestras de semen colectadas por método de colecta se muestran en el Cuadro 1 y el porcentaje del índice de fragmentación de ADN espermático en el Cuadro 2. Los espermatozoides colectados por electroeyaculación y poscópula presentaron menor porcentaje de índice de fragmentación de ADN espermático con relación a los espermatozoides recuperados del conducto deferente (p<0.05). El esperma colectado del conducto deferente no contiene plasma seminal y los espermatozoides probablemente no han completado su maduración.
Cuadro 1 Características macroscópicas y microscópicas de semen de alpaca1 colectado por electroeyaculación (EE), desviación del conducto deferente (DCD) y poscópula (PC)
1 Tres machos por método y tres colecciones por macho
DISCUSIÓN
Los resultados de la evaluación de los parámetros seminales de rutina de los tres métodos de colección fueron similares a los descritos en espermatozoides recuperados del conducto deferente por Meza et al. (2018) y Quispe (2015) en semen colectado pos-cópula por Alarcón et al. (2012) y en semen colectado por electroeyaculación por Ordoñez et al. (2013) y Ciprian (2019) en alpacas.
La integridad del ADN de los espermatozoides es importante para el desarrollo normal del embrión y del feto. La fragmentación del ADN se ve influenciada en gran parte por la susceptibilidad al daño de los espermatozoides producto del shock por frío (Salazar, 2013). En el presente estudio, tras exponer el semen a temperaturas altas se obtuvo mayor porcentaje de degradación de ADN espermático; por lo tanto, en camélidos sudamericanos, este es otro factor que aumenta el índice de fragmentación de ADN espermático (Carretero et al, 2012a). Así mismo, el método de colecta afectó la calidad de las muestras de semen en el presente estudio. La velocidad de degradación de ADN espermático varía entre especies y método de colecta, siendo muy elevada para el caso de oveja, medio para el caso del humano y el caballo y baja en el caso del toro (Lorences, 2010).
Los espermatozoides recuperados del conducto deferente carecen de plasma seminal, que es un componente que juega un rol importante en la conservación de los espermatozoides, ya que contiene una proteína secretora rica en cisteína (CRISP3), que ha sido asociada positivamente con la tasa de concepción (Novak et al., 2010), además de diversos componentes que actúan como antioxidantes (Villa et al., 2012). Así mismo, Pizarro et al. (2013) señala que el plasma seminal mantiene menores niveles de peroxidación lipídica de los espermatozoides; es decir, menos estrés oxidativo de la muestra. En consecuencia, los espermatozoides recuperados del conducto deferente, al carecer de plasma seminal, presentan una mayor degradación de ADN espermático frente a los otros dos métodos de colecta.
No se tienen reportes sobre la fragmentación del ADN espermático con el método de SCD en espermatozoides de alpacas recuperados del conducto deferente y de semen colectado por poscópula; sin embargo, Carretero et al. (2015) reportó en llamas 19.2% de espermatozoides fragmentados con este método en semen colectado por electroeyaculación, valor superior al hallado en este estudio por el mismo método de obtención de semen.












 uBio
uBio