INTRODUCCIÓN
El carcinoma de células escamosas ocular (CCEO) bovino es la neoplasia más frecuente en ganado, siendo causa de descarte, pérdidas económicas e implicaciones en bienestar animal, ya que el auto traumatismo es efecto de incomodidad en respuesta al dolor (Carvalho et al., 2012). Este tipo de carcinoma se presenta mayormente en bovinos Bos taurus, pues las razas cebuínas y criollas son más resistentes (Brogdon y McLaughlin, 1992). Es considerado un tumor maligno de los queratinocitos del estrato malpighiano de la epidermis y su desarrollo se asocia a la exposición prolongada a la luz ultravioleta, la pérdida de pelo en la zona y la piel hipopigmentada periorbital, debido a que la melanina es un factor fotoprotector en las superficies epidérmicas y mucosas (Ramos et al., 2007).
Según Tsujita y Plummer (2010) el carcinoma se puede ubicar en las uniones lateral corneo esclerótica (66.7%) y medial (16.5%). Gharagozlou et al. (2007) menciona una mayor presentación en el ojo derecho (40%) que en el izquierdo (37.5%) y una ocurrencia en ambos ojos de 21.9%. El carcinoma de células escamosas de la conjuntiva varía en gravedad, desde la displasia leve hasta el carcinoma in situ y carcinoma invasivo. El tumor en todas las especies se desarrolla a través de una serie de etapas premalignas, placas epidérmicas y papilomas, para después desarrollarse durante meses o años a carcinoma in situ e invasivo (Tsujita y Plummer, 2010).
En general, los tumores pueden tener un aspecto papilar de tamaño variable, tomando forma de coliflor, de superficie ulcerada y sangran con facilidad. Inician con alteracio-nes que son caracterizadas por tener eritema, edema, descamación y formación de costras y ulceración. A medida que invade la dermis, el sitio se torna firme y el área ulcerada más amplia y profunda (Fernandes, 2007). Microscópicamente, el carcinoma bien diferenciado presenta células dispuestas en cordones o espirales con centros queratinizados, muchos en forma de perlas lamelares, y/o dispuestos en puentes intercelular, pudiendo presentar queratinización individual. Los carcinomas diferenciados presentan varias células con queratinización individual y menos frecuencia de perlas y puentes intercelulares. En los indiferenciados es difícil reconocer las células tumorales como originadas de queratinocitos (Ramos et al., 2008.
La radiación ultravioleta causa mutación en oncogenes y genes supresores de tumores, y se han detectado mutaciones específicas de p53 en carcinomas de células escamosas cutáneas inducidas por esta (Coulter et al., 1995). Generalmente la mutación del gen p53 se acumula en el núcleo de células tumorales en cantidades detectables por inmunohistoquímica (Schliephake, 2003).Tiene un papel importante en el control del ciclo celular, actuando como factor de transcripción de la estabilidad genómica, de la diferenciación celular y de la apoptosis (Whyte et al., 2002). La detección de esta proteína suele indicar la ineficacia de los mecanismos estabilizadores; es decir, hay una pérdida de la función proapoptótica, lo que da lugar a un crecimiento continuo tumoral (Werkmeister et al., 2000). Este gen no se detecta en el estudio inmunohistoquímico de las células normales. Debido a sus patrones de distribución específicos, se les utiliza como marcadores de diferenciación en patología tumoral (Fornazari et al., 2017).
La citoqueratina 19 (CK19) se expresa normalmente en epitelio escamoso estratificado. Se considera que es un marcador de premalignidad y susceptibilidad al cáncer como el CCEO. Las citoqueratinas juegan un papel en la apoptosis (Zhong et al., 2007). La utilidad clínica de las citoqueratinas como marcadores tumorales está bien establecida y reflejan actividad tumoral teniendo un valor predictivo de la enfermedad muy preciso (Malhotra et al., 2016). La importancia de los estudios de inmunohistoquímica en el carcinoma de células escamosas radica en la necesidad de precisar el diagnóstico y pronóstico de la enfermedad (Fletcher, 1986). Para obtener una mejor comprensión de la patología y del proceso de transformación neoplásica, se evaluó la expresión mediante el análisis inmunohistoquímico de p53 yCK19, y las características histopatológicas y clínicas del cáncer de células escamosas ocular en bovinos del departamento de Nariño, Colombia.
MATERIALES Y MÉTODOS
Tipo de Estudio
El estudio fue de tipo descriptivo, no probabilístico, realizado en 26 vacas con lesiones neoplásicas oculares y periorbitales. El estudio tuvo el aval del Comité Bioético (Código 1633, 2018) de la Vicerrectoría de Investigaciones, Postgrados y Relaciones Internacionales de la Universidad de Nariño.
Localización
El estudio fue realizado en fincas de la región andina del departamento de Nariño, Colombia, especialmente en los municipios de Pasto, Pupiales, Ipiales, Guachucal y Tuquerres a una altura aproximada de 3000 msnm. La temperatura ambiental promedio es de 14 °C, humedad relativa de 82%, precipitación anual de 800 mm, brillo solar mínimo de 80 horas/mes y máximo de 107 horas/ mes, un índice UV mínimo de 12.8 y máximo de 15.3.
Animales
Se trabajó con 26 bovinos hembra, de edades comprendidas entre 3 y 16 años, de raza Holstein (n=17), Normando (n=3), Holstein x Simmental (n=3), criolla (n=2), y Montbéliarde (n=1). Estos animales hacen parte de la casuística presentada entre septiembre de 2018 y mayo de 2019. A cada animal se le realizó el examen clínico y oftalmológico para determinar la distribución anatómica de la lesión ocular o periorbital. Se les clasificó por edad como jóvenes (menores de tres años), adultos (entre tres y siete años) y seniles (mayores de siete años).
Carcinoma
Se realizó una caracterización anatomopatológica de las lesiones cutáneas, basándose en la observación macroscópica de las características que presentaban las lesiones tumorales. El carcinoma fue clasificado en cuatro estadios y la distribución anatómica en ojo y región periorbital. De igual forma, dependiendo del caso clínico se realizaron cirugías para obtener la muestra para histopatología. Dependiendo del órgano o tejido involucrado, se realizó la exenteración del globo ocular y tejidos adyacentes, la resección de la membrana nictitante, la queratectomía superficial en el caso de las córneas o una blefaroplastia en el caso del párpado inferior.
Histología e Inmunohistoquímica
Los tejidos fueron depositados en frascos estériles con una proporción de 1/10 de formol al 10%. Las muestras se tabularon y se transportaron en una nevera al laboratorio de patología especializado de alta tecnología, Bio-Molecular Diagnostica, en la ciudad de Bogotá. Para histopatología, las muestras se tiñeron con la coloración de Hematoxilina -Eosina (H-E) y se estudió con 40x de magnificación. La tinción inmunohistoquímica se realizó utilizando el método de estreptavidina-biotina-peroxidasa. Se utilizaron dos anticuerpos policlonales comerciales dirigidos contra antígenos humanos (CK19 de Novocastra, Clon b170, 1 ml liofilizado NCLCK19 FP y NCL-p53-CM1, de Novocastra, Newcastle, Reino Unido).
RESULTADOS
En el Cuadro 1 se presenta la distribución de las lesiones según sexo, edad, raza y ubicación. De los 26 animales estudiados, 24 presentaron lesiones compatibles con carcinoma de células escamosas en el ojo y región periorbital, mientras uno en un caso se trató de papilomatosis y en otro de un absceso en la subconjuntiva, ambos con la lesión en el tercer parpado. Según raza, la más afectada fue la Holstein (15, 57.6%) y por edad, la mayor frecuencia fue en adultas (16, 64%, seguida de semiles (8, 32%) y jóvenes (1, 4%, lo que indica que el factor asociado a la frecuencia del CCEO fue en animales adultos.
Cuadro 1 Distribución de lesiones oculares o periorbitales en 26 bovinos en el departamento de Nariño, Colombia, según sexo, edad, raza y ubicación
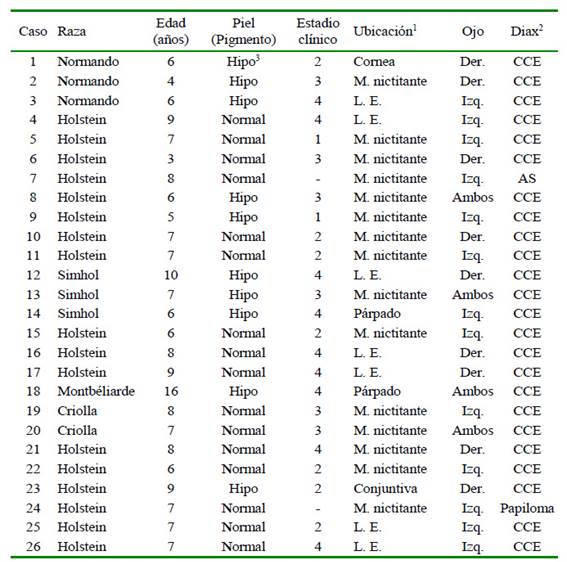
1 M. nictitante: Membrana nictitante; L:E. Limbo esclerocorneal
2CCE: carcinoma de células escamosas; AS: absceso subconjuntival;
3 Hipo: Hipopigmentación
Catorce vacas (56%) presentaron el carcinoma de células escamosas en la membrana nictitante, 7 (28%) en el limbo esclerocorneal, 2 (8%) en párpado, 1 (4%) en córnea y uno (4%) en conjuntiva (Figura 1). El porcentaje de animales con el área periorbital hipopigmentada fue de 40% (10 vacas). En cuanto a la distribución del carcinoma, 12 ocurrieron en el ojo izquierdo, 9 en el ojo derecho y 4 vacas tuvieron afectados ambos ojos.
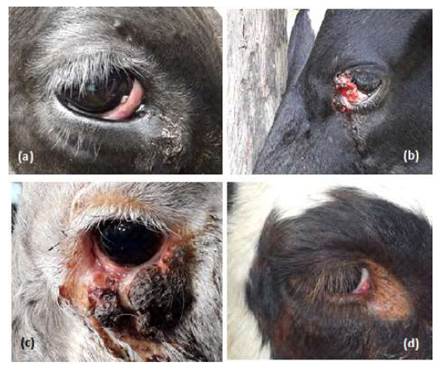
Figura 1 Distribución del carcinoma de células escamosas en el ojo y región periorbital en vacas de leche del departamento de Nariño, Colombia. (a) en córnea; (b) en limbo esclerocorneal y parpado superior; (c) en parpado inferior; (d) en membrana nictitante
Al examen clínico macroscópico se observaron lesiones en placa cutánea conjuntival de color blanco-grisáceo con superficie lisa (Figura 2a) en dos animales, hiperqueratosis de superficie rugosa disgregada (Figura 2b) en siete vacas, seis con carcinomas no invasivos con superficie granulomatosa o ulcerosa (Figura 2c) y nueve animales con carcinoma invasivo de aspecto de coliflor con grietas, necrosis, cubierto de sangre, moco, fibrina y/o pus, con base ancha que irrumpe en los tejidos adyacentes (Figura 2d) (Rosenberger, 1988).
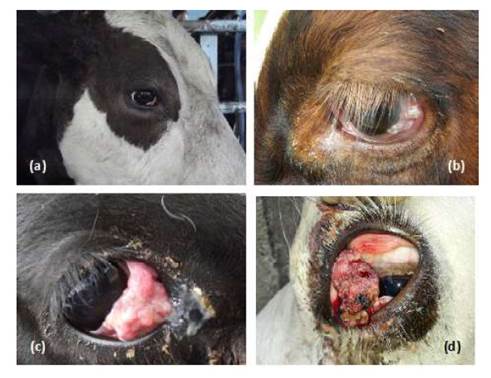
Figura 2 Lesiones clínicas encontradas en el carcinoma ocular de células escamosas en bovinos. (a) Estadio uno en membrana nictitante; (b) Estadio dos en conjuntiva y tercer párpado; (c) Estadio tres en limbo esclerocorneal; (d) Estadio cuatro en limbo esclerocorneal
Pen la histopatología, las muestras coloreadas con H-E presentaron hallazgos microscópicos similares entre ellas, y que corresponden a un cáncer ocular de células escamosas. En el primer estadio (Figura 3a) se observaron núcleos grandes, ovoides, con uno o dos nucléolos en su interior; además de un citoplasma abundante que varía de pálido a eosinofílico, con bordes bien definidos. Estas células intentan formar cordones. También se presenta edema intercelular. Para el segundo estadio (Figura 3b) el carcinoma se evidencia bien diferenciado con paraqueratosis, formando distintas «perlas» de queratinas, similar al estadio tres (Figura 3c), observándose además un acentuado infiltrado linfoplasmocitario intersticial. En el estadio cuatro (Figura 3d) las células tumorales poseen bordes distintos, con forma poligonal o fusiforme, de núcleos grandes, ovales, con cromatina finamente granular y con uno o dos nucléolos. El citoplasma es abundante, eosinofílico y homogéneo y se puede presenciar claramente la formación de perlas de queratina e infiltración linfoplasmocitaria.
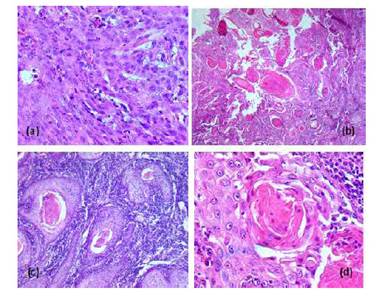
Figura 3 Hallazgos microscópicos del carcinoma de células escamosas ocular en bovinos. (a) Estadio uno; (b) Estadio dos; (c) Estadio tres; (d) Estadio cuatro (H-E, 40x)
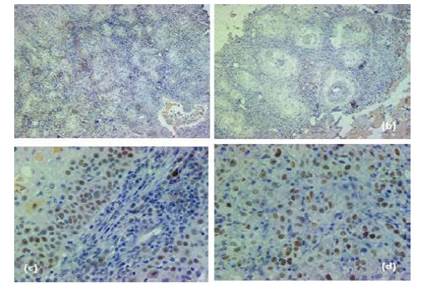
En cuanto a los resultados de la inmunohistoquímica, 18 (75%) muestras presentaron una sobreexpresión débil, 4 sobreexpreión y en 2 no hubo reactividad. Para el primer estadio (Figura 4a), se encontró una marcación nuclear de p53 en cerca del 40% de células tumorales; similar al estadio dos (Figura 4b). En el estadio tres (Figura 4c) se observa la expresión nuclear de p53 en las células tumorales y presencia de células inflamatorias que acompañan el tumor, quienes fueron negativas para este supresor tumoral. En el estadio cuatro (Figura 4d) se observa la inmunomarcación en el núcleo de la mayoría de células epiteliales malignas como también la presencia de nucléolo evidente en las células con expresión nuclear de la proteína.
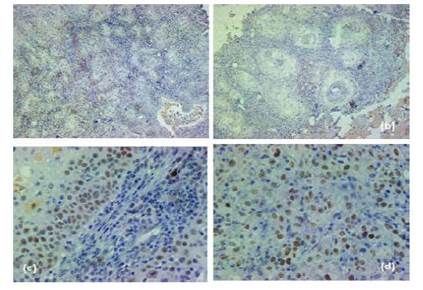
Figura 4 Hallazgos microscópicos de inmunohistoquímica con marcador p53 en el carcinoma ocular de células escamosas en bovinos. (a) Estadio uno; (b) Estadio dos; (c) Estadio tres; (d); Estadio cuatro (10x)
No se evidenció reactividad al marcador CK19 (Figura 5) en las muestras realizadas independientemente del estadio clínico en el que se encontraba.
DISCUSIÓN
La mayor frecuencia de CCEO en vacas Holstein se debió probablemente a que es la raza lechera predominante en la región, además de presentar una piel hipopigmentada. Todos los casos en las vacas Montbéliarde, Simhol y Normando se presentaron en piel hipopigmentada en los ojos y tejidos periorbitales, lo cual facilita el desarrollo de carcinomas (Carvalho et al., 2012). Las lesiones en dermis se han reportado especialmente en las uniones mucocutáneas y se evidencia en pacientes que carecen de pigmentación en la epidermis (Carvajal, 2012). Dadas las características fenotípicas de piel hipopigmentada del párpado y la zona esclerocorneal se describen razas con mayor predisposición a desarrollar este tipo de carcinomas, entre ellas, Hereford, Holstein, Simmental, Ayrshire y Charoláis (Carvalho et al., 2012). Además, la presentación del CCEO se relaciona directamente a factores como altitud y latitud de la zona geográfica donde los animales son expuestos a intensa radiación solar durante largos periodos y si tienen o no piel pigmentada (Narayanan y Saladi, 2010).
El factor edad es un factor asociado al desarrollo del CCEO, a mayor edad hay mayor riesgo. La gran mayoría de los bovinos con carcinoma en este estudio fueron adultos y seniles, lo que coincide con el trabajo de Carvalho et al. (2012) en Brasil.
Los hallazgos del CCEO encontrados macroscópicamente fueron similares a las reportadas por Cardona et al. (2013). La presencia de «perlas» de queratinas y un acentuado infiltrado de linfoplasmocitario intersticial coincide con el estudio de Ramos et al. (2008). Por otra parte, Bhargava et al. (2010) no encontraron una relación clara entre el grado de la tumoración y la tasa de curación, el estadio de la enfermedad y la afectación metastásica.
Los animales estudiados se mantenían en una región de latitud baja y a una altitud por encima de los 2600 msnm, con exposición a rayos UV mínimo de 80 horas/mes y máximo de 107 horas/mes con un índice UV mínimo de 12.8 y máximo de 15.3. Por lo tanto, es concebible que las mutaciones inducidas por los rayos ultravioleta tuvieron cierta influencia en la etiología de CCEO. Sin embargo, no fue el factor etiológico más importante ya que en la mayoría de los casos mostraron inmunoexpresión débil de p53. El gen supresor p53 juega un papel significativo en la carcinogénesis de diversos tejidos, y su prevalencia en bovinos se ha relacionado directamente con la exposición a la radiación con rayos ultravioleta. La mutación de este gen que codifica para la proteína p53, está relacionada con los factores que intervienen en la génesis del tumor (Sánchez et al., 2003). Los resultados obtenidos difieren de lo observado en informes anteriores de CCEO que demostraron una fuerte inmunoexpresión de p53 en un porcentaje mayor de casos en animales con piel hipopigmentada (Carvalho et al., 2005). Por lo tanto, no se pudo establecer una asociación entre la inmunoexpresión de p53 y la diferenciación de células cancerosas que corrobora los hallazgos de otros investigadores.
En la piel normal el CK19 se expresa de forma particularmente intensa en las células basales de la epidermis y en los anejos cutáneos. Resulta por tanto positiva en neoplasias epiteliales, tanto benignas como malignas, y negativa en todas las neoplasias mesenquimales y melanocíticas en humanos (Makin et al., 1984). El CK19 se encuentra en la mayoría de las células escamosas carcinomas y tanto en lesiones primarias como metastásicas. La importancia de CK19 en el patrón de expresión en carcinomas escamosos es evidente; sin embargo, no está clara la no reactividad del CK19 en el CCEO bovino, lo cual merece más investigación.
CONCLUSIONES
El estudio demostró que la valoración morfológica de las lesiones de carcinoma de células escamosas ocular con tinción H-E continúa siendo la mejor herramienta diagnóstica, aunque no es posible clasificar los estadios del carcinoma por su grado de diferenciación microscópica.
El marcador p53 mostró una inmunoexpresión débil, tanto en animales con pigmentación normal como piel hipopigmentada.
La importancia de CK19 en el patrón de expresión en carcinomas escamosos es evidente; sin embargo, se requiere mayor investigación de la no reactividad en el carcinoma de células escamosas ocular bovino.












 uBio
uBio