INTRODUCCIÓN
En toros se ha observado que la movilidad evaluada subjetivamente y mediante sistemas computarizados de análisis espermático (CASA), así como la incidencia de espermatozoides vivos, se correlacionan positivamente con la fertilidad en campo (Januskauskas et al., 2003). Así mismo, se reportan correlaciones positivas entre diversos métodos para la evaluación de espermatozoides con plasmalema intacto, entre los cuales, se conoce que el ensayo hipoosmótico (HOST) contribuye con la predicción de la tasa de fertilización in vitro (Brito et al., 2003).
Además de los métodos convencionales de evaluación seminal, el análisis espermático por citometría de flujo es considerado como método objetivo, preciso y de alto grado de confiabilidad. Esta técnica mide de manera imparcial la cantidad de tinción fluorescente asociada con las células e incluso permite evaluar múltiples tinciones en espermatozoides individuales (Graham, 2001). La evaluación de un alto número de espermatozoides por muestra en este análisis permite que los datos obtenidos muestren una menor variabilidad intra-análisis y, por lo tanto, son más repetibles (Kirk et al., 2005; Mocé y Graham, 2008). Sellem et al. (2015) encontraron que varios parámetros de calidad del semen bovino descongelado, evaluados mediante CASA y citometría de flujo, estaban correlacionados con la fertilidad basada en la tasa de no retorno a los 56 días después de la inseminación.
Otras asociaciones interesantes son las resultantes entre los métodos convencionales de evaluación seminal, el uso de sistemas computarizados y los parámetros evaluados por citometría de flujo, toda vez que podrían favorecer la estimación de fertilidad potencial de las muestras de semen, sin requerir la evaluación de la fertilidad a través de tasas de no retorno, confirmación ecográfica de la preñez o el nacimiento de crías vivas. Mediante evaluaciones fluorométricas y por citometría de flujo de semen bovino criopreservado se ha podido establecer correlaciones entre la actividad mitocondrial, la viabilidad, la movilidad progresiva y la integridad del acrosoma, con mediciones microscópicas de la movilidad espermática y el estado acrosomal (Garner et al., 1997; Thomas et al., 1998; Gürler et al., 2016). Así mismo, Kirk et al. (2005) hallaron correlaciones positivas (r>0.50) entre la movilidad visual y por CASA con los resultados por citometría de flujo de espermatozoides viables, viables con acrosomas intactos y con alto potencial de membrana mitocondrial, logrando ajustar modelos altamente predictivos del potencial fertilizante de las muestras de semen equino criopreservado.
Se ha descrito que la criopreservación del semen bovino induce fenómenos característicos de la apoptosis, como son la disminución del potencial de membrana mitocondrial, la activación de las caspasas y el aumento de la permeabilidad de la membrana, los cuales estarían implicadas en la disminución de la movilidad celular, y en alteraciones de la regulación del ciclo celular, la diferenciación celular, la capacitación y las reacciones acrosómicas (Martin et al., 2004). A pesar de esto, existe información limitada respecto a las posibles asociaciones existentes entre diferentes parámetros convencionales y por sistemas computarizados de calidad seminal, con la evaluación por citometría de flujo de alteraciones generadas por la criopreservación como la apoptosis, la criocapacitación y la vitalidad espermática. El objetivo de este estudio fue evaluar la asociación entre parámetros convencionales y computarizados de calidad seminal con la evaluación por citometría de flujo de semen bovino congelado.
MATERIALES Y MÉTODOS
Animales
Se obtuvieron 10 eyaculados de cinco toros sanos y sexualmente maduros, de las razas Angus y Holstein, ubicados en el departamento de Antioquia, Colombia. Los toros se mantuvieron bajo condiciones controladas de manejo y alimentación. Todos los procedimientos fueron aprobados por el Comité de Ética y Experimentación con Animales del Politécnico Colombiano Jaime Isaza Cadavid.
Colecta y Evaluación Seminal
Las muestras de semen se colectaron una vez por semana durante un periodo de 10 semanas consecutivas, mediante el uso de un electroeyaculador (Electrojac 6, USA). El toro fue inmovilizado en un brete, se indujo la micción, se cortó el pelo del prepucio y se le lavó con una solución salina y se vació el contenido rectal. El voltaje del electroeyaculador aumentó automáticamente durante su empleo (Baiee et al., 2018).
El eyaculado se recogió en una bolsa de plástico estéril, se estimó su movilidad masal e individual mediante un microscopio de contraste de fases (Eclipse E200, Nikon, Japón) y se evaluó su concentración mediante un espectrofotómetro (Spermacue®, Minitube, Alemania). Los requerimientos mínimos de calidad seminal para procesar los eyaculados fueron de 70% de movilidad y una concentración espermática de 500x106 espermatozoides/ml (Khumran et al., 2015).
Criopreservación Seminal
Las muestras de semen se diluyeron a una concentración de 60x106 espermatozoides/ml con el diluyente Triladyl® (Minitube, Alemania), el cual fue previamente preparado de acuerdo con las especificaciones del fabricante. Luego, cada muestra se introdujo en un dispositivo de transporte a 4 °C (Equitainer, Hamilton Biovet, USA), donde permanecieron durante dos horas. Una vez en el laboratorio, las muestras de semen fueron equilibradas durante una hora en un refrigerador a 4 °C, se empacaron en pajillas de 0.25 ml (IMV, Francia) y se sellaron con alcohol polivinílico (Merck, Alemania). Posteriormente, las pajillas se sometieron a vapores de nitrógeno líquido (LN ), al colocarlas durante 15 minutos en un rack, a una distancia de 4 cm por encima de la superficie del LN2 y finalmente se almacenaron en un tanque de nitrógeno líquido. Las pajillas fueron descongeladas en agua a 37 °C durante 1 minuto luego de una semana de almacenamiento.
Calidad Espermática
Se evaluó la movilidad y la cinética de los espermatozoides mediante el software Sperm Class Analizer (SCA®, Microptic, España). Se colocó una gota de semen descongelado en un portaobjetos precalentado a 37 °C y se cubrió con un cubreobjetos. En un microscopio de contraste de fases (Eclipse E200, Nikon Inc., Japón) se analizaron un mínimo de 500 espermatozoides por muestra, para determinar la movilidad total (MT), la movilidad progresiva (MP), la velocidad lineal (VSL), la velocidad curvilínea (VCL) y la velocidad media (VAP).
La vitalidad espermática (VE) y la morfología normal (MN) se evaluaron utilizando la tinción de eosina y nigrosina. Una gota de 20 µl de semen descongelado se mezcló sobre un portaobjetos con 20 µl de eosinanigrosina (Merck, Alemania) durante 15 segundos y se dejó secar sobre una placa térmica a 37 ºC. Se evaluaron 200 espermatozoides para cada prueba utilizando un microscopio de contraste de fases (Eclipse E200, Nikon, Japón). Los espermatozoides con cabezas no teñidas se consideraron vivos y los espermatozoides con cabezas rosadas se clasificaron como muertos (Khumran et al., 2015). Los espermatozoides se clasificaron, asimismo, según su morfología normal o anormal (Nagy et al., 2013).
La integridad funcional de la membrana plasmática se evaluó mediante la prueba hipoosmótica (HOST) (Rekha et al., 2016). Se mezclaron 50 µl de semen descongelado con 200 µl de una solución hipoosmótica (5.4% de sacarosa, 100 mOsmol/l) y se colocó a incubación a 37 °C durante 40 minutos. Se realizó el conteo de 200 espermatozoides mediante microscopia (Eclipse E200, Nikon, Japón). Los espermatozoides que reaccionaron con el enrollamiento de la cola se consideraron como células con membranas funcionalmente intactas (Baiee et al., 2018).
Citometría de Flujo
La criocapacitación y la apoptosis de los espermatozoides congelados-descongelados se evaluaron mediante las sondas fluorescentes Merocianina 540 / Yo-Pro-1 (Thermo Fisher Scientific, USA). Se prepararon soluciones stock de Merocianina 540 en DMSO (1 mM) y Yo-Pro-1 en DMSO (25 µM). Se tomaron 10 µl de semen diluido y se agregaron ambas sondas en concentraciones finales de 2.7 µM de Merocianina 540 y 25 nM de Yo-Pro-1 (Kavak et al., 2003). Las muestras fueron incubadas en oscuridad durante 30 minutos a 37 °C. Se evaluaron usando un citómetro de flujo (LSR Fortessa, BD Biosciences, USA), en un rango de emisión entre 500-550 nm para Yo-Pro-1 y 580-620 nm para Merocianina 540. Los datos de citometría de flujo se analizaron con el software FlowJo v. 7.6.2 (FlowJo, USA).
El potencial de membrana mitocondrial (ΔψM) de los espermatozoides se evaluó con una versión adaptada del protocolo descrito por Zamzami et al. (1996). Se usó un tubo de poliestireno para depositar 3.3'yoduro de dihexiloxacarbocianina (DiOC6(3), Thermo Fisher Scientific, USA) en PBS a una concentración final de 80 nM y 7-aminoactinomicina D (7-AAD, Thermo Fisher Scientific, USA) a una concentración final de 2 µg/ml. A esta mezcla se agregó 10 µl de semen, dando como volumen final 300 µl.
Posteriormente, para evaluar simultáneamente la viabilidad celular, se añadió 1 mg/ ml de yoduro de propidio (PI) (Thermo Fisher Scientific, USA). Se incubó durante 30 minutos y la lectura se hizo mediante citometría de flujo (LSR Fortessa™, BD Biosciences, USA). Las muestras se excitaron utilizando un láser de fase sólida de 488 nm y se detectó fluorescencia de DiOC6(3) y 7-AAD a 530/30 nm y 630/30 nm, respectivamente. Los datos de citometría de flujo se analizaron utilizando el software FlowJo v. 7.6.2 (FlowJo, USA).
Análisis Estadístico
Se realizaron análisis de correlación de Pearson (r) y regresión lineal entre las variables convencionales y computarizadas de calidad seminal con las variables espermáticas evaluadas por citometría de flujo. Así mismo, se utilizó un análisis de regresión multivariado para determinar los modelos multiparamétricos de «mejor ajuste» para estimar la calidad espermática posdescongelación (Mocé y Graham, 2008). Para esto, se calculó el índice de calidad seminal (SQi) = ΣSp/100 n, donde Sp es cada parámetro seminal y n es el número de parámetros. En el cálculo del SQi se incluyeron los parámetros MT, MP, VE, MN y HOST. Los valores de SQi oscilan entre 0 y 1, donde Sqi = 1 representa el nivel máximo de calidad de espermática (Ortiz et al., 2013). Se consideraron como coeficientes de correlación y regresión significativos aquellos con un valor p<0.05. Todos los análisis se realizaron mediante el programa SAS v. 9.2 (SAS, USA).
RESULTADOS Y DISCUSIÓN
Los resultados de la evaluación de la calidad espermática por métodos convencionales, computarizados y citometría de flujo se presentan en el Cuadro 1. Se evaluaron un mínimo de cinco pajillas de semen congelado-descongelado por eyaculado, con la finalidad de reducir la variabilidad por efecto de la repetición. Se observó entre media y alta variabilidad en la mayoría de los parámetros de calidad seminal, siendo mayor en algunas poblaciones de espermatozoides según el ΔψM y la estabilidad de membrana.
Cuadro 1 Evaluación por métodos convencionales, computarizados y citometría de flujo, de semen bovino criopreservado
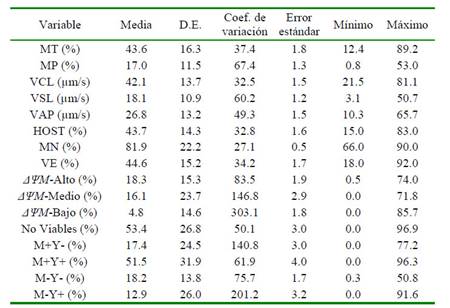
MT: movilidad total. MP: movilidad progresiva. VCL: velocidad curvilínea. VSL: velocidad lineal. VAP: velocidad media. MN: morfología normal. VE: vitalidad espermática. HOST: integridad funcional de membrana. ΔΨM-Alto: espermatozoides con potencial de membrana mitocondrial alto. ΔΨM-Medio: espermatozoides con potencial de membrana mitocondrial medio. ΔΨM-Bajo: espermatozoides con potencial de membrana mitocondrial bajo. M+Y-: espermatozoides criocapacitados no-apoptóticos. M+Y+: espermatozoides criocapacitados apoptóticos. M-Y-: espermatozoides no-criocapacitados no-apoptóticos. M-Y+: espermatozoides no-criocapacitados apoptóticos
La asociación entre los métodos para la evaluación de la movilidad, la cinética, la morfología y la integridad de membrana de los espermatozoides fue evidente en relación con la evaluación por citometría de flujo de la actividad mitocondrial, la viabilidad y la estabilidad de membrana. La presencia de poblaciones de espermatozoides con un potencial de membrana mitocondrial alto (ΔψM-Alto) se correlacionó de manera positiva y significativa con todos los parámetros de calidad seminal (p<0.05), a excepción de la morfología (Cuadro 2). Por otro lado, se hallaron correlaciones positivas (p<0.05) entre un potencial de membrana mitocondrial medio (ΔψM-Medio) y diferentes parámetros de calidad seminal, mientras en ningún caso se encontró asociación entre un potencial de membrana mitocondrial bajo (ΔψM-bajo) y los parámetros convencionales y computarizados de calidad espermática.
Cuadro 2 Coeficientes de correlación (r) entre métodos convencionales, computarizados y por citometría de flujo para la evaluación de semen bovino criopreservado
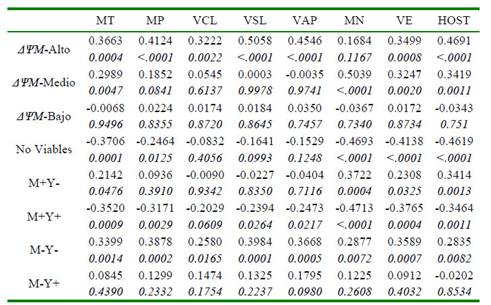
Los resultados se presentan como coeficiente de correlación (arriba), valor p (abajo). MT: movilidad total. MP: movilidad progresiva. VCL: velocidad curvilínea. VSL: velocidad lineal. VAP: velocidad media. MN: morfología normal. VE: vitalidad espermática. HOST: integridad funcional de membrana. ΔΨM-Alto: espermatozoides con potencial de membrana mitocondrial alto. ΔΨM-Medio: espermatozoides con potencial de membrana mitocondrial medio. ΔΨM-Bajo: espermatozoides con potencial de membrana mitocondrial bajo. M+Y-: espermatozoides criocapacitados no-apoptóticos. M+Y+: espermatozoides criocapacitados apoptóticos. M-Y-: espermatozoides no-criocapacitados no-apoptóticos. M-Y+: espermatozoides no-criocapacitados apoptóticos
Thomas et al. (1998) encontraron una correlación negativa entre la proporción de mitocondrias con un potencial de membrana mitocondrial bajo (fluorescencia verde) con la movilidad previa a la congelación (r=-0.81), y una correlación positiva entre el potencial de membrana mitocondrial alto (fluorescencia rojo-naranja), con la movilidad previa a la congelación (r=0.60). Sin embargo, estos investigadores no encontraron correlaciones significativas para ambos niveles de actividad mitocondrial con la movilidad espermática posdescongelación, lo cual difiere con lo encontrado en el presente estudio donde la actividad mitocondrial estuvo claramente asociada con la movilidad y la cinética posdescongelación de los espermatozoides (Cuadro 2). Según Mazur et al. (2000), el estado mitocondrial de los espermatozoides es crítico debido a su relación con el estado energético y la movilidad de la célula y, por lo tanto, se ha relacionado con la fertilidad.
Como era de esperarse, la presencia de células no viables se correlacionó negativamente con los indicadores de calidad seminal (Cuadro 2), aunque no se halló significancia para las variables de cinética espermática (VCL, VSL y VAP). Esto es acorde con lo reportado por Gürler et al. (2016), quienes aplicaron modelos polinomiales a los resultados de calidad de semen bovino incubado por 24 horas después de la congelación y descongelación, y hallaron coeficientes negativos simultáneamente para la movilidad progresiva, la integridad de membrana y del acrosoma y la actividad mitocondrial alta, demostrando un efecto adverso de la criopreservación sobre la viabilidad de los espermatozoides.
Los coeficientes de regresión estimados entre los niveles de actividad mitocondrial y los parámetros de calidad seminal coincidieron en la mayoría de los casos con las co rrelaciones encontradas entre estos, mostrando incrementos significativos en cada parámetro de calidad seminal ante el incremento dado en la población de espermatozoides con ΔψM-Medio y ΔψM-Alto (p<0.05) (Cuadro 3). Forero-Gonzalez et al. (2012) reportaron correlaciones positivas entre la movilidad y la función mitocondrial (r=0.66) y entre la membrana plasmática intacta y la función mitocondrial (r>0.90) de semen bovino criopreservado de forma convencional o automatizada.
Cuadro 3 Análisis de regresión entre parámetros convencionales y computarizados de calidad seminal con la actividad mitocondrial de semen bovino criopreservado
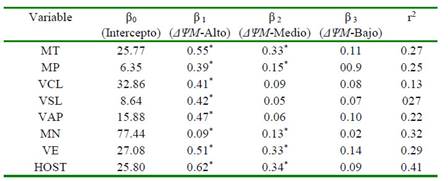
Coeficientes de regresión significativos (p<0.05)
MT: movilidad total. MP: movilidad progresiva. VCL: velocidad curvilínea. VSL: velocidad lineal. VAP: velocidad media. MN: morfología normal. VE: vitalidad espermática. HOST: integridad funcional de membrana. ΔΨM-Alto: espermatozoides con potencial de membrana mitocondrial alto. ΔΨM-Medio: espermatozoides con potencial de membrana mitocondrial medio. ΔΨM-Bajo: espermatozoides con potencial de membrana mitocondrial bajo. r2: coeficiente de determinación del modelo de regresión
Se observó una clara asociación entre las poblaciones de espermatozoides según su estabilidad de membrana con los parámetros convencionales de calidad seminal. Se encontraron coeficientes de correlación positivos entre la población de espermatozoides nocriocapacitados no-apoptóticos (M-Y-) y todos los parámetros convencionales y computarizados evaluados (p<0.05) (Cuadro 2). Así mismo, se hallaron coeficientes de regresión significativos entre dicha población y los distintos parámetros de calidad seminal (p<0.05) (Cuadro 4), demostrando incrementos significativos en la calidad del semen congeladodescongelado en la medida que se logra una mayor conservación de la estabilidad de membrana plasmática.
Cuadro 4 Análisis de regresión entre parámetros convencionales y computarizados de calidad seminal con la estabilidad de membrana (criocapacitación / apoptosis) de semen bovino criopreservado
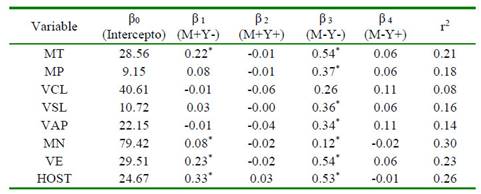
* Coeficientes de regresión significativos (p<0.05)
MT: movilidad total. MP: movilidad progresiva. VCL: velocidad curvilínea. VSL: velocidad lineal. VAP: velocidad media. MN: morfología anormal. VE: vitalidad espermática. HOST: integridad funcional de membrana. M+Y-: espermatozoides criocapacitados no-apoptóticos. M+Y+: espermatozoides criocapacitados apoptóticos. M-Y-: espermatozoides nocriocapacitados no-apoptóticos. M-Y+: espermatozoides no-criocapacitados apoptóticos. r2: coeficiente de determinación del modelo de regresión
Consecuentemente, la población de espermatozoides criocapacitados apoptóticos (M+Y+) presentó correlaciones negativas para la mayoría de los parámetros (p<0.05), mostrando la reducción general de la calidad espermática por la disminución en la estabilidad de la membrana plasmática (Cuadro 2).
A pesar de esto, los coeficientes de regresión estimados para dicha población no fueron significativos. Por otro lado, se hallaron coeficientes de regresión positivos entre la población de espermatozoides criocapacitados no-apoptóticos (M+Y-) con MT, MN, VE y HOST (p<0.05), mostrando que la reducción en la presentación del proceso de apoptosis de los espermatozoides criopreservados influye positivamente en la calidad posdescongelación de las muestras de semen.
Al respecto, se sabe que la funcionalidad mitocondrial también puede ser necesaria para la capacitación del esperma, dado que, se ha observado un pico en el consumo de oxígeno durante la capacitación in vitro y la reacción acrosómica inducida por la progesterona en espermatozoides bovinos y porcinos (Cordoba et al., 2006, Ramio-Lluch et al., 2011). Además, está bien establecido que varias proteínas mitocondriales de los espermatozoides se someten a la fosforilación de la tirosina dependiente de la capacitación (Shivaji et al., 2009). Por otro lado, fenómenos similares a la apoptosis como la disminución de la viabilidad, movilidad y ΔψM, así como aumentos en el daño al ADN, defectos de morfología y peroxidación de lípidos, se han asociado al exceso de especies reactivas de oxígeno y al desequilibrio en las defensas antioxidantes disponibles (Amaral et al., 2013). En el semen bovino se han reportado cambios similares a la apoptosis por efecto de la criopreservación (Martin et al., 2004).
No obstante que diferentes autores no han encontrado relación entre los niveles de apoptosis del semen bovino criopreservado y la fertilidad en campo (Anzar et al., 2002, Dogan et al., 2013), un estudio reciente demostró como tanto el estado de apoptosis, como otros indicadores de la pérdida de la estabilidad de membrana y la viabilidad del semen criopreservado de búfalo están correlacionados negativamente con la fertilidad en campo (Singh et al., 2016). Así mismo, se han establecido modelos de regresión altamente predictivos de la fertilidad del semen bovino, mediante la inclusión de diferentes parámetros de calidad seminal (Kirk et al., 2005; Mocé y Graham, 2008). En la presente investigación se construyeron modelos de regresión a partir de los parámetros derivados de las evaluaciones por citometría de flujo, empleando el índice de calidad seminal (SQi) como variable dependiente.
El Cuadro 5 presenta los mejores modelos de regresión para el SQi, según el número de variables incluidas a partir de la evaluación por citometría de flujo de la estabilidad de membrana y la actividad mitocondrial. Para el SQi del semen criopreservado se encontró un valor promedio de 0.43 ± 0.12 (media ± DE), cuyos resultados estuvieron en un rango entre 0.21 y 0.80. Los máximos coeficientes de determinación (r2), se alcanzaron en los modelos de cuatro variables, donde se incluyeron todas las poblaciones de espermatozoides según su potencial de membrana mitocondrial y alguna de las poblaciones con espermatozoides no-apoptóticos del análisis de estabilidad de membrana. Lo anterior, muestra como la actividad mitocondrial y el estado de apoptosis aportan de forma importante a la calidad seminal, y deja abierta la posibilidad de incluir otros parámetros evaluados por citometría de flujo en modelos de regresión, con la finalidad de incrementar la predictibilidad de la fertilidad potencial del semen bovino criopreservado.
Cuadro 5 Mejores modelos de regresión para la calidad seminal del semen criopreservado bovino con relación a la evaluación por citometría de flujo de la estabilidad de membrana y la actividad mitocondrial

SQi: índice de calidad seminal. r2: coeficiente de determinación del modelo de regresión ΔΨM-Alto: espermatozoides con potencial de membrana mitocondrial alto. ΔΨM-Medio: espermatozoides con potencial de membrana mitocondrial medio. ΔΨM-Bajo: espermatozoides con potencial de membrana mitocondrial bajo. M+Y-: espermatozoides criocapacitados no-apoptóticos. M+Y+: espermatozoides criocapacitados apoptóticos. M-Y-: espermatozoides no-criocapacitados no-apoptóticos
CONCLUSIONES
El potencial de membrana mitocondrial de los espermatozoides derivado de la evaluación por citometría de flujo se encuentra altamente asociado con la calidad espermática estimada por métodos convencionales y computarizados en el semen bovino congelado-descongelado. El semen con alto potencial de membrana mitocondrial tiende a presentar resultados favorables en la movilidad, la cinética, la morfología, la vitalidad y la integridad funcional de membrana plasmática.
La estabilidad de membrana derivada de la evaluación por citometría de flujo de la criocapacitación y la apoptosis de los espermatozoides se encuentra altamente asociada con la calidad espermática estimada por métodos convencionales y computarizados, en el semen bovino congelado-descongelado. La población de espermatozoides no-criocapacitados noapoptóticos tiende a presentar resultados favorables en la movilidad, la cinética, la morfología, la vitalidad y la integridad funcional de membrana plasmática.












 uBio
uBio 

