INTRODUCCIÓN
Bolivia y Perú concentran la mayor población de llamas a nivel mundial, parte del cual ofrece seguridad alimentaria a las poblaciones altoandinas de ambos países. Sin embargo, una de las limitantes de su crianza son los bajos índices de fertilidad (Díaz et al., 2011). Entre los factores que afectan a la reproducción en los camélidos sudamericanos se encuentra la baja calidad del semen, especialmente la reducida concentración de espermatozoides (Giuliano et al., 2008). En este sentido, la introducción de la tecnología CASA(ComputerAssisted SemenAnalysis) en el estudio de la evaluación seminal de camélidos viene permitiendo una valoración más precisa de la calidad seminal (Soler et al., 2014a,b; Cucho et al., 2019).
Un factor relativo a la baja movilidad espermática se refiere a la presencia de una elevada viscosidad (Casaretto et al., 2012), consecuencia de la presencia de glicosaminoglicanos y mucina 5B (Kershaw-Young y Maxwell, 2012). Esta viscosidad dificulta la separación de los espermatozoides del plasma seminal, la dilución del eyaculado, la homogenización de las muestras, la separación en alícuotas y el envasado en pajuelas (Tibary y Vaughan, 2006). Para solventar estos problemas se suele acudir al empleo de enzimas como la papaína, presente en la papaya (Carica papaya), la cual mostró resultados promisorios en semen de alpaca (Morton et al., 2008). Posteriormente Kershaw-Young et al. (2013) reportaron que la papaína reducía la viscosidad del semen, sin afectar el porcentaje de espermatozoides vivos, la integridad del ADN y del acrosoma de los espermatozoides de alpaca.
El objetivo de este estudio fue determinar el efecto de la incubación en papaína sobre la cinética de los espermatozoides de llama utilizando los parámetros de evaluación espermática del sistema CASA-Mot (ISAS®).
MATERIALES Y MÉTODOS
Lugar del Estudio y Animales
El estudio fue realizado en el Centro de Investigación en Camélidos Sudamericanos CICAS -La Raya, de la Universidad Nacional de San Antonio Abad del Cusco. El Centro se encuentra ubicado en el distrito de Maranganí, provincia de Canchis, departamento del Cusco, Perú, a una altitud de 4130 msnm. El área pertenece a la zona de vida de páramo húmedo-subalpino subtropical (Holdridge, 1967).
El estudio se efectuó entre febrero y junio de 2018. Se seleccionaron cuatro llamas Ch’aku, de 5-8 años de edad, peso 118.13 ± 10.62 kg, sin problemas reproductivos y pertenecientes al plantel de reproductores del CICAS La Raya. El tamaño del testículo izquierdo fue de 4.37 ± 0.33 x 3.50 ± 0.16 cm, y el derecho fue de 4.78 ± 0.71 x 3.80 ± 0.64 cm. Los animales eran alimentados en pradera natural, compuesto de cuatro especies predominantes: Stipa obtusa, Festuca sp, Calamagrostis amoena y Scirpus rigidus.
Colección de Semen
La colección de semen fue realizada por el método de vagina artificial y maniquí. Las llamas fueron entrenadas durante dos semanas para que aceptaran al maniquí, al cual se le rociaba con secreciones vaginales en la zona de la grupa. Se empleó una vagina artificial de ovinos (Minitube®, Alemania), que se cubrió con una frazadilla eléctrica para mantener la temperatura a 37 °C, según técnica descrita por Bravo et al. (1997). El intervalo entre las colectas de semen fue de una semana, hasta obtener cuatro colectas adecuadas por animal. El semen fue colectado en tubos Falcon graduados de 15 ml.
Tratamiento del Semen
El semen colectado fue separado en dos alícuotas. Una se empleó para el análisis en fresco y a la otra se le añadió papaína (Sigma Aldrich®) disuelta enTris (0.1 mg/ml de Tris) en una proporción de 1:1, manteniéndose durante 20 minutos a 37°C en un baño seco. A continuación, se agregó 20 µl del inhibidor de papaína (E-64, SigmaAldrich®) por mililitro de dilución de semen con papaína durante 5 min y conservando la misma temperatura (Crichton et al., 2015).
Análisis del Semen
Se evaluó el volumen (ml) y la filancia (cm) definida como la capacidad de formar filamentos (Giuliano, 2012). La concentración de espermatozoides (millones de espermatozoides por mililitro) se determinó con un Spermtrack® (Proiser R+D, España), empleando 3 µl de semen.
El porcentaje de espermatozoides vivos se determinó empleando 5 µl tanto de semen. eosina y nigrosina (Minitube®,Alemania). La funcionalidad de la membrana esper-mática (HOS) se realizó usando una solución de 50 mOsm/kg, donde los espermatozoides con las colas hinchadas y dobladas indicaron una reacción positiva al HOS (Quispe et al., 2015). El porcentaje de espermatozoides con acrosoma reaccionado de evaluó con azul de Coomassie (Sigma-Aldrich®), según lo descrito por Fumuso et al., 2014) donde los espermatozoides con el acrosoma intacto mostraban una coloración azul. Todos los análisis se realizaron en un microscopio de contraste de fases (Proiser-UOP-UB200i) 400x y con no menos de 200 espermatozoides por muestra.
Análisis de la Cinética de los Espermatozoides
La movilidad de los espermatozoides se evaluó utilizando un sistema CASA-Mot (ISAS®v1, Proiser), que incluía un microscopio de contraste de fase (Proiser-UOPUB200i) con un objetivo de contraste de fase negativo de 10x y una videocámara (Ximea MQ003MG-CM, Alemania). Se determinaron las siguientes variables:
- Movilidad total (MT; %). Porcentaje de células móviles dentro de la muestra.
- Movilidad progresiva (MP; %). Espermatozoides con un valor del STR superior al 75%.
- Velocidad curvilínea (VCL; µm/s). Ve locidad de la cabeza del espermatozoide a lo largo de la trayectoria curvilínea.
- Velocidad rectilínea (VSL; µm/s). Velo cidad a lo largo de la trayectoria entre el punto inicial y final de la trayectoria del espermatozoide.
- Velocidad promedio (VAP; µm/s). Velo cidad de la cabeza de un espermatozoi de a lo largo de su trayectoria media (Amann y Waberski, 2014; Valverde y Madrigal-Valverde, 2018).
-Índices de rectitud (STR = VSL/VAP; %), linearidad (LIN = VSL/VCL; %) y oscilación (WOB = VAP/VCL; %). Caracterizan la calidad del movimiento espermático (Mortimer, 2000; Meza et al., 2018).
-Amplitud del desplazamiento lateral de la cabeza (ALH; µm). Desviación de la trayectoria curvilínea respecto de la media
-Frecuencia de batido de la cola (BCF, Hz). Número de las intersecciones de la trayectoria curvilínea y la trayectoria promedio (Amann y Waberski, 2014).
Las áreas de las partículas capturadas estuvieron comprendidas entre 5 y 60 µm2, y se analizó según una conectividad de 10.
Diseño Estadístico
Se usó estadística descriptiva para el volumen, filancia, concentración, espermatozoides vivos, funcionalidad de la membrana espermática y reacción acrosomal. Se realizó un análisis de correlación de Pearson entre el volumen y filancia.
La normalidad de la distribución de los datos de cinética espermática (VCL, VSL, VAP, LIN STR, ALH y BCF) y las movilidades (MT y MP) se analizaron con el test de Shapiro-Wilk. La homogenidad de varianzas se determinó con el test de Levene. La ALH y la MP no presentaban distribución normal y fueron transformadas por su raíz cuadrada para los cálculos subsiguientes. El efecto de la papaína en la MT, MP y los parámetros de cinética espermática fueron evaluados con un arreglo factorial en bloques completamente al azar, donde la comparación de medias se realizó con la prueba de Duncan (α=0.05). Las pruebas estadísticas fueron realizadas con el programa R v.3.6.0.
RESULTADOS
Semen
Las colectas tuvieron una duración promedio de 27.0 ± 6.3 minutos. El 80% de las colecciones de semen fueron aceptables. El restante 20% presentó concentraciones de espermatozoides menores a 25 x 106/ml, contaminación con orina o eyaculación parcial, lo que motivó su exclusión del estudio. En total, se analizaron 16 muestras de semen, cuatro de cada animal.
Las características seminales se muestran en el Cuadro 1. El volumen y la filancia se mostraron moderadamente correlacionados (r=0.51).
Cinética Espermática
La MT (%) en semen fresco y degelificado con papaína fue similar entre tratamientos, aunque con una tendencia a mejores valores en el semen degelificado (Cuadro 2). Asimismo, se pudo observar valores heterogéneos. La MP (%) fue significativamentesuperior enel semen tratado con papaína, tanto en el promedio general como individual (con excepción de un animal) (Cuadro 2).
Cuadro 2 Movilidad total y progresiva (promedio ± DE) en semen de llama fresco y degelificado con papaína (4 muestras por macho)
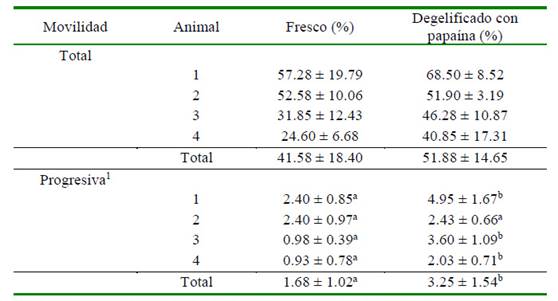
a,b Letras diferentes dentro de filas indican diferencia significativa (p<0.05)
1 Los espermatozoides progresivos muestran un índice de rectitud (STR) >75%
La mayoría de las variables (MT, MP, VCL, VSL, VAP, LIN, STR y BCF) mostraron un incremento significativo (p<0.05) tras la incubación con papaína y solamente el WOB y ALH presentaron valores similares entre tratamientos (Cuadro 3).
Cuadro 3 Movilidad total y progresiva, y parámetros de cinética espermática (promedio ± DE) en semen de llama fresco y degelificado con papaína (16 muestras por tratamiento)
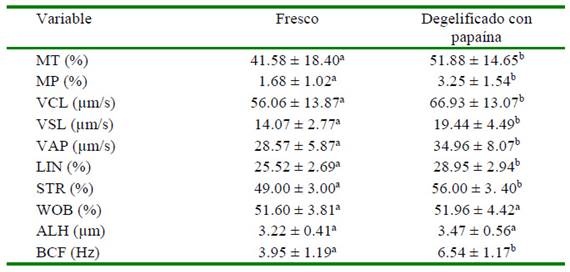
MT: movilidad total; MP: Movilidad progresiva; VCL: velocidad curvilínea; VSL: velocidad rectilínea; VAP: velocidad promedio; LIN: índice de linealidad; STR: índice de rectitud; WOB: índice de oscilación; ALH: amplitud del desplazamiento lateral de la cabeza; BCF: frecuencia de batido de la cola
a,b Letras diferentes dentro de filas indican diferencia significativa (p<0.05)
DISCUSIÓN
Semen
La colección de semen por vagina artificial requiere que los machos tengan una libido adecuada. En este estudio se tuvo una eficiencia de 80% en las colecciones de semen, lo cual estuvo dentro de los rangos reportados (Aller et al., 2003; Giuliano et al., 2008). El tiempo de colecta (27.0 ± 6.3 minutos) fue mayor a los reportados por Aller et al. (2003), de 18.5 minutos, Godoy (2014) de 20 minutos y Giuliano et al. (2008) de 15 a 20 minutos, bajo las condiciones de crianza de Chile yArgentina, respectivamente, por lo que las diferencias observadas podrían deberse a las diferentes condiciones ambientales, sin poderse descartar el efecto del animal, en especial en lo referente a su libido. Asimismo, el volumen colectado (7.99 ± 1.95 ml), fue muy superior a otros reportes (Giuliano et al., 2008; Quispe y Delgado, 2012; Valle, 2013; Godoy, 2014), quienes reportan valores entre 1.6 a 5.5 ml. Cabe señalar que esta variable también es muy dependiente de la libido del macho, y de la estación reproductiva (Giuliano et al., 2008).
Quispe y Delgado (2012), reportaron una filancia de 5.2 cm, superior a la observada en el presente trabajo (3.88), mientras que Ccalta et al. (2017) y Ríos (2014), hallaron valores inferiores, de 2.38 y 3.62 cm, respectivamente, en alpacas y colectadas por el método de poscópula. Se observó una correlación positiva y moderada (r=0.51) entre el volumen y la filancia, lo que sugiere que un incremento del volumen también incrementaría la filancia.
La concentración espermática observada (146.18 ± 64.83 x 106/ml), es mayor a las halladas por Quispe y Delgado (2012) de 99 x 106/ml, por Giuliano et al. (2008) de 69.07 a 82.24 x 106/ml, y por Godoy (2014) de 33.3 x 106/ml. Estas diferencias, si bien podrían deberse a la libido de los animales, podrían también deberse al instrumento de medición utilizado, ya que todos ellos emplearon una cámara hemocitométrica, mientras que en el presente estudio se utilizó un Spermtrack®, que ha mostrado mejores resultados que las cámaras de Neubauer para estas evaluaciones (Soler et al., 2012; Crespilho et al., 2017). Por otro lado, el porcentaje de espermatozoides vivos (70.23%) estuvo dentro de los rangos reportados en la literatura (Aller et al., 2003; Giuliano et al., 2008; Quispe y Delgado, 2012; Valle, 2013: Godoy, 2014).
La funcionalidad de la membrana espermática del estudio (54.31%) fue superior a las reportadas por Giuliano et al. (2008) de 29.5-30.4%, utilizando el mismo método de colección y con una solución hipoósmotica también ajustada a 50 mOsm/kg, o las halladas por Santa Cruz et al., (2016) de 31.349.1% de muestras de semen colectadas por electroeyaculación. Es posible que estas diferencias se deban a la mejor calidad de semen de este estudio, el cual se refleja en el volumen, concentración y porcentaje de espermatozoides vivos encontrados.
La reacción acrosomal de 67.36% fue inferior a los valores reportados por Fumuso et al. (2014) y Carretero et al. (2015) en semen de llama colectado por electro eyaculación. Esta variable es de gran importancia pues permite evaluar los efectos de varias biotecnologías reproductivas (Giuliano et al., 2012).
Cinética Espermática
La MT en semen fresco no mostró diferencias significativas entre animales, en contraposición a lo reportado por Meza et al. (2018) en espermatozoides de alpacas recuperados de los conductos deferentes. En dicha publicación, los valores de MT fueron similares a los encontrados en el presente estudio (41.7%), utilizando el mismo sistema CASA. Por su parte, Quispe y Delgado (2012) y Valle (2013), reportaron valores superiores en semen de llamas, aunque con evaluaciones subjetivas.
Kershaw et al. (2017) hallaron un descenso de la movilidad espermática a los 30 minutos del tratamiento con papaína en semen de alpaca, descenso que fue más lento al ser tratado con 0.1 mg/ml de dicha enzima, concentración empleada en este estudio al incubar el semen de llama. Por su parte, Flores et al. (2015) mostraron que la MT de los espermatozoides de alpaca se veía incrementada al emplear colagenasa.
Monaco et al. (2016) evaluaron el efecto del tratamiento con papaína en la viscosidad y la MP del semen de dromedario, reportando una disminución lineal de la viscosidad hasta los 120 minutos, así como un incremento de la MP a los 20 minutos para luego descender igualmente en forma lineal, sin encontrar una explicación plausible para tal fenómeno. En el presente estudio se observó un comportamiento similar de la viscosidad, dado que hubo un mayor MP tras el degelificado con papaína. Este efecto fue también observado por El-Bahrawy et al. (2017) en semen de dromedarioincubado con α-amilasa, bromelina y papaína.
En su mayoría, los valores de movilidad espermática reportados y que provienen de evaluaciones subjetivas (Valle, 2013; Quispe y Delgado, 2014) son mayores a los encontrados en este estudio, lo que puede ser explicado por el tipo de análisis de movilidad. Los sistemas CASA-Mot (Soler et al., 2016; Holt et al., 2018) generalmente ignoran como móviles a los espermatozoides que no muestran desplazamiento, mientras que en los análisis subjetivos el movimiento de la cola de los espermatozoides se incluye dentro de la movilidad.
Los parámetros de la cinética espermática observados en el presente estudio fueron menores a los reportados por Rodríguez (2013) y Flores et al. (2015) en semen de llamas y alpacas, respectivamente, ambos colectados por electroeyaculación, así como en semen de dromedario (El-Bahrawy et al., 2017; Malo et al., 2019). En forma similar, en semen de alpaca recuperados de los conductos deferentes (Meza et al., 2018). En el presente estudio se ha puesto de manifiesto que el tratamiento con papaína indujo un incremento de los parámetros de la cinética espermática considerados (VCL, VSL, VAP, LIN, STR, WOB, ALH, BCF), lo que también fue observado por El-Bahwary et al. (2017), en las variables de VCL, VSL y VAP en semen de dromedario incubado con αamilasa, bromelina y papaína.
La VAP se ha mostrado como el parámetro predictor más importante de la fertilidad en semen de toros (Nagy et al., 2015) y de burros (Dorado et al., 2013). Otro de los indicadores de fertilidad empleados en toros es la habilidad del espermatozoide de hiperactivarse (Shojaei et al., 2012), siendo los parámetros comúnmente usados para identificar este estado, los valores elevados de la VCL y de ALH y los valores bajos de LIN. En este trabajo no se encontró alteraciones en la ALH, lo que indicaría que, con el proceso de incubación en papaína, no se ha inducido dicho estado de hiperactivación en los espermatozoides de las llamas.
CONCLUSIONES
Se encontró un incremento significativo (p<0.05) de las variables cinemáticas analizadas [movilidad total (MP), movilidad progresiva (MP), velocidad curvilínea (VCL), velocidad rectilínea (VSL), velocidad promedio (VAP), índice de linealidad (LIN), índice de rectitud (STR), índice de oscilación (WOB), amplitud del desplazamiento lateral de la cabeza (ALH) y frecuencia de batido de la cola (BCF)] en el semen de llama incubado con papaína en relación al semen fresco
Los resultados sugieren que el tratamiento con papaína mejora la movilidad total y progresiva, y la mayoría de los parámetros de cinética espermática del espermatozoide de llama, sin llegar a inducir su hiperactivación.












 uBio
uBio 


