INTRODUCCIÓN
El éxito de los programas de inseminación a tiempo fijo (IATF) y de la producción de embriones in vivo (MOET) e in vitro (PIV) está influenciado por el estado folicular individual de los animales antes de iniciar los tratamientos hormonales (Lonergan et al., 2003) y, si bien la dinámica folicular puede ser evaluada mediante ecografía (Ayala et al., 2019), se complica cuando se requiere trabajar con varios animales a la vez, especialmente en sistemas de explotación extensivos (Bo et al., 1995).
Una posible estrategia es el control exógeno de la onda folicular previo al inicio de la aplicación de protocolo para la IATF o MOET (Kohram et al., 1998), utilizando estradiol más progesterona/progestágenos para suprimir la liberación de FSH e inducir la atresia folicular, permitiendo el surgimiento de una nueva onda folicular (Bo et al., 1993, 1995). También, en reemplazo de los estrógenos se puede estimular el reinicio de la onda folicular mediante la aplicación de GnRH, siempre que exista un folículo dominante que pueda ovular (Martinez et al., 1999). Diversos estudios han demostrado que la administración de GnRH en etapas aleatorias del ciclo estral produce ovulación en el 44 a 54% de las vacas lecheras (Bello et al., 2006; Colazo et al., 2009), en el 56% de novillas de carne (Martinez et al., 1999) y en el 60% de vacas de carne (Small et al., 2009); sin embargo, el nivel de respuesta es demasiado inconsistente para el éxito de un programa de MOET.
Otra alternativa para sincronizar la onda folicular es eliminar el efecto supresor del folículo dominante (FD) mediante la ablación folicular guiada por ultrasonido (Bergfelt et al., 1994; Bungartz y Niemann, 1994), e iniciar la superovulación 1-2 días más tarde. Si bien la ablación del FD es altamente efectiva, tiene como desventaja que se requiere un equipo de ultrasonido y personal capacitado para operarlo, lo cual dificulta la aplicación de esta tecnología a nivel de campo.
Estas alternativas han sido evaluadas en varias razas bovinas de carne criadas principalmente en el trópico bajo (Dorneles et al., 2017) y en sistemas intensivos de producción de leche (Quispe et al., 2014; Hidaka et al., 2018), lo cual ha permitido estandarizar el momento del reinicio de la onda folicular en el bovino. Sin embargo, hay diferencias en la fisiología ovárica entre Bos indicus y Bos taurus; así se reporta 42.7 y 19.7 folículos entre 2 y 5 mm en una onda folicular en B. indicus (Nelore) y B. taurus (Holstein), respectivamente, así como FD en el proceso de desviación de 8.3 y 9.8 mm en B. indicus y B. taurus, respectivamente (Bastos et al., 2010).Además, se reporta que vacas Holstein con folículos entre 7 y 8.5 mm no llegaron a ovular con la aplicación de LH (Sartori et al., 2001), mientras que Gimenes et al. (2008) reporta ovulaciones en el 33% de vacas B. indicus. Asimismo, se observan diferencias entre estas especies en el volumen del cuerpo lúteo y la concentración de estrógenos y progesterona (Sartori et al., 2016).
Aparte de las diferencias fisiológicas entre razas de B. indicus y B. taurus, se deben considerar diferencias entre y dentro de razas, Así, Morotti et al. (2018) reportaron diferencias individuales en el recuento de folículos antrales altos y bajos en vacas Nelore, en tanto que razas autóctonas presentan características ováricas particulares, que podrían modificar el reinicio de la onda folicular (Chasombat et al., 2013; Ayala et al., 2019). Toda esta información permite suponer que el reinicio de la onda folicular estimulada por la aplicación del benzoato de estradiol, GnRH o la ablación del FD en la fase tardía de la primera onda folicular, podría tener una respuesta diferente en vaquillas Holstein mestizas, criadas en fincas lecheras y alimentadas al pastoreo. Por lo tanto, el objetivo de este estudio fue caracterizar el comportamiento del FD, el perfil de la FSH y estradiol, y el reinicio de la nueva onda folicular, luego de la aplicación de una dosis de benzoato de estradiol o de GnRH, o la ablación folicular en la fase tardía de la primera onda folicular.
MATERIALES Y MÉTODOS
Localización
El estudio se realizó entre julio y diciembre de 2018 en la Granja Experimental de Irquis, Universidad de Cuenca, Ecuador. La zona se encuentra a una altitud de 2671 msnm, y presenta una precipitación promedio anual de 1078 mm y temperatura entre 7 a 12 °C.
Animales y Manejo
Se utilizaron nueve vaquillas Holstein mestizas, con peso promedio de 427.7±23.0 kg, condición corporal de 2.7±0.1 (escala de 1 a 5) y edad de 26.7±1.4 meses. Las vaquillas no habían sido inseminadas previamente y todas se encontraban en el día 6 del ciclo estral (metaestro tardío) al iniciarse el estudio. Los animales fueron manejados en un grupo común, y se alimentaban con una mezcla de kikuyo (Pennisetum clandestinum), ray gras inglés (Lolium perenne) e italiano (Lolium multiflorum), y recibían 2.5 kg de concentrado/día, 100 g/animal de sales minerales y agua ad libitum. En el trabajo se aplicó la normativa del código sanitario para animales terrestres, capitulo 7.8 «Utilización de animales en la investigación y educación» de la Organización Mundial de Sanidad Animal (OIE, 2019), el cual permite asegurar el bienestar de los animales.
Protocolo de Sincronización Pre-experimento
La sincronía del ciclo estral de las vaquillas se realizó mediante un protocolo estándar de IATF, al inicio de cada repetición. Día -15: implante de progesterona (DIB® 0.5 g, Syntex, Argentina) + 2 mg de benzoato de estradiol (Grafoleón®, Life, Ecuador) IM; Día -8: retiro del implante + 0. 5 mg de cloprostenol sódico (Lutaprost® 250) IM. Además, se colocó un parche colorimétrico para facilitar la detección de celo en la región lumbosacra; Día -7: 1 mg de benzoato de estradiol, IM; Día -5: se verificó mediante ultrasonografía el tamaño y la ubicación del folículo preovulatorio; Día -3: confirmación ecográfica de la ovulación; Día 0: (día 6 post celo), se confirmó la presencia del cuerpo lúteo (CL) >15 mm y un folículo dominante >10 mm, condiciones necesarias para que las vaquillas se asignaran aleatoriamente a uno de los tres tratamientos experimentales.
Tratamientos
En el día 6 pos-celo (Día 0) se inició la aplicación de los tratamientos. Se aplicó un diseño de cuadrado latino de 3x3 con tres tratamientos y tres repeticiones: T1: 2 mg de benzoato de estradiol - BE, (Grafoleón®, Life, Ecuador), IM (n=9); T2: 0.25 mg de gonadorelina (Fertagyl®, MSD Intervet, Ecuador), IM (n=9); T3: ablación de folículos >5 mm (n=9).
La valoración del FD se realizó mediante ecografía transrectal (Aloka, Prosoun 2, Japón) con una sonda lineal de 7.5 MHz cada 24h (06:00), durante cinco días consecutivos. Se determinó el ancho y el largo del FD (en mm). Asimismo, se realizaron chequeos ecográficos de ambos ovarios cada 24 h, mediante un barrido dorsoventral y latero-medial para identificar la emergencia de un nuevo grupo de folículos <4 mm y cuantificar el número de estos folículos.
A partir del Día 0 y por cinco días consecutivos se colectaron 10 ml de sangre de la vena coccígea (06:00) en tubos sin anticoagulante. Las muestras se centrifugaron a 3000 g durante 20 min y el suero sobrenadante fue congelado a -20 °C hasta la medición de las hormonas. La determinación de las concentraciones de FSH y estradiol (Steranti Research, UK) fueron realizadas mediante radioinmunoensayo. El rango de la curva estándar para FSH fue de 0.13 a 16 ng/ml y la sensibilidad del ensayo de 0.2 ng/ml. Los coeficientes de variación de los estándares de referencia bajos y altos fueron 6.5 y 5.8%, respectivamente. En el caso del estradiol la curva estándar varió entre 5 a 400 pg/ml, sensibilidad de 5.2 pg/ml, coeficiente de variación intra-ensayo de 8.1%.
Análisis Estadístico
Se utilizó el programa SPSS v. 25®. El efecto de los tratamientos sobre las variables comportamiento del FD (tamaño), y niveles de estradiol y FSH y el momento del reinicio de la onda folicular fueron determinados mediante análisis de varianza. Para la comparación de medias se utilizó la prueba de Tukey al 5%.
RESULTADOS Y DISCUSIÓN
El tamaño del FD en los tres tratamientos fue similar al inicio del experimento (Día 0): T1 = 12.7±0.67 mm, T2 = 12.9±0.96 mm, T3 = 12.2±0.69 mm. Estos valores concuerdan con un trabajo previo de este grupo de investigación en vaquillas Holstein receptoras en el día 6 del ciclo estral (Ayala et al., 2017); sin embargo, los FD fueron más pequeños a los obtenidos por Sartori et al. (2004) y Echternkamp et al. (2009), quienes reportaron FD en vaquillas Holstein de15.0±0.2 mm y 14.0±0.3 mm, respectivamente.
El comportamiento del FD presentó diferencias significativas entre T1 y T2 (p<0.05) a partir del día 1 (Figura 1). Las vaquillas que recibieron GnRH (T2) presentaron una reducción marcada del tamaño del FD en los dos primeros días (día 1: 2.3 mm y día 2: 2.7 mm), mientras que fue menor em los siguientes dos días (0.5 y 0.3 mm). Esta disminución drástica del tamaño del FD luego del tratamiento fue producto de la ovulación ocurrida. Se determinó que 5 de las 9 vaquillas tratadas con GnRH (55.5%) ovularon en las primeras 24 h y las restantes entre 24 y 48 h (1.4±0.02 días), lo cual concuerda con lo descrito por Martínez et al. (1999), quienes mencionan que la aplicación de GnRH desencadena la ovulación en caso se encuentre presente un FD. Asimismo, Bello et al. (2006) describieron que contar con FD y un CL funcional en el momento de la aplicación de GnRH permite elevar el porcentaje de ovulación en vacas lecheras a un 85%, lo cual podría explicar el 100% de ovulación en el presente trabajo, ya que las nueve vaquillas tenían CL funcional y un FD >10 mm.
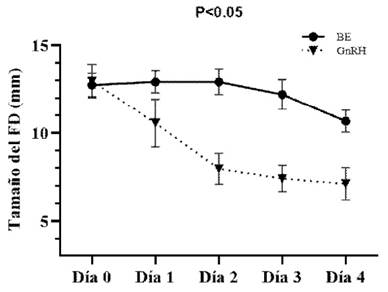
Figura 1 Comportamiento del folículo dominante (FD), expresado en media y error estándar (mm), en los tratamientos T1=Benzoato de estradiol (BE) y T2=GnRH, durante los primeros cuatro días de la aplicación
El FD de los animales de T1 que recibieron BE (Día 0) presentó un patrón de comportamiento diferente a las vaquillas de T1 (GnRH). Así, el FD incrementó 0.22 mm en promedio las primeras 24 h, para luego entrar mantener ese tamaño y recién en el día 3 y 4 reducir su tamaño en 0.7 y 1.7 mm, respectivamente (Figura 1), de allí que se puede notar que la aplicación de BE en el día 6 del ciclo estral no generó atresia inmediata del FD, comportamiento que concuerda con lo reportado por Bo et al. (1993) al aplicar 5 mg de valeriato de estradiol en el día 6 del ciclo estral.
Los niveles de FSH fueron similares al inicio del experimento en los tres tratamientos (0.27±0.09, 0.14±0.02 y 0.34±0.09 ng/ml para T1, T2 y T3, respectivamente). El pico de FSH fue observado a las 24 h de la aplicación de GnRH (0.71±0.19 ng/ml) y de la ablación folicular (0.99±0.19 ng/ml) (Figura 2). Valores similares han sido descritos por Ramos et al. (2010) a las 24 h de la ablación folicular y también por Bergfelt et al. (1994) en vaquillas mestizas. Por otro lado, las vaquillas de T1 (BE) tuvieron la mayor concentración de FSH (0.87±0.21 ng/ml) a las 48 h del tratamiento (Figura 2), lo cual concuerda con lo descrito por Bo et al. (1993) al aplicar valeriato de estradiol y por Ramos et al. (2010) al aplicar BE en vaquillas.
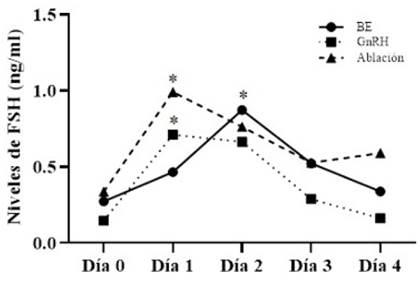
Figura 2 Comportamiento de la hormona folículo estimulante (FSH), expresado en media (ng/ ml), en los tratamientos T1=Benzoato de estradiol (BE) y T2=GnRH, durante los primeros cuatro días de la aplicación. (*) Diferencia significativa dentro de cada tratamiento que permite determinar el pico de FSH
Los niveles de estradiol en sangre fueron similares al inicio del experimento en los tres tratamientos (60.3±5.16, 47.8±7.05 y 57.9±3.80 pg/ml para T1, T2 y T3, respectivamente), llegándose a casi duplicar a las 24 h de la aplicación de BE en las vaquillas de T1 (103.9±14.41 pg/ml) aunque inferiores a los reportados por Bo et al. (1993) al aplicar 5 mg de valeriato de estradiol (150 pg/ml). Los valores de estradiol en T2 y T3 se mantuvieron constantes en el día 2 (59.9±12.40 y 58.3±5.75 pg/ml en T2 y T3, respectivamente, para recién elevarse en el día 3 y 4 (Figura 3). En este sentido, Macmillan y Thatcher (1991) describieron que los niveles de estradiol por efecto de la aplicación de buserelina en el día 12 del ciclo estral en ganado de carne se mantuvieron constantes.
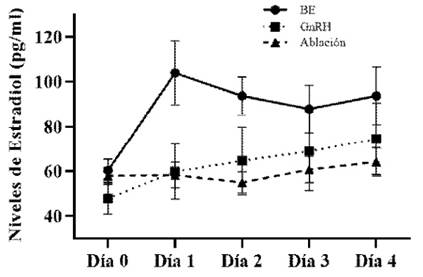
Figura 3 Comportamiento del estradiol en suero sanguíneo, expresado en media (pg/ml), en los tratamientos T1=Benzoato de estradiol (BE), T2=GnRH y T3=Ablación folicular, durante los primeros cuatro días de la aplicación
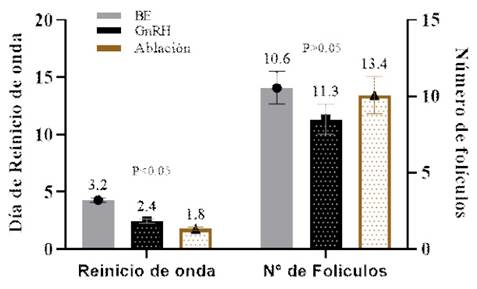
Figura 4 Intervalo al reinicio de la onda folicular y número de folículos al momento de reinicio de la onda folicular en vaquillas Holstein mestizas, en los tratamientos T1=Benzoato de estradiol (BE), T2=GnRH y T3=Ablación folicular
Se encuentra descrito que el 17β estradiol se ha utilizado con éxito para sincronizar la emergencia de ondas foliculares en el ganado bovino (Bo et al., 2002). En el presente trabajo, la aparición de una nueva cohorte de folículos <4 mm estuvo conformada por 10.6±1.1 folículos a los 3.2±0.2 días en T1 (BE). Se presentó antes de los 4.7±0.2 días reportados para vacas Angus por Bo et al. (1995), al aplicar 5 mg de 17β-estradiol en el día 6 del ciclo estral, aunque después de los 2.5±0.2d reportado por Sá Filho et al. (2011) en vaquillas Nelore al aplicar 2 mg de BE, lo cual fortalece la hipótesis de la existencia de varios factores que pueden alterar el momento del reinicio de la onda folicular.
Las vaquillas de T2 (GnRH) reiniciaron la onda folicular a los 2.4±0.18 días con un pool de 11.3±1.31 folículos. Valores inferiores fueron reportados por Martínez et al. (1999) en vaquillas de carne (2.1±0.6 d) al aplicar GnRH el día 6 del ciclo estral. Por otro lado, se observaron 13.4±1.6 folículos el día 1.8±0.15 en las vaquillas de T3 (ablación), con diferencia estadística en el momento del reinicio de la onda entre T2 y T3 (p<0.05), intervalo que concuerda con lo establecido por Bergfelt et al. (1994) en una sesión de OPU en vaquillas de carne.
El número de folículos promedio reclutados en la nueva onda folicular fue semejantes a los descritos por Chasombat et al. (2013), quienes contabilizaron 10.5±0.1 folículosenganadocriolloTailandes yAyala et al. (2019) de 9.9±1.5 folículos en vaquillas criollas en el altiplano ecuatoriano.
CONCLUSIONES
La aplicación de 2 mg de benzoato de estradiol más progesterona en vaquillas Holstein mestizas, criadas sobre los 2500 msnm y alimentadas al pastoreo presentan un reinicio de onda folicular promedio a los 3.2 días del tratamiento, mientras que la aplicación de GnRH en estas condiciones genera el reinicio a los 2.4 días y la ablación folicular a los 1.8 días.
La presencia de un cuerpo lúteo (CL) funcional y un folículo dominante (FD) >10 mm (metaestro tardío) permitió estimular el reinicio de la onda folicular más homogénea al aplicar BE, GnRH o realizar la ablación folicular.












 uBio
uBio 

