INTRODUCCIÓN
Las enfermedades provocadas por protozoos de la familia Trypanosomatidae como la leishmaniosis y la tripanosomiasis se encuentran clasificadas por la Organización Mundial de la Salud (OMS) como enfermedades desatendidas debido a que afectan a las comunidades humanas más pobres y marginadas (Alvar et al., 2006; Eloy y Lucheis, 2009; Álvarez-Hernández et al., 2018).
La leishmaniosis es una enfermedad distribuida casi globalmente y es causada por tripanosomátidos de la subfamilia Leishmaniinae. Se estima que unas 50 mil personas mueren anualmente por leishmaniosis, siendo la segunda enfermedad parasitaria que más muertes humanas provoca (Oryan y Akbari, 2016). Existen alrededor de 23 especies de Leishmania, la mayoría de tipo zoonótica. Los vectores de estos parásitos son dípteros de la subfamilia Phlebotominae, conocidos como flebotominos. La mayoría de las especies en Europa, Asia y África pertenecen al género Phlebotomus, mientras que en América son del género Lutzomyia (Sosa Ávila et al., 2014).
En el continente americano, los países de la cuenca amazónica presentan las prevalencias más altas de leishmaniosis, siendo Brasil el más afectado (Pace, 2014). En México, los estados con mayor prevalencia son Campeche, Chiapas, Nayarit, Quintana Roo, Tabasco, Veracruz, Yucatán y Oaxaca, cuyos casos corresponden a infecciones por L. mexicana, L. braziliensis y L. amazonensis (Sosa Ávila et al., 2014; MonroyOstria y Sanchez-Tejeda, 2017). Se han reportado casos de leishmaniosis visceral por L. infantum en humanos y perros en Guerrero (Rosete-Ortíz et al., 2011) y Chiapas (Pastor-Santiago et al., 2012) y por L. mexicana en pacientes inmunocomprometidos (Monroy-Ostria y Sanchez-Tejeda, 2017). En Quintana Roo se han determinado seroprevalencias en perros de 16.3, 9.2 y 4.6% para L. mexicana, L. infantum y L. braziliensis, respectivamente utilizando anticuerpos contra superóxido dismutasa de hierro excretada por el parásito (López-Céspedes et al., 2012).
El tripanosomátido de mayor impacto en salud pública en América es T. cruzi, causante de la enfermedad de Chagas o tripanosomiasis americana (Carabarin-Lima et al., 2013). La enfermedad afecta a cerca de ocho millones de personas en el mundo, especialmente en América Latina (ÁlvarezHernández et al., 2018). Los vectores son hemípteros de la familia Reduviidae, conocidos como «vinchucas» o «chinches besuconas», y comprenden más de 130 especies pertenecientes a tres géneros: Triatoma, Rhodnius y Panstrongylus (Iowa State University, 2010; Pérez-Molina y Molina, 2017). Dos tercios del territorio mexicano son endémicos de tripanosomiasis americana. Los estados con la seroprevalencia más alta en humanos son Veracruz, Morelos, Oaxaca, Yucatán, Chiapas, Guerrero y Jalisco (RojoMedina et al., 2018). En Quintana Roo, se estableció una seroprevalencia en perros de 21.3% en la prueba de detección de anticuerpos contra superóxido dismutasa de hierro excretada por T. cruzi (LópezCespedes et al., 2013).
Los principales reservorios de L. mexicana son roedores de los géneros Peromyscus, Ototylomys y Sigmodon (Roque y Jansen, 2014). Los reservorios de L. infantum son cánidos domésticos y silvestres (Ribeiro et al., 2018). Los principales animales que actúan como reservorio de T. cruzi son zarigüeyas, armadillos y algunos roedores (Gürtler y Cardinal, 2015). Se estima que los protozoos de esta familia se pueden alojar en al menos 150 especies de mamíferos silvestres (Eloy y Lucheis, 2009).
Las manifestaciones clínicas en los perros pueden ir desde lesiones cutáneas, como úlceras localizadas en el caso de infección por L. mexicana (Cruz-Chan et al., 2014) hasta enfermedad multisistémica con compromiso renal y cuadro clínico pleomórfico como ocurre en muchas infecciones por L. infantum (Solano-Gallego et al., 2011). Las principales manifestaciones clínicas de enfermedad de Chagas en perros son agrandamiento del corazón, miocarditis aguda, letargia, anorexia, ascitis, dificultad respiratoria y alteración de la conducción cardíaca (Kjos et al., 2008). Muchos signos clínicos de enfermedades provocadas por tripanosomátidos en perros suelen ser inespecíficos, lo que hace casi imposible el diagnóstico sin pruebas complementarias de laboratorio. Además, la presencia de coinfecciones entre géneros y especies de esta familia de parásitos es común en zonas endémicas (Oliveira-Porfirio et al., 2018; Viettri et al., 2018).
El estado de Quintana Roo presenta características climáticas y ecológicas para el desarrollo de los principales vectores de tripanosomátidos (Dumonteil y Gourbière, 2004; May-Uc et al., 2011) y los veterinarios de campo reportan casos de perros con manifestaciones clínicas sugestivas de leishmaniosis y tripanosomiasis canina. Sin embargo, los agentes causales no han sido debidamente diagnosticados. Debido a esto, el objetivo de esta investigación fue determinar la frecuencia serológica y molecular de infección por Leishmania spp y T. cruzi en perros con signos sugestivos a infección por tripanosomátidos, así como identificar factores asociados a los patógenos en perros del municipio de Lázaro Cárdenas, Quintana Roo, México.
MATERIALES Y MÉTODOS
Animales
Se incluyeron 40 perros en el estudio transeccional descriptivo mediante un muestreo no probabilístico en el municipio de Lázaro Cárdenas, Quintana Roo, entre septiembre y octubre de 2018. Se buscaron casos con cuadros clínicos sospechosos de infección por tripanosomátidos. Los perros seleccionados presentaron al menos tres de los siguientes signos clínicos: condición corporal baja, mucosas pálidas, agrandamiento de linfonodos y fiebre (Barr, 2009; Reis et al., 2009), así como dermatitis ulcerativa focal, multifocal o difusa, dermatitis exfoliativa, nodular, pustular o papular, hiperqueratosis del morro, epistaxis, enfermedad corneal, conjuntivitis (Solano-Gallego et al., 2011, 2017) y tos (Kjos et al., 2008).
Se colectó suero, piel y médula ósea de perros que presentaban signos de enfermedad cutánea o sistémica. Además, se tomaron los principales datos del animal en una hoja de expediente clínico orientado a problemas y se realizó un examen físico general en cada uno. Los perros muestreados presentaron un rango de edad de 5 meses a 13 años.
Toma de Muestras
La muestra de sangre se colectó mediante venopunción de la vena cefálica y se colocó en tubos de plástico de 5 ml sin anticoagulante. La biopsia de piel se realizó con un sacabocados de 6 mm de diámetro, empleando un punto de sutura simple al finalizar el procedimiento. La obtención de médula ósea se realizó mediante punción costocondral. Para esto, se palpó la unión costocondral en el tercio ventral de las costillas X y XI, se realizó la antisepsia del área con solución de yodopovidona al 10% y se introdujo una aguja (21 G) perpendicularmente a través de la costilla hasta alcanzar la porción medular. Se aspiró y se extrajo de 0.3 a 0.5 ml de médula ósea (Maidana et al., 2010).
Las muestras de médula ósea y piel se obtuvieron bajo anestesia general superficial. Se empleó una dosis de 0.5 mg/kg de clorhidrato de xilacina vía IM y 2 a 3 mg/kg de la combinación clorhidrato de tiletamina/zolazepam vía IV 15 minutos después de la primera droga. Cada animal fue muestreado bajo la presencia del propietario o responsable del animal, habiendo firmado una hoja de consentimiento informado. El proyecto contó con la aprobación del Comité de Bioética del Campus de Ciencias Biológicas y Agropecuarias de la Universidad Autónoma de Yucatán (Código de Registro CB-CCBA-M2018-005).
Las muestras de sangre fueron centrifugadas a los 30 minutos de la extracción a 1600 x G durante 10 minutos. Los sueros resultantes (1 ml) se colocaron en viales de 1.5 ml y se guardaron en refrigeración (+4 °C) hasta llegar al Laboratorio de Biología Molecular del Campus de Ciencias Biológicas y Agropecuarias de la Universidad Autónoma de Yucatán, donde se almacenaron a -20 °C. Posteriormente se enviaron al laboratorio de Sanidad Animal de la Universidad Complutense de Madrid, España.
La biopsia de piel se cortó en dos fragmentos similares inmediatamente después de su obtención. La muestra de piel destinada para el análisis histopatológico fue depositada en una solución de formalina tamponada al 10 % y conservada a temperatura ambiente (Pimentel et al., 2008). La otra parte, destinada para el análisis molecular, se depositó en una solución de etanol al 100% en una proporción 1:10 y se mantuvo a temperatura ambiente (Alqaydi y Roy, 2016). Esta técnica de conservación se ha empleado para muestras de piel y órganos de murciélagos en la detección de L. mexicana con resultados satisfactorios (Berzunza-Cruz et al., 2015). Para el análisis citológico, una gota de médula ósea fue extendida entre dos portaobjetos y secada al aire. Para el análisis molecular, se depositaron 2 gotas de médula ósea en un tubo para biología molecular (Eppendorf, Alemania) de 1.5 ml con 200 µl de buffer NET-10 (10 mM de NaCl, 10 mM EDTA y 10 mM de Tris HCl con 25 mg/ml de gentamicina). Las muestras en el buffer se conservaron entre -15 y -10 °C hasta su procesamiento.
Análisis de las Muestras
Inmunofluorescencia indirecta
La prueba de inmunofluorescencia indirecta (IFI) es la prueba de referencia para el diagnóstico de la leishmaniosis canina recomendada por la OIE (Moreno et al., 2017). Tiene una sensibilidad entre 87 y 100% y especificidad entre 77 y 100%. Se empleó la metodología descrita por Moreno et al. (2014), que consiste en la fijación de anticuerpos del suero problema en una placa con promastigotes. Una vez aplicada la muestra de suero en la placa, se adicionó un conjugado de anti-inmunoglobulinas caninas marcadas con isotiocianato de fluoresceína. La mezcla final se observó al microscopio con luz ultravioleta luego de una serie de diluciones. Se consideró el punto de corte a partir de la dilución 1/100. Los sueros que presentaron un título menor al punto de corte fueron considerados como sospechosos (Miró, 2007).
Prueba serológica inmunocromática para detección de anticuerpos anti-Trypanosoma cruzi
Se empleó la prueba rápida Chagas Ab Rapid (SD BioLine, Corea) para la detección de inmunoglobulina G (IgG) anti-T. cruzi. La prueba tiene una sensibilidad de 90.799.3% y especificidad de 94-100% (Ji et al., 2009; Sánchez-Camargo et al., 2014).
Análisis histopatológico de piel
Se siguió la metodología descrita por Terán et al. (2013) para el corte, montaje y tinción de muestras fijadas en formalina tamponada. Se empleó la tinción hematoxilinaeosina.
Análisis citológico de médula ósea
Luego de secarse, cada extensión de médula ósea fue fijada y teñida en campo con el kit DiffQuick (Pimentel et al., 2015). Las laminillas fijadas y teñidas se conservaron a temperatura ambiente.
Extracción y purificación de ácidos nucleicos
Las muestras de piel fueron removidas de la solución fijadora hasta secar por completo y se depositaron en un vial de 1.5 ml. Se almacenaron durante 24 h en ultracongelación a -80 °C. Después, cada muestra congelada se maceró con un pistilo en un tubo tipo Eppendorf de 1.5 ml para facilitar su digestión. El procedimiento se realizó con el estuche comercial DNeasy Blood and Tissue (Qiagen, 2006). El material obtenido de la purificación se congeló a -20 °C hasta su amplificación.
Para determinar su pureza, se midió la absorbancia de la elución a 260 nm y a 280 nm en un espectrofotómetro NanoDrop 2000 (Thermo Fisher), usando como blanco la solución AE del kit empleado para la extracción. El cociente de absorbancias A260/A280 nm mayor a 1.7 es indicador de la pureza del ADN del extracto analizado (Risueño et al., 2018).
PCR ITS1 Leishmania spp
Se realizó el procedimiento en los extractos de piel y médula ósea. El espaciador interno ribosomal 1 (ITS1) se encuentra en el operón ribosomal, entre los genes que codifican para la región 18S y 5.8S (Schönian et al., 2003). Esta región conservada posee mayor variabilidad entre especies que otras regiones del operón, razón por la cual se emplea para caracterizar al parásito a nivel de especie. La secuencia del ITS1 está repetida varios cientos de veces en el genoma (Baldwin et al., 1995), por lo que se puede detectar de 0.1 a 0.2 parásitos por reacción (Nasereddin et al., 2008; Ranasinghe et al., 2015). Se usó un extracto de cultivo de promastigotes de la cepa MHET/MX/97/Hd18 de L. mexicana como control positivo. Se emplearon los cebadores LITSR: 5’CTG GAT CAT TTT CCG ATG -3’ (forward) y L5.8S: 5’TGA TAC CAC TTA TCG CAC TT -3’ (reverse) (Lima et al., 2017). Los iniciadores generan un amplicón de 300 a 350 pb para cualquier especie de Leishmania con una variación ligera en el peso molecular entre cada especie (Céspedes-Chaves et al., 2016). Se empleó el estuche GoTaq Green Master Mix, siguiendo el procedimiento recomendado por el fabricante (Promega Corporation, 2016) en un termociclador MyCycler Thermal Cycler System. Se empleó el marcador molecular DNA Leadder Molecular Weight Marker 100 bp.6. Se usaron las condiciones de PCR descritas por Lima et al. (2017), con una temperatura de desnaturalización inicial de 95 °C durante tres min, seguido de 35 ciclos con 40 s de desnaturalización a 95 °C, 53 °C de alineamiento por 45 s y 72 °C durante un min de extensión. Finalmente, una temperatura de extensión de 70 °C durante 6 min. El producto amplificado se sometió a electroforesis en geles de agarosa al 2% con 10 µl de bromuro de etidio (10 mg/ml) por cada 100 ml de gel, aplicando un voltaje de 90 V durante 45 min.
PCR kDNA Trypanosoma cruzi
Se realizó la PCR para detección de T. cruzi en los extractos de médula ósea empleando los oligonucleótidos Tc121: 5’-AAA TAA TGT ACG GGG KGA GAT GCA TGA -3’ (forward) y Tc122: 5’GGT TCG ATT GGG GTT GGT GTA ATA TA -3’ (reverse) (Virreira et al., 2018), que amplifican una región del ADN del kinetoplasto con un peso molecular de 300 pb. Como control positivo se usó un cultivo de tripomastigotes de la cepa H4 de T. cruzi. Se empleó el kit DreamTaq Green (Thermo Scientific), bajo condiciones similares a las reportadas por Saavedra et al. (2013); es decir, desnaturalización inicial de 94 °C por 3 min, 35 ciclos de 94 °C de desnaturalización, 63.6 °C de alineamiento y 72 °C de extensión, cada fase con una duración de 1 min. Para la extensión final se mantuvo la temperatura anterior durante 5 min. La electroforesis se realizó bajo condiciones similares al ensayo anterior, pero por 25 min.
Factores Asociados
Para el análisis de factores asociados los signos clínicos de 40 perros fueron divididos en dos grupos. Perros con signos clínicos compatibles con leishmaniosis fueron considerados aquellos que presentaron uno de los siguientes signos: dermatitis ulcerativa focal, multifocal o difusa, dermatitis exfoliativa, nodular, pustular o papular, hiperqueratosis del morro, epistaxis, enfermedad corneal, conjuntivitis (Solano-Gallego et al., 2011), y perros con tos fueron asignados al grupo sugestivo de tripanosomiasis americana (Bonilla et al., 2018). Los signos clínicos de condición corporal baja, mucosas pálidas, agrandamiento de nódulos linfoides y fiebre fueron signos incluidos en ambos grupos (Barr, 2009; Reis et al., 2009).
Debido al reducido número de casos positivos a anticuerpos anti-L. infantum y PCR a Leishmania spp, solo se realizó el análisis de factores asociados con los resultados de T. cruzi. Para ello se usaron como variables independientes el sexo (macho, hembra), edad (>1 año, <1 año), condición corporal (baja, superior) de acuerdo con Freeman et al. (2011), fiebre (sí, no) de acuerdo con Eldredge et al. (2007), mucosas pálidas (sí, no), nódulos linfoides agrandados (sí, no) y tos (presente, ausente). Se usó como prueba tamiz la prueba exacta de Fisher (Pértega-Díaz y Pita-Fernández, 2004). Las variables con p<0.2 fueron analizadas mediante una prueba de regresión logística con el programa SPSS. La asociación se consideró significativa si presentaba un valor p<0.05.
RESULTADOS
En el Cuadro 1 se presentan los animales positivos a anticuerpos anti-L. infantum, anti-T. cruzi y positivos a la PCR de T. cruzi. El 7.5% de perros fueron positivos a anticuerpos anti-L. infantum (3/40) y 12.5% resultaron sospechosos (5/40). Asimismo, 15% fue positivo a anticuerpos anti-T. cruzi (6/40). Ninguna de las muestras de médula ósea y piel resultaron positivas a la PCR para Leishmania spp. En el Cuadro 1 también se puede observar que 64.7% (11/17) de los perros positivos a la infección por T. cruzi en la PCR no presentaron anticuerpos anti-T. cruzi y que todos los perros positivos a anticuerpos anti-T. cruzi fueron positivos a la infección por T. cruzi en la PCR (6/6). Asimismo, 66.6% (2/3) de los perros positivos a anticuerpos anti-L. infantum también resultaron positivos a anticuerpos anti-T. cruzi y a la PCR de T. cruzi. Se presentó un perro (1/3) que solamente fue positivo a anticuerpos anti-L. infantum.
Cuadro 1 Perros positivos a las pruebas diagnósticas de leishmaniasis y tripanosomiasis en el municipio de Lázaro Cárdenas, Quintana Roo, México (2018)
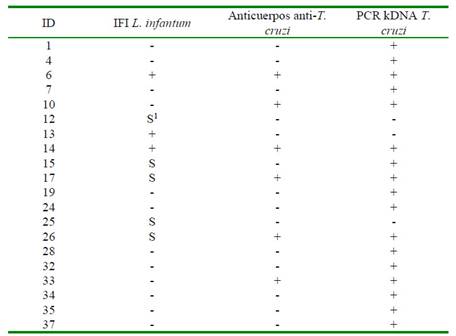
1 Sospechoso
En las pruebas de PCR realizadas en médula ósea, 42.5% (17/40) de los perros resultaron positivos a la infección por T. cruzi (Figura 1).
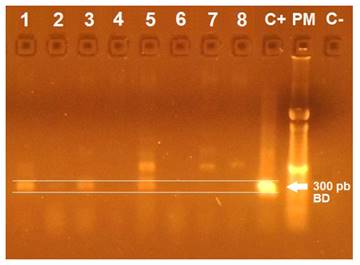
Figura 1 Análisis de PCR para la detección de kDNA T. cruzi a partir de extractos de médula ósea de perros con sospecha de tripanosomiasis. Se aprecian bandas de 300 pb en los carriles 1, 2, 3 y 5. C+: control positivo. PM: peso molecular. C-: control negativo. BD: banda diagnóstica
Los perros del estudio presentaron los siguientes signos clínicos: condición corporal baja (60%), úlcera cutánea (32.5%), mucosas pálidas (20%), fiebre (15%), agrandamiento de nódulos linfoides (15%), tos (10%), soplo cardíaco (2.5%) y epistaxis (2.5%).
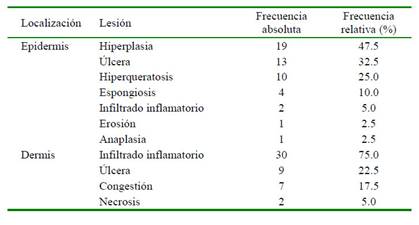
En los estudios histopatológicos no se hallaron fases de desarrollo de tripanosomátidos (amastigotes) dentro o fuera de células fagocíticas. Las lesiones histopatológicas observadas se presentan en el Cuadro 2, siendo la presencia de infiltrado inflamatorio dérmico e hiperplasia epidérmica las más frecuentes. Los tipos de infiltrados inflamatorios dérmicos fueron histiocítico (52.5%), supurativo (25.0%), linfocítico (17.5%) y piogranulomatoso (5.0 %). Las probables causas primarias de dermopatía fueron de origen bacteriano (22.5%), neoplásico (17.5%), micótico (12.5%), alérgico (5%) y parasitario por Demodex spp (2.5%).
Cuadro 2 Frecuencia de lesiones halladas en el análisis histopatológico de perros (n=40) con signos clínicos sugestivos a tripanosomátidos
En ninguna de las 40 muestras de médula ósea se observaron fases de desarrollo de tripanosomátidos dentro o fuera de histiocitos. Incidentalmente, se hallaron microfilarias en seis casos (15%).
En el análisis de asociación con los casos positivos a anticuerpos anti-T. cruzi se encontró que la condición corporal y mucosas pálidas presentaron un valor p<0.2 en la prueba exacta de Fisher y fueron incluidas en el análisis de regresión logística. Asimismo, las variables sexo, condición corporal, fiebre, mucosas pálidas y nódulos linfoides agrandados tuvieron valores de p<0.2 con la PCR para T. cruzi y fueron incluidas en otro análisis de regresión logística. Únicamente la variable condición corporal baja en los perros positivos a anticuerpos anti-T. cruzi presentó un valor de p=0.035 en la prueba exacta de Fisher. En el análisis de regresión logística de los casos positivos a anticuerpos anti-T. cruzi y PCR kDNA de T. cruzi no se encontró significancia en las variables estudiadas.
DISCUSIÓN
Las frecuencias de perros positivos en los análisis serológicos para la detección de anticuerpos anti-L. infantum y anti-T. cruzi en el presente estudio fueron relativamente similares a las seroprevalencias reportadas por otros autores en la región. Así, LópezCéspedes et al. (2012) obtuvieron una seroprevalencia en perros para L. infantum en Quintana Roo ligeramente mayor (9.2%) y López-Cespedes et al. (2013) encontraron una seroprevalencia de perros positivos a anticuerpos anti-T. cruzi de 21.3%, siendo en el presente estudio de 15%.
Por otro lado, la frecuencia de perros positivos en la PCR para T. cruzi resultó mayor (42.5%) en comparación con la frecuencia de positivos en la prueba de detección de anticuerpos anti-T. cruzi (15 %), posiblemente debido a que los perros fueron muestreados cuando se encontraban en la etapa aguda de la infección. La seroconversión ocurre alrededor de las tres semanas de la infección, acompañada de un descenso en la parasitemia. Los anticuerpos persisten en el animal por el resto de su vida, independientemente de si desarrolla signos de enfermedad crónica (Barr, 2009).
La presencia de anticuerpos anti-L infantum en perros positivos y sospechosos a la prueba de IFI, a pesar de la ausencia de casos positivos en la PCR para Leishmania spp, podría deberse a la infección por el agente en animales resistentes a la enfermedad, especialmente en aquellos que resultaron negativos a la prueba serológica y molecular de T. cruzi. Solano-Gallego et al. (2009) afirman que alrededor de la mitad de los perros infectados con L. infantum son resistentes al patógeno. En ellos, la infección desencadena predominantemente una respuesta inmunitaria tipo Th1 con un nivel de anticuerpos anti-L. infantum bajo a medio, pudiéndose detectar o no al patógeno mediante PCR debido a la baja carga parasitaria. Si el resultado de la prueba de IFI es dudoso, Miró (2007) recomienda repetir el análisis a los 30-45 días o emplear otra prueba diagnóstica.
Respecto a las muestras biológicas empleadas en este estudio, se demuestra que la médula ósea en perros es un tejido útil para el diagnóstico molecular de T. cruzi. Se han reportado casos caninos donde se hallan amastigotes de T. cruzi en médula ósea en exámenes citológicos (Almeida et al., 2013); sin embargo, no se llegaron a observar en la presente investigación. De la misma manera, se pueden observar amastigotes en piel de humanos infectados (Hemmige et al., 2012), pero no se han reportado en perros y tampoco se observaron en los análisis histopatológicos de lesiones cutáneas en este estudio.
T. cruzi no fue buscado en los tejidos donde regularmente se encuentran los pseudoquistes de amastigotes (miocardio, intestino delgado o bazo) (Kjos et al., 2008), debido a que la investigación se centró en animales vivos, todos ellos domiciliados. En cambio, la obtención de médula ósea en perros en la unión costocondral es una técnica rápida y segura, considerada la técnica de elección para la obtención de este tejido para el diagnóstico de la leishmaniosis canina (Maidana et al., 2010).
El único factor que presentó asociación significativa en el análisis estadístico fue la condición corporal. Esta variable es un signo relacionado con la infección por T. cruzi en perros reportado por varios autores (Ortiz et al., 2016; Curtis-Robles et al., 2018), aunque se encuentra también en numerosas patologías. Sin embargo, Carrillo-Peraza et al. (2014) no encontraron esta asociación en perros en Molas, Yucatán, pero hallaron una asociación significativa con la edad, concluyendo que los perros adultos tenían mayor probabilidad de resultar positivos a anticuerpos anti-T cruzi.
La presente investigación revela que la probabilidad de hallar casos positivos a la infección por T. cruzi es mayor que la probabilidad de hallar casos positivos a la infección por L. infantum en pruebas serológicas y moleculares en perros con signos sugestivos de infección por tripanosomátidos en el municipio de Lázaro Cárdenas, Quintana Roo.
CONCLUSIÓN
Los perros con signos clínicos sugestivos a infección por tripanosomátidos en Lázaro Cárdenas, Quintana Roo, México, presentan baja frecuencia de anticuerpos IgG anti-L. infantum sin que se detecte molecularmente la presencia del agente. Asimismo, estos perros presentan alta frecuencia molecular de infección por T. cruzi y baja frecuencia de anticuerpos de la clase IgG. La condición corporal baja en perros se asoció a la presencia de anticuerpos IgG anti-T. cruzi.












 uBio
uBio 

