INTRODUCCIÓN
El tráfico ilegal de fauna silvestre es una de las actividades más lucrativas, donde los animales comercializados terminan como alimento, mascotas o elementos de vestuario (Garza-Almanza, 2015). En Colombia, los primates no humanos (PNH) son considerados como uno de los grupos de animales de la fauna silvestre más afectados por esta actividad (Defler, 2010).
Los PNH son susceptibles a infecciones parasitarias y micóticas que resultan del contacto directo con animales infectados o con fómites contaminados. Además, en el caso de los PNH recuperados de áreas endémicas, al ser reunidos con otros primates procedentes de diferentes orígenes geográficos puede ocasionar una rápida propagación de patógenos e introducir enfermedades que pueden representar una amenaza para la salud de las colonias (Bernstein y Didier, 2009; Sasseville y Mansfield, 2010).
A pesar de que la lista de infecciones fúngicas y parasitarias que afectan a los PNH es limitada en comparación con las entidades bacterianas y virales, estas infecciones son responsables de enfermedades que podrían ejercen un efecto epizoótico (Adrus et al., 2019), además de conllevar un impacto relevante en la salud de estos animales (Robertson et al., 2000; Seyedmousavi et al., 2018).
Varios autores han descrito la importancia de las infecciones fúngicas y parasitarias en los PNH, tratando de elucidar las posibles implicaciones en la salud humana (Eckert et al., 2006; Cristóbal-Azkarate et al., 2010; Helenbrook et al., 2015). De otra parte, es importante proporcionar datos locales sobre la epidemiología de los parásitos y los hongos en los primates autóctonos. Es así que el objetivo de este trabajo fue determinar la presencia de hongos patógenos y oportunistas y parásitos intestinales con potencial zoonótico en un grupo de tres especies de primates no humanos (Aoutus sp, Alouatta seniculus y Cebus albifrons) cautivos en el Centro de Atención y Valoración de Fauna y Flora Silvestre - CAVFFS en Valledupar (Colombia).
MATERIALES Y MÉTODOS
Ubicación del Estudio
Este estudio se realizó en el Centro de Atención y Valoración de Fauna y Flora Silvestre (CAVFFS) de la ciudad de Valledupar (Colombia). La zona se encuentra a 169 msnm y con una temperatura promedio de 28.4 ºC. El clima de la ciudad es cálido y muy seco, con dos estaciones lluviosas (marzo - junio y septiembre - noviembre) y dos estaciones secas (diciembre - febrero y julio - agosto). La precipitación pluvial anual en promedio es de 970 mm (IDEAM, 2018).
El estudio fue aprobado por el Comité de Ética del CAVFFS. Personal de este centro realizaron la toma de las muestras clínicas.
Población de Estudio
La población de primates del presente estudio corresponde a un grupo de animales provenientes de tráfico animal y actividades ilegales asociadas. El estudio incluyó 17 primates en cautiverio que ingresaron al CAVFFS durante entre enero y mayo de 2018: Alouatta seniculus (10), Aotus sp (2) y Cebus albifrons (5). Cada animal ingresado fue evaluado por el personal médico veterinario y especialistas del CAVFFS para identificar su estado de salud. Durante este proceso, se realizó la toma de muestra para obtención de datos clínicos y los correspondientes al estudio. El intervalo de tiempo entre el ingreso y toma de muestra en cada animal, no fue superior a un día.
Toma de Muestra
Se colectaron tres muestras de materia fecal fresca (5 g) por animal, sin contacto con el suelo. Además, con la ayuda de una lanceta estéril, se hicieron raspados a partir de los bordes de lesiones alopécicas, placas eritematosas descamativas o zonas de piel que arrojaran resultado positivo para la fluorescencia con la lámpara de Wood. En cada primate se tomaron tres muestras de piel y pelo de distintas zonas del cuerpo con el fin de determinar la presencia de hongos dermatofitos.
Las muestras (materia fecal, piel y pelo) se etiquetaron con datos generales que incluyeron un código alfanumérico, fecha y hora de la toma de la muestra y se transportaron a temperatura ambiente en un recipiente hermético hasta los laboratorios de Microbiología de la Universidad Popular del Cesar (Valledupar, Colombia). El tiempo transcurrido entre la toma de la muestra y su procesamiento fue en todos los casos, inferior a una hora.
Muestras de Heces
Las muestras se analizaron por tres técnicas: a) montaje con solución salina al 0.85% y solución de lugol al 1%; b) coprocultivo según la técnica descrita por Montoya et al. (2005) para búsqueda de larvas L3 de nemátodos; y c) técnica de Baermann descrita por Vélez (1983). La identificación de las formas parasitarias se realizó empleando claves taxonómicas (Skryabin et al., 1991a, b; Ash & Orihel, 2010; WHO, 2019).
Muestras de Piel y Pelo
Las escamas de piel y los fragmentos de pelo se analizaron por triplicado con montajes entre lámina y laminilla e hidróxido de potasio (KOH) al 20% en microscopía óptica (100x y 400x). En aquellos casos donde se observaron estructuras fúngicas (conidias, artroconididas, blastoconididas, hifas o pseudohifas), se realizaron cultivos en placas con Sabouraud dextrosa con adición de cloranfenicol e incubación hasta por dos semanas a 28 ºC. Ante la presencia de colonias en los medios de cultivo, se realizó montaje con azul de lactofenol y microscopía óptica (100x y 400x) para la identificación fenotípica de género (Howell et al., 2015; Chen et al., 2015; Zhang et al., 2015).
RESULTADOS
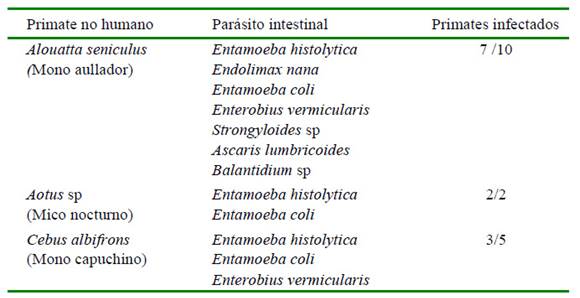
Doce primates (70.5%) presentaron parásitos intestinales: Aoutus sp (2/2), C. albifrons (3/6) y A. seniculus (7/10). Asimismo, seis primates (35.3%) presentaron hongos en piel o pelo. Se encontraron trofozoítos y quistes de Entamoeba histolytica y Entamoeba coli en los tres grupos de primates. Según el orden de frecuencia, E. histolytica fue encontrado en el 41% de las muestras, Entamoeba coli en 29%, Endolimax nana en 24%, Enterobius vermicularis y Strongiloydes sp en 18% cada uno y Balantidium coli y Ascaris lumbricoides en 12% cada uno.
Cuadro 1 Parásitos intestinales encontrados en primates no humanos cautivos en el Centro de Atención y Valoración de Fauna y Flora Silvestre (Valledupar, Colombia)
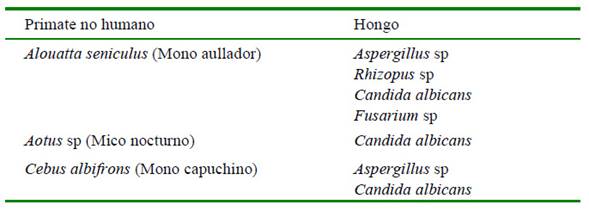
C. albicans fue hallada en los tres grupos de PNH. Otros géneros, incluyendo Aspergillus sp, Rhizopus sp, y Fusarium sp también fueron encontrados en las muestras de piel y pelo (Cuadro 2).
DISCUSIÓN
Los hallazgos de este estudio son similares a los obtenidos por Rondón et al. (2017), quienes encontraron Balantidium sp, Entamoeba sp, oxiuros, Strongyloides sp y Ascaris sp en Alouatta seniculus y Cebus albifrons, y a los de Montoya et al. (2013) en el Centro de Atención, Valoración y Rehabilitación de Fauna Silvestre (CAVR-Ecosantafé), quienes reportaron multiparasitismo intestinal en los PNH.
El 70.5% (12/16) de los PNH presentó parásitos intestinales, resultado similar a los obtenidos por Roncancio-Duque y Benavides (2013), quienes encontraron una frecuencia de parásitos del 70% en poblaciones pequeñas y aisladas de mono aullador rojo (Alouatta seniculus) y mono araña café (Ateles hybridus) en los departamentos de Caldas y Antioquia (Colombia). No obstante, contrasta con el 27% reportado por Castañeda et al. (2010) en Ateles geoffroyi, Ateles hybridus, Saimiri sciureus, Saguinus leucopus, Saguinus nigricollis y Aotus sp cautivos en Ibagué (Colombia) y con el 98.3% mencionado por Guerrero et al. (2012) en un parque zoológico de Pucallpa, Perú, que incluyó ocho especies de PNH y en donde todas las especies presentaron, al menos, una especie de parásito intestinal. Es importante señalar que, en este caso, el hecho de encontrar los parásitos en PNH recién introducidos al CAVFFS evidencia que las infecciones ocurrieron en el hábitat donde fueron capturados.
E. histolytica fue el parásito más prevalente en los tres grupos de primates. Este agente es un patógeno con actividad citotóxica y citolítica, causante de amebiasis intestinal y extraintestinal y es reconocido como la principal forma patógena en PNH (Trejos-Suárez y Castaño, 2009).
A pesar de que la presencia de Balantidium sp es un hallazgo inusual, debido a que su hospedero natural es el cerdo y su reporte en humanos es infrecuente (Kaur y Gupta, 2016), la infección de primates por Balantidium ha ido reportada (Adrus et al., 2019). La infección de PNH con este parásito podría deberse a un contacto previo de los primates con heces humanas o porcinas contaminadas, situación relacionada con el deterioro y la invasión de los espacios naturales para la supervivencia de la fauna silvestre.
Entamoeba coli, al igual que Balantidium sp, procede de los seres humanos y su presencia en los PNH sugiere una antropozoonosis. Esto podría estar relacionado con el contacto cercano a los humanos antes de su recaptura en mercados ilegales. La prevalencia de Strongyloides sp, Ascaris lumbricoides y Enterobius vermicularis fue menor, posiblemente debido a la complejidad de sus ciclos biológicos y función celular. No obstante, Adrus et al. (2019) reportaron una mayor prevalencia de Ascaris sp y Strongyloides sp en PNH en Malasia.
En relación con los factores sociales relacionados con la presencia de estos agentes infecciosos, el allogrooming o acicala-miento social, es reconocido como una actividad que puede facilitar la transmisión de microorganismos a través del contacto con las heces o el pelaje contaminado de otros primates (Sánchez-Villagra et al., 1998); asimismo, el comportamiento de los monos aulladores tiende a formar grupos numerosos (Gómez-Posada et al., 2009),
Las infecciones micóticas en PNH son relativamente raras en comparación con otros agentes infecciosos y ocurren generalmente por contacto accidental con hongos del suelo o la vegetación, o más excepcionalmente, por la implantación del hongo en áreas desnudas de las membranas mucosas o en piel, siendo la candidiasis la enfermedad micótica más frecuente en los PNH (Gozalo y Strait, 2013). En este estudio Candida estuvo presente en las tres especies de PNH, no habiéndose encontrado agentes de dermatofitosis tales como Trichophyton sp y Microsporum sp. Estos resultados coinciden con los publicados por Simmons y Gibson (2012), quienes concluyeron que las dermatofitosis son poco comunes en los PNH y que la colonización intestinal y de las mucosas genitales por Candida es frecuente.
Fedullo et al. (2013) reportaron la presencia de Rhizopus sp y Aspergillus sp en el pelaje de Cebus mantenidos en cautiverio; mientras que, de Freitas et al. (2015) describieron la presencia de Aspergillus sp y Fusarium sp en el pelaje de primates del género Callithrix cautivos en Brasil. No obstante, la presencia de Rhizopus sp y Aspergillus sp podría estar relacionada con el contacto con fómites o jaulas de almacenamiento, de allí que estos aislamientos deben ser interpretados con cautela.
Alouatta seniculus fue el único grupo de PNH en donde se encontró Rhizopus sp. Existen pocos estudios que describan casos de zigomicosis en PNH (Fiennes, 1967; Baskin et al., 1984; Torres-Urbano et al., 2010) y en los tres casos, la zigomicosis se presentó a partir de lesiones graves o inmunosupresión del animal y el diagnóstico solo se confirmó post mortem. Por la ubicuidad de este agente y la ausencia de lesiones clínicas características, la presencia de este hongo en pelo y piel de los PNH de este estudio podría considerarse una colonización.
CONCLUSIONES
Los hallazgos revelan diversidad de parásitos intestinales y hongos oportunistas en primates no humanos (PNH) cautivos de Aoutus sp, Alouatta seniculus y Cebus albifrons.
Los datos obtenidos en esta investigación son los primeros disponibles para estas especies en la región Caribe colombiana.












 uBio
uBio