INTRODUCCIÓN
La leptospirosis es una enfermedad zoonótica bacteriana de distribución mundial (Olivieira et al., 2017; Tan et al., 2016), animales silvestres y animales domésticos (Silva et al., 2010; Vieira et al., 2016). Leptospira interrogans es la causante de la leptospirosis humana y animal (Fernandes et al., 2016). Esta enfermedad está asociada a la ocurrencia de fiebre, ictericia, vómitos, diarrea, hemorragias, uremia causada por falla renal y, eventualmente, la muerte, aunque en la mayoría de los casos tienen presentación asintomática, tanto en humanos como en animales (Van de Maele et al., 2008; Aygün et al., 2016). Los roedores y caninos son los portadores más importantes de esta enfermedad (Rojas et al., 2010; Guernier et al., 2016), teniendo a los perros como los portadores más cercanos al hombre.
La transmisión de la enfermedad está influenciada por la presencia de portadores asintomáticos (roedores, cánidos, ganado) en regiones de climas húmedos tropicales y subtropicales. La infección ocurre por contacto directo de las mucosas o lesiones de piel con orina, sangre, agua o tierras contaminadas con Leptospira spp (Villumsen et al., 2012; Vieira et al., 2016; Kurilung et al., 2017). En el caso de los cánidos, la infección desarrolla una leptospiremia con posterior invasión del tejido renal, excretando leptospiras por la orina por varios meses, contaminando el ambiente donde viven (Harkin et al., 2003; Monahan et al., 2008). Así mismo, los ambientes con altas temperaturas y humedad permiten la sobrevivencia de las leptospiras en la tierra y en cuerpos de agua durante meses (Trueba et al., 2004; Saito et al., 2013; Kurilung et al., 2017), facilitando una mayor diseminación de la enfermedad (Bronson et al., 2009).
En el Perú, los departamentos con mayores reportes de casos de leptospirosis confirmados en humanos son Loreto (21.6%), Cusco (14.8%), Madre de Dios (11.6%) y Lima (11.1%) (Céspedes et al., 2006). Así mismo, se reporta el 27.8% de seroprevalencia de Leptospira en perros asintomáticos de la ciudad de Lima (Céspedes et al., 2007) y 58% en perros clínicamente sospechosos (Siuce et al., 2015), encontrándose que las variables demográficas (edad, sexo, lugar de procedencia) influyen en la presentación de leptospirosis canina (Huerta et al., 2013; Siuce et al., 2015). No obstante, son escasos los estudios en la ciudad de Lima donde se evalúa la influencia de las condiciones climáticas en la frecuencia de la leptospirosis canina, a pesar de conocer su importancia en el proceso de transmisión (Lau et al., 2010). Por ello, el objetivo del estudio fue evaluar la asociación de las estaciones del año con la presentación de casos positivos a Leptospira spp en canes con signos clínicos compatibles con leptospirosis en Lima.
MATERIALES Y MÉTODOS
Lugar de Estudio
Este estudio tuvo un diseño retrospectivo. Los datos fueron recabados del Laboratorio de Parasitología Animal de la Facultad de Veterinaria y Zootecnia de la Universidad Peruana Cayetano Heredia (UPCH), que recibe muestras de la Clínica Veterinaria Docente de la universidad, así como del laboratorio de análisis clínico «Vet Support» que recibe de canes remitidos de centros médicos veterinarios. Ambas instituciones se encuentran ubicadas en la zona de Lima Norte. Las muestras de sangre fueron analizadas mediante la prueba de microaglutinación (MAT), siguiendo el protocolo descrito por el Instituto Nacional de Salud del Perú (Céspedes y Glenny, 2002) y con las recomendaciones de la Organización Mundial de Sanidad Animal (OIE, 2018). Los datos fueron tomados de los registros de canes sometidos a la prueba MAT, lo cual incluyó información básica como edad, sexo y lugar de procedencia.
Variables
Los perros con títulos mayores o iguales a 1:100 como resultado de la prueba de MAT fueron considerados como positivos a una infección por Leptospira spp (Céspedes y Glenny, 2002). Los canes vacunados o sin conocimiento sobre su estado de vacunación se consideraron positivos si tuvieron títulos mayores o iguales a 1:400. Se utilizó este punto de corte teniendo en cuenta que los títulos vacunales no llegan a ser mayores a 1:400 y los títulos por infección por Leptospira spp alcanzan niveles que pueden superar los 1:1600 (Andre-Fontaine et al., 2013).
La variable de exposición fue la estación del año categorizada en primavera-verano (entre el 22 de setiembre y el 19 de marzo) y otoño-invierno (entre el 20 de marzo y el 21 de setiembre). Se recolectaron, además, los registros de temperatura y humedad relativa atmosférica desde 2014 hasta marzo de 2017.
Se analizó la influencia de del sexo, edad, lugar de procedencia, año de infección, temperatura atmosférica (°C) y humedad relativa atmosférica (%) en la presentación de leptospirosis canina.
Análisis de Datos
Las características de la población se describieron como medianas con valores mínimos y máximos para variables cuantitativas y como frecuencias absolutas y relativas para las variables categóricas. Se describió la asociación de la leptospirosis canina con los factores de riesgo a través de un análisis bivariado con la prueba de Chi cuadrado para variables categóricas y la prueba U de MannWhitney para variables cuantitativas no paramétricas. Finalmente se usó un modelo lineal generalizado de la familia Poisson con función de enlace log y errores estándares robustos para evaluar la razón de prevalencia de leptospirosis canina entre las estaciones del año ajustado por las covariables edad, sexo, lugar de procedencia y año de infección. Se evaluó el mejor modelo lineal usando el criterio de información bayesiana (BIC) y la colinealidad entre variables independientes fue evaluado con el factor de inflación de la varianza (VIF). Todos los análisis estadísticos fueron ejecutados con el software Stata 14.
RESULTADOS
La ciudad de Lima mostró una mediana de temperatura atmosférica de 19.3 °C y una humedad relativa de 83.3% entre 2014 y 2017 (Cuadro 1). Se evaluaron los registros de 271 canes cuyas muestras fueron tomadas en esos años. La prevalencia de leptospirosis canina en perros clínicamente sospechosos fue de 34% (IC95%: 28.7 ± 40.3). La mayor parte de los casos se presentaron en perros machos (61%) entre 1 y 6 años de vida (47.9%), provenientes de Lima norte (83.9%).
Cuadro 1 Características de la muestra de canes sospechosos de Leptospira sp y variables climáticas en la ciudad de Lima Norte y Centro entre 2014 y 2017
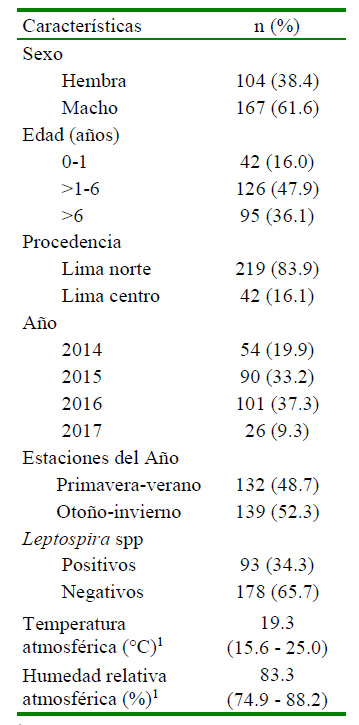
1 Mediana (valor mínimo y máximo)
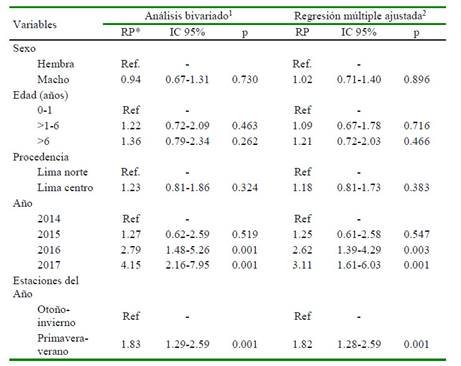
La mayor frecuencia de casos se encontró en las estaciones de primavera-verano (44.7%) con relación otoño-invierno (24.5%) (p=0.001). Los canes diagnosticados como positivos estuvieron expuestos a una mediana de temperatura ambiental de 20.6 °C y una mediana de humedad relativa de 83.1%. Ambos parámetros climáticos mostraron diferencias significativas (p=0.001) en las estaciones de primavera-verano y otoño-invierno. Así mismo, 2016 y 2017 presentaron la mayor frecuencia de casos (p<0.05), mientras que la edad, el sexo y el lugar de procedencia no mostraron asociación estadística (Cuadro 2).
Cuadro 2 Factores asociados a la presencia de Leptospira spp en canes clínicamente sospechosos de leptospirosis en Lima Norte y Centro entre 2014 y 2017
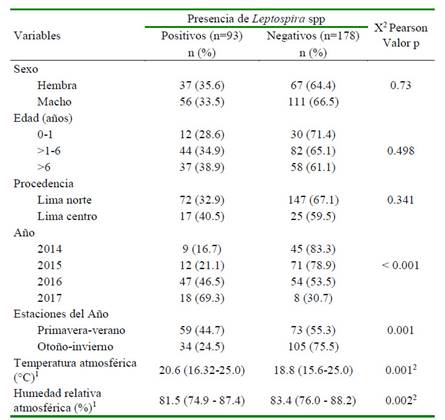
1 Mediana (valor mínimo y máximo)
2 Valor p obtenido por la prueba U de Mann-Whitney
Los resultados obtenidos en el análisis multivariado muestran que las estaciones de primavera-verano tienen mayor probabilidad de presentar casos de leptospirosis canina (RP: 1.82; IC 1.28-2.59). La fuerza de asociación se mantiene al ajustar por edad, sexo y lugar de procedencia. Las variables temperatura atmosférica y humedad relativa no se analizaron por problemas de colinealidad con las estaciones del año. La edad, el sexo, lugar de procedencia y año de infección se incluyeron en el modelo y al igual que en el análisis bivariado no mostraron asociación estadísticamente significativa, a diferencia de la variable año de infección (p<0.05) (Cuadro 3).
DISCUSIÓN
Se encontró una mayor frecuencia de leptospirosis en las estaciones de primaveraverano con respecto a las de otoño-invierno, sugiriendo que altos niveles de humedad y calor en la atmosfera influyen en la presencia de la enfermedad. Además, en la mayor época de calor ocurre la mayor reproducción de los portadores (Bronson et al., 2009; Saito et al., 2013; Kurilung et al., 2017). Así mismo, Huerta et al. (2013) encontró una mayor, aunque no significativa, frecuencia de leptospirosis canina en el verano de Lima de los años 2002-2007, posiblemente debido a la pequeña variabilidad climática existente.
Muchos de los factores de riesgo evaluados en este trabajo no mostraron diferencia estadística. La variable edad no mostró una diferencia estadística en comparación de otros estudios donde se observa que canes mayores a 1 año presentan una mayor frecuencia de leptospirosis (Rubel et al., 1997; Batista et al., 2005; Huerta et al., 2013; Siuce et al., 2015). El sexo tampoco mostró una diferencia estadística, tal y como lo reportan Batista et al. (2005) y Silva et al. (2007), aunque se dispone de estudios que demuestran al macho como factor de riesgo (Huerta et al., 2013; Siuce et al., 2015).
La procedencia de los canes no muestra una influencia en la presencia de leptospirosis. La falta de asociación estaría explicada por las amplias similitudes socioculturales y climáticas entre los distritos de Lima norte y centro. Por otro lado, el efecto de año (2016 y 2017) observado en el presente estudio se puede asociar a los cambios climáticos debido al efecto invernadero que genera un incremento de la temperatura año tras año (Frumkin et al., 2008; Lau et al., 2010), siendo de 0.5 °C por año en los registros del presente estudio. Adicionalmente, en el verano de 2017 se registró el fenómeno de «El Niño» que afectó a la ciudad de Lima, existiendo evidencias de asociación de la leptospirosis con este fenómeno climático (Storck et al., 2008).
No obstante, este trabajo tiene limitaciones que pueden ser tomadas en cuenta al evaluar los hallazgos, pues la población de estudio incluyó solo a perros clínicamente sospechosos de leptospirosis que fueron llevados por sus dueños a una clínica veterinaria. Sin embargo, la condición climática de cada estación del año afecta a toda la población canina de manera indistinta.
El punto de corte en la prueba de MAT para la definición de enfermo fue otra limitación que puede afectar los resultados. La falta de antecedentes de vacunación en los perros de este estudio no permitió saber con certeza si los títulos de anticuerpos menores a 1:400 se deben a anticuerpos vacunales o por infección de Leptospira spp en fase clínica inicial (Andre-Fontaine et al., 2013; Picardeau, 2013), lo cual podría estar subestimando la prevalencia.












 uBio
uBio