INTRODUCCIÓN
La leptospirosis es una enfermedad causada por especies patógenas del género Leptospira que afecta numerosas especies animales causando fiebre, hemólisis, nefritis, trastornos respiratorios y reproductivos que pueden ocasionar la muerte (Dorjee, 2007), sobre todo en regiones tropicales y subtropicales (Ellis, 2015, Haji Hajkolaei et al., 2016). Los animales infectados excretan las bacterias en la orina, contaminando las instalaciones, alimentos, agua, los que se constituyen en fuentes de infección (Azizi et al., 2014). Estos patógenos se localizan en los riñones causando daño renal (Taghadosi et al., 2016) en los animales, y en los humanos se le asocia a la enfermedad renal crónica (Yang et al., 2015).
Los mataderos pueden ser fuentes primarias de datos para la vigilancia de enfermedades (Azizi et al., 2014; FAO, 2014; Thrusfield et al., 2018). Elmonir y Ramadan (2016) consideran los resultados de la inspección veterinaria de animales en el matadero como una herramienta de gran impacto en la detección de infecciones zoonóticas. Asimismo, en países en desarrollo se le utiliza para minimizar el riesgo de las zoonosis desatendidas, como es el caso de la leptospiroris del bovino (EFSA, 2011).
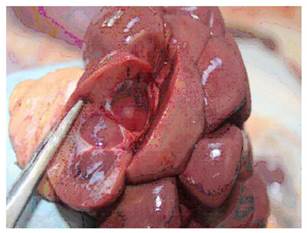
Uno de los hallazgos de importancia que se reporta en la inspección post mortem del ganado bovino es la presencia de riñones con nefritis intersticial focal (NI), caracterizada macroscópicamente por focos dispersos de color blanco grisáceo, conocidos por «Riñones con Manchas Blancas» (RMB) (Yener y Keles, 2001; Azizi et al., 2014), que, si bien no es específica de leptospirosis, se le asocia a infecciones por bacterias del género Leptospira (Amatredjo et al., 1976). Estudios posteriores determinaron que la presencia de RMB al sacrificio puede ser un indicador de exposición a Leptospira spp (Dorjee et al., 2009) y confirman la asociación entre la detección de Leptospira spp y la presencia de RMB en los bovinos sacrificados (Azizi et al., 2012). Ante esto, el objetivo del presente estudio fue determinar la posible relación entre la presencia de RMB y la seroprevalencia de Leptospira spp en bovinos sacrificados en la provincia Manabí, Ecuador.
MATERIALES Y MÉTODOS
Diseño del Estudio
Se realizó un estudio transversal en el periodo comprendido entre septiembre de 2017 y febrero de 2018, mediante el cual se trabajaron 320 bovinos sacrificados en el matadero del cantón Manta, Ecuador. Se tomaron muestras de sangre a los animales para detectar la presencia de anticuerpos contra agentes del género Leptospira; asimismo, se practicó una evaluación anatomopatológica macro y microscópica para detectar la presencia de lesiones renales relacionadas con la presencia de leptospirosis (Luna, 1968).
Tamaño de Muestra
El número de muestras a tomar para este tipo de estudio se determinó por la fórmula propuesta por Lwanga y Lemeshow (1991): n = Z2*p*(l -p)/d 2 , donde Z=1.96 (nivel de confianza 95 %), p=0.15 (proporción de la población prevista como afectada), 1-p= 0.85, d= 0.04 (precisión absoluta a ambos lados de la proporción), resultando en una mínima de 306 muestras.
Muestras de Sangre
Se colectaron muestras de sangre de los bovinos (5 ml), sin anticoagulante, de la vena yugular o de la arteria caudal. Se utilizaron tubos con vacío y agujas descartables. En todos los casos, los dueños de los animales firmaron el acta de consentimiento informado.
Las muestras se mantuvieron a una temperatura aproximada de 20 ºC y tras la formación del coágulo se procedió a la extracción del suero por centrifugación a 1500 g durante 10 min. El suero se distribuyó en alícuotas de 0.5 ml y se congeló a -20 ºC hasta el momento de ser procesado (Mejía Martínez y Lemus Flores, 2012).
Diagnóstico Serológico
Las muestras se analizaron en los Laboratorios de la Dirección de Diagnóstico Animal de la Agencia Ecuatoriana para la Calidad del Agro (AGROCALIDAD) de Tumbaco, utilizando la técnica de la aglutinación microscópica (MAT). Se consideraron positivos los títulos >1:100. Todos los sueros se analizaron para comprobar la presencia de títulos de anticuerpos para los ocho serovares de Leptospira interrogans de mayor circulación en el país: Canicola, Hardjo, Pomona, Icterohaemorrhagiae, Grippotyphosa, Wolffi, Bratislava y Copenhageni, conforme a lo recomendado por la Organización Mundial de Sanidad Animal (OIE, 2014).
Diagnóstico Patológico
Para el análisis de las alteraciones macroscópicas renales se tomaron en cuenta los criterios de Zachary (2016) y Tucunduva de Faria et al. (2007), quienes han establecido una asociación directa entre la presencia de varios serovares de Leptospira y la aparición de nefritis intersticial focal o difusa, con o sin afectación tubular (NI) en diferentes especies animales, y cuya manifestación macroscópica es el conocido Riñón con Manchas Blancas (RMB). En el presente estudio se consideró esta lesión como específica de la enfermedad para establecer una diferenciación con el resto de las alteraciones que comúnmente son encontradas en la inspección de riñones en el matadero (quistes renales, reacciones o cambios circulatorios como hiperemia, congestión o focos hemorrágicos y procesos degenerativos o infiltrativos como lipidosis).
Para comprobar la presencia de NI desde el punto de vista histológico, se tomaron muestras de todos los riñones con presencia de RMB. Las muestras fueron fijadas en una solución de formol neutro tamponado a 10%, y procesadas por la técnica clásica de inclusión y corte en bloques de parafina. Los cortes de tejido se colorearon con la técnica convencional de Hematoxilina y Eosina (Luna, 1968).
Análisis Estadístico
Se determinó la seroprevalencia de bacterias del género Leptospira. Se identificaron los principales serovares presentes y los títulos de anticuerpos por cada uno de ellos.
Asimismo, se determinó la seroprevalencia y la presencia de lesiones en los animales por cantón de procedencia.
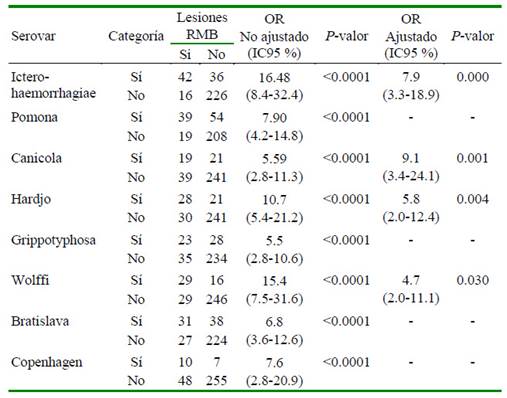
Se realizó un análisis de riesgo para determinar la asociación entre presencia de títulos de anticuerpos contra Leptospira spp y la presencia de lesiones renales específicas según sexo de los animales y el cantón de procedencia. En todos los casos se utilizó el paquete estadístico en línea VassarStats.net.
La asociación entre la presencia de lesiones en los riñones y los serovares de Leptospira spp se evaluó mediante regresión logística. Se realizaronanálisisunivariados entre la variable dependiente (lesiones renales) y las variables independientes (seropositividad a cada serovar) y se incluyeron en el análisis multivariado aquellos con valor de p<0.2. La colinealidad entre las variables independientes incluidas en el modelo se evaluó a través del cálculo del Factor de inflación de la varianza (en inglés, Variance inflation factor -VIF) el cual resultó entre 1.11 y 2.11. El análisis fue realizado mediante el software SPSS v.25.
RESULTADOS
La seroprevalencia fue de 50.9% (IC95% 45-56%). En el Cuadro 1 se presentan los resultados por serovar, comprobándose que los mayores valores se presentan para Pomona, Icterohaemorragiae y Bratislava (p<0.001).
Cuadro 1 Seroprevalencia y niveles de anticuerpos en ocho serovares de Leptispora en 320 muestras de sangre obtenidos en bovinos en el matadero del cantón Manta, Ecuador
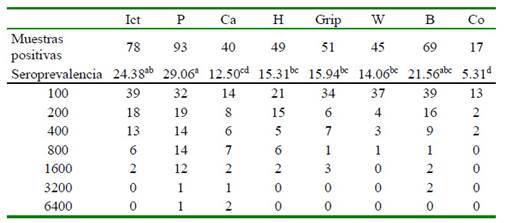
Letras desiguales por filas difieren significativamente (p<0.0001)
Ict= Icterohaemorragiae, P=Pomona, Ca=Canicola, H=Hardjo, Grip=Grippotyphosa, W=Wolffi, B=Bratislava, Co=Copenhageni
En el estudio anatomopatológico macroscópico se comprobó la presencia de RMB en 58 de los 320 animales estudiados, lo que representa 18.13% de prevalencia (IC95% 14.3-52.7%). En los RMB se observaron lesiones focales, multifocales y difusas que afectaban el parénquima renal, en la mayoría de los casos de forma bilateral (Figura 1).
Las alteraciones histopatológicas con NI se caracterizaron por la presencia de reacción inflamatoria, primordialmente de carácter crónico, afectando focalmente el tejido intersticial, pero con distribución fundamentalmente perivascular (Figura 2). La distribución del cuadro histopatológico no fue homogénea, presentándose en ocasiones, lesiones focales o difusas. También se observó la presencia de alteraciones de la pared de los túbulos renales (nefrosis), instaurándose un cuadro conocido como nefritis túbulointersticial (Figura 2).
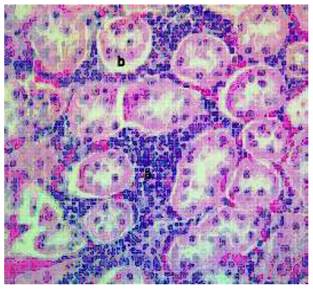
Figura 2 Cuadro de nefritis intersticial en riñón de bovino. (a) Reacción inflamatoria perivascular. (b) Alteraciones de la pared de los túbulos renales (nefrosis). H-E, 100X
Los resultados del estudio de riesgo se muestran en el Cuadro 2. Se comprueba la relación entre la positividad a Leptospira spp y la presencia de lesiones renales específicas de la enfermedad, mostrando que los animales seropositivos tienen 40 veces más probabilidad de presentar las mismas lesiones que los animales negativos.
Cuadro 2 Asociación entre la positividad a Leptospira spp y la presencia de lesiones renales de tipo "Riñones con Manchas Blancas" (RMB) en 320 bovinos sacrificados en el matadero del cantón Manta, Ecuador
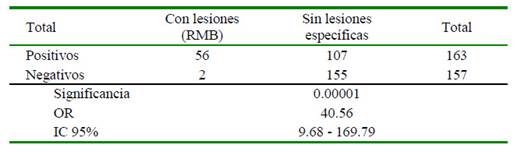
En el Cuadro 3 se puede apreciar la asociación entre la positividad a ocho serovares de Leptopira spp estudiadas y la presencia de lesiones renales de tipo RMB, comprobándose asociación significativa con los serovares Icterohaemorragiae, Canicola, Hardjo y Wolffi. Por otra parte, no se encontró asociación significativa entre la presencia de lesiones RMB con el sexo de los animales ni con el cantón de procedencia.
DISCUSIÓN
El monitoreo de Leptospira spp es muy importante debido a su potencial zoonótico y los problemas de salud que pueden derivarse de la infección en los animales y en el hombre (Oliveira Filho et al., 2012). En muchas ocasiones, la infección por bacterias del género Leptospira se presenta de forma subclínica y se detecta por la presencia de anticuerpos o por las lesiones de nefritis intersticial focal en la inspección de los animales al sacrificio (Bolin, 2005).
En el estudio realizado se demostró una elevada seroprevalencia de la enfermedad en los animales sacrificados; resultados que coinciden con los reportados por otros autores para Ecuador (Macias, 2003; Román-Cárdenas y Chávez-Valdivieso, 2016) y otros países (Ensuncho-Hoyos et al., 2017; Pulido-Medellín et al., 2017).
Se comprobó que 18.13% de los animales sacrificados presentaban RMB, resultado que corrobora lo que señalan otros autores sobre la existencia de un riesgo adicional, que muchos de los animales llevados al matadero para ser sacrificados puedan albergar infecciones crónicas o subclínicas que rara vez se detectan durante un examen de rutina ante mortem (Swai y Schoonman, 2012).
Se demostró que existe asociación entre la seropositividad de los animales y la presencia de RMB en la inspección al sacrificio, resultado que coincide con lo planteado en otros trabajos que señalan que algunos animales pueden permanecer por periodos prolongados como portadores de Leptospira, lo cual se asocia a la enfermedad renal crónica (Bolin, 2005). Dorjee (2009) demostraron en ovinos que la presencia de lesiones caracterizadas por manchas blancas en los riñones tiene 5.2 veces más probabilidad de ser seropositivos a Leptospira spp que aquellos que no las presentaban. Asimismo, Ayanegui turales se ha establecido la nefritis tubuloin- Acérreca (2006) demostraron en ciervos en tersticial linfoplasmocitaria como la lesión más Nueva Zelanda que las infecciones con títu-común asociada con infección crónica por los elevados con el serovar Pomona están leptospirosis (Tucunduva de Faria et al., 2007; asociados con una mayor frecuencia y seve-Zachary, 2016). ridad a lesiones renales.
La nefritis intersticial representa un amplio y diverso grupo de desórdenes caracterizados, primeramente, por fibrosis intersticial con infiltración de células mononucleares y atrofia tubular, que se pueden asociar a diferentes procesos de enfermedad; sin embargo, en condiciones experimentales y naturales se ha establecido la nefritis tubulointersticial linfoplasmocitaria como la lesión más común asociada con infección crónica por leptospirosis (Tucunduva de Faria et al., 2007; Zachary, 2016).
En el análisis de los serovares se comprobó que esta asociación solo se presenta con Icterohaemorragiae, Canicola, Hardjo y Woffi, lo que confirma la importancia de los resultados para la región estudiada, ya que los tres primeros más Pomona son los que afectan más frecuentemente el bovino (da Silva et al., 2005).
Los datos obtenidos en el matadero proveen de información geoespacial para los sistemas de vigilancia animal (Thomas-Bachli et al., 2012). En los esquemas de salud, los resultados de las inspecciones del matadero proporcionan retroalimentación a los productores y a los veterinarios de la situación sanitaria de sus rebaños, lo que les ayuda a aumentar la conciencia sobre la aparición de determinadas enfermedades (Sanchez Vazquez et al., 2011).
CONCLUSIONES
Los bovinos seropositivos a Leptospira spp tienen 40.56 veces más probabilidad de presentar lesiones renales, conocidas como Riñón con Manchas Blancas, que los animales seronegativos.
Esta relación se presenta, fundamentalmente, en los animales afectados por los serovares Icterohaemorrhagiae, Canicola, Hardjo y Wolffi.
Se encontró una seroprevalencia de 50.9% a Leptospira spp en los animales sacrificados en Manabí, Ecuador, mayormente para los serovares Pomona, Icterohaemorragiae y Bratislava












 uBio
uBio